液体培养真菌菌丝体及发酵液的高效分离方法
2015-07-01安子旋吕曼曼朱国栋张佩佩刘志华张荣沭
安子旋,吕曼曼,朱国栋,张佩佩,常 媛,刘志华,张荣沭*
(1.东北林业大学 园林学院,黑龙江 哈尔滨150040;2.东北林业大学 林学院,黑龙江 哈尔滨150040)
在微生物试验中,经常需要将液体培养的少量真菌菌丝体与其发酵液进行分离。在分离过程中由于不同属的真菌菌丝体的形态特征、菌丝之间纠结程度和发酵液粘稠度不同,采用不同的分离方法会导致不同的菌丝收集效果。当需要利用菌丝体提取其总RNA、DNA 和蛋白时,如果收集的菌丝体中残留少量的发酵液,其中的小分子化合物及蛋白等物质会干扰试验结果;相反,当需要研究真菌发酵液的特性及成分时,如果发酵液中残留菌丝体也会干扰试验结果。可见,采用高效的菌丝体与发酵液分离方法非常重要,将直接影响后续试验的进程及结果。目前,多数实验室均采用传统的高速离心法和真空抽滤法分离菌丝体和发酵液[1-5],然而,研究发现,这2种方法均存在操作步骤多、收集速度慢、耗电、成本高、对某些液体培养菌丝体收集效果差的缺点。为此,本研究建立一种快速节能的菌丝体与发酵液分离方法—多层纱布过滤法。为阐明多层纱布过滤法的优点和实用性,本研究选取不同种属具有代表性的6种真菌菌株,包括木霉属的棘孢木霉、毛壳属的球毛壳菌、核盘菌属的核盘菌、镰刀菌属的尖孢镰刀菌、链格孢属的链格孢菌和丝核菌属的立枯丝核菌的菌株[6],分别利用高速离心法、真空抽滤法及纱布过滤法从发酵液中收集菌丝体,通过比较其分离效果及试验成本,阐明纱布过滤法的多种优点,为同行提供一种快速节能、低成本的高效分离真菌菌丝体及发酵液的优良方法。
1 材料与方法
1.1 菌种来源及菌丝体获得
木霉属的棘孢木霉(Trichodermaasperellum)、毛壳属的球毛壳菌(Chaetomiumglobosum)、链格孢属的链格孢菌(Alternaliaalternate)、镰刀菌属的尖孢镰刀菌(Fusariumoxysporum)、核盘菌属的核盘菌(Sclerotiniasclerotiorum)和丝核菌属的立枯丝核菌(Rhizoctoniasolani)共6 种真菌菌种,均由东北林业大学森保学科提供(表1)。由于供试的6种真菌在液体PD 培养基中菌丝的繁殖速度不同,为了在同一时间能收集到适量菌丝体,采用不同的接菌量。其中,T.asperellum、A.alternate、F.oxysporum和C.globosum培养48h可获得适量菌丝体,S.sclerotiorum和R.solani菌丝的繁殖速度相对较慢,培养120h后可收获适量菌丝体。
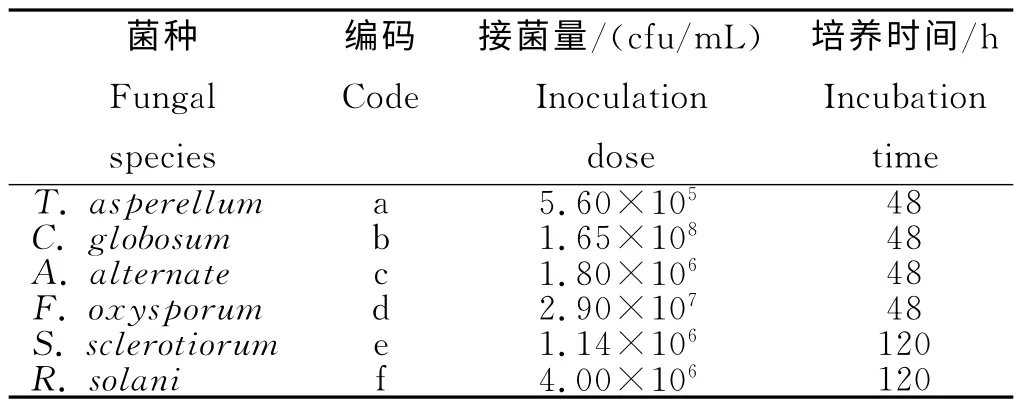
表1 供试真菌种类及其培养菌丝体的接菌量和培养时间Table 1 Different species of fungi and inoculums of the cultured mycelium
1.2 主要仪器与培养基
超净工作台,恒温振荡培养箱,减压抽滤装置,高压蒸汽灭菌锅,恒温水浴锅,超低温冰箱,台式冷冻离心机,凝胶成像系统,核酸鉴定仪。
马铃薯葡萄糖琼脂(PDA)固体培养基,马铃薯200g,葡萄糖20g,琼脂粉18g,H2O 1 000mL,pH自然。发酵培养基为不加琼脂粉的PD 液体培养基。
1.3 试验设计与培养方法
采用高速离心法、真空抽滤法及纱布过滤法从发酵液中收集菌丝体,比较3种方法的收集效果及试验成本。
菌种活化。4℃保存的菌种转接到新配制的PDA 斜面上,26℃培养5d,获得分生孢子。
菌丝体培养。将PDA 斜面上生长好的分生孢子用一定体积的无菌水稀释,测定孢子含量,将一定量的孢子悬液(表1)接入装有100mL 的PD 培养液的三角瓶中,26℃200r/min振荡培养。每种真菌均培养9瓶,分别用于高速离心法、真空抽滤法及纱布过滤法3种分离方法,每种分离方法设3次重复。
1.4 分离真菌菌丝体的方法
1.4.1 高速离心法 将6种真菌的发酵产物分别置于50mL离心管中,在20℃8 000r/min条件下离心10min,分离上清液,收集的菌丝体置于培养皿中。
1.4.2 减压抽滤法 6种真菌的发酵产物分别用抽滤装置进行常温减压抽滤,将菌丝体与发酵液分开。菌丝体保留在滤纸上,发酵液流入收集瓶中。
1.4.3 多层纱布过滤法 将折叠8层后的纱布放在培养皿中,分别将6种真菌的发酵产物平摊于纱布,操作者戴无菌乳胶手套,将纱布细心卷起,双手反向拧紧纱布,使发酵液与菌丝体分离,待无液体流下时,轻轻展开纱布,收集菌丝体。
1.5 测定方法
1.5.1 分生孢子计数 用血球计数器将真菌的孢子悬浮液在显微镜下计数。
1.5.2 菌丝体含水率 菌株培养一定时间后(表1),分别取不同菌种的发酵产物100 mL,采用高速离心、真空抽滤和纱布过滤3种方法收集菌丝体,精确称量菌体湿重(g),然后将菌体在105℃下烘干至恒重,精确称量干重。菌丝体含水率计算公式为:
菌丝体含水率=(菌丝体鲜重-菌丝体干重)/菌丝体鲜重×100%。
1.6 提取真菌菌丝体的总RNA
将采用不同方法收集的6种真菌菌丝体分别称取等重,液氮研磨。采用CTAB 方法[7]提取不同菌种、不同方法收集的菌丝体的总RNA。
1.7 数据处理
所有数据采用Excel 2007软件处理,结果以平均值±SD表示。采用Minitab 16统计软件(Minitab,Version 16)进行ANOVA 分析,比较各方法之间的差异性。
2 结果与分析
2.1 液体发酵培养获得的菌丝体
6种真菌发酵一定时间后,其菌丝体大量生长。这6个菌种的发酵产物在菌丝的形态、发酵产物颜色和粘稠度等方面差异很大(图1)。说明,研究选取的6种真菌各具代表性,且菌丝产量差异不大。
2.2 高速离心法分离的菌丝体与发酵液
采用高速离心法将真菌的发酵产物离心后,6种真菌均表现为菌丝体与发酵液分离,形成絮状或松散沉淀(图2-1)。用移液器将上清液分离后,将菌丝体置于培养皿中发现,由于菌丝体很轻(只有球毛壳菌的菌丝球坚硬),并且发酵液粘稠,导致离心后收集的菌丝体中仍含有少量发酵液(图2-2),说明,采用高速离心法很难将菌丝体与发酵液彻底分离。

图1 振荡培养一定时间后6种真菌的菌丝体Fig.1 State of the six fungal mycelium after shaking culture some time.

图2 高速离心法收集的菌丝体Fig.2 The mycelia collected by high speed centrifuging method
2.3 减压抽滤法分离的菌丝体与发酵液
采用减压抽滤法将真菌的发酵产物进行常温减压抽滤发现,6种真菌均表现为菌丝体与发酵液的分离速度差异极大(表2)。木霉菌的菌丝体与其发酵液很易分离,压力减为0.02kpa时,只用1min,发酵液快速被抽滤到收集瓶中。球毛壳菌、链格孢菌、尖孢镰刀菌的菌丝体则较难与其发酵液分离,在压力减至0.08kpa时,达到图3所示的分离效果,所需的抽滤时间分别为20 min、30 min和60min,而核盘菌和立枯丝核菌即使在压力减至0.08kpa条件下,抽滤时间达60 min,收集到的菌丝体中还能见到有发酵液存在(表2;图3-1中e和f),说明此方法用于收集不同菌种的菌丝体,其效果和用电成本存在很大差异。另外,收集的菌丝体与滤纸接合的紧密程度不同,如木霉、链格孢菌、尖孢镰刀菌的菌丝体与滤纸接合紧密,需要小心细致才能将其从滤纸上剥离。而球毛壳菌的菌丝球坚硬,与滤纸接合松散,较易剥离,但菌球并没有完全被抽瘪,仍含有一定水分。虽然试验中多数菌种的菌丝体与发酵液能很好地被分离,但这些菌丝体紧密附着于滤纸上,收集时间长,说明此方法用于不同菌种的分离,其分离效果、所用时间及成本均存在差异。
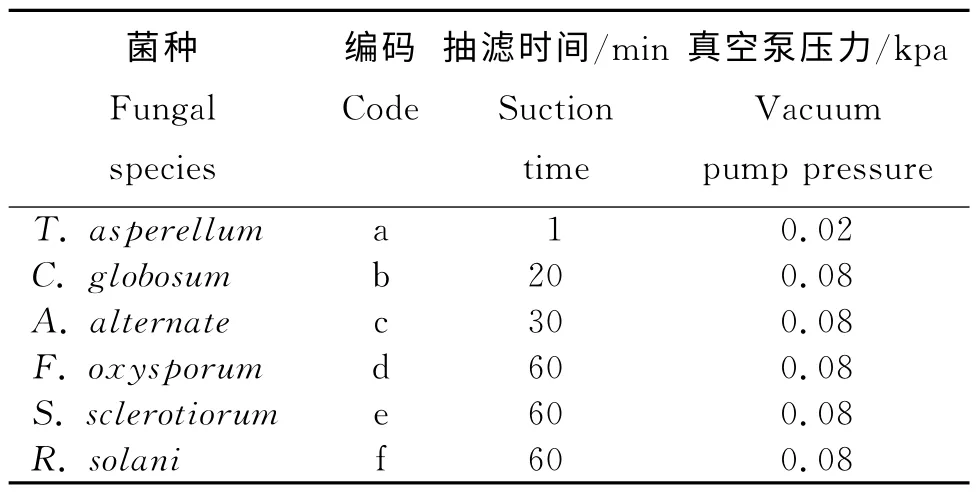
表2 6种菌丝体的抽滤时间和减压压力Table 2 Suction filtration time and decompression pressure

图3 减压抽滤法分离获得的菌丝体Fig.3 Mycelium was separated by the vacuum filtration method

图4 多层纱布过滤法分离的菌丝体Fig.4 The mycelium of six fungi was separately left on the dry gauze
2.4 多层纱布过滤法分离的菌丝体与发酵液
从图4可见,采用多层纱布过滤法(将真菌的发酵产物用拧压的力量)将菌丝体与发酵液分离,干燥菌丝体团块的边缘卷起,与纱布分离,易于剥离菌丝体。球毛壳菌坚硬的菌丝球也可以被压挤成片,脱水效果优于高速离心和减压抽滤法。说明,多层纱布过滤方法操作简单,成本低,无需使用电力设备,分离速度快,效果好。
2.5 不同分离法收集菌丝体的含水量
从表3看出,采用纱布过滤法收集的菌丝体的含水量均极显著低于高速离心法(P<0.01)。说明,纱布过滤法与高速离心法相比分离效果极好。另外,只有真菌S.sclerotiorum和R.solani采用纱布过滤法得到的菌丝体的含水量极显著低于减压过滤法(P<0.01),其他4种真菌(T.asperellum、C.globosum、A.alternate和F.oxysporum)分离获得的菌丝体的含水量与减压过滤法相比虽然略低,但未达极显著差异。说明,采用减压过滤法分离菌丝体并不适合对S.sclerotiorum和R.solani的分离,分离后菌丝中的含水量较高。因此,采用纱布过滤法将真菌菌丝体与其发酵液分离的效果也优于减压过滤法。
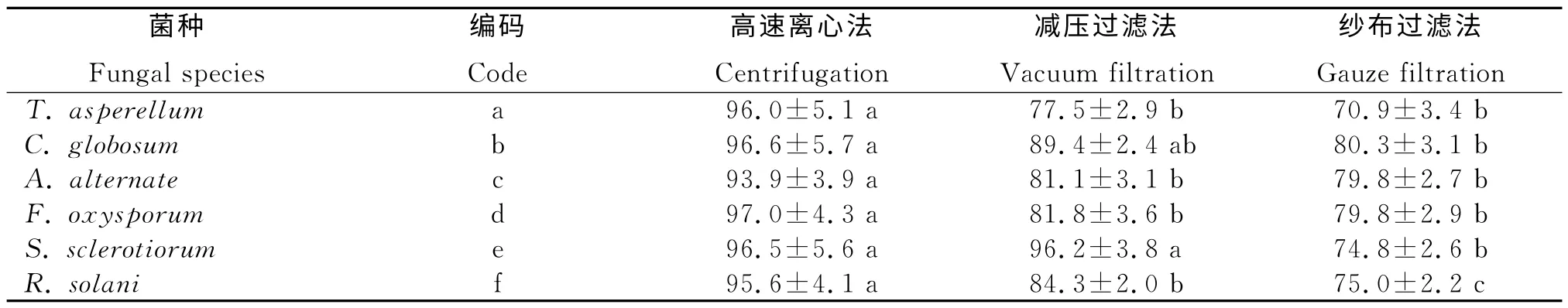
表3 不同分离方法获得的菌丝体的含水量Table 3 Moisture content of separating the mycelium by different methods %

表4 不同方法分离的菌丝体提取RNA的产量Table 4 The RNA yield of separating the mycelium in different methods
2.6 不同分离法收集菌丝体中提取的核酸质量和产量
采用CTAB方法提取不同菌种、不同方法收集的菌丝体的总RNA 结果(表4)表明,6种真菌分别采用3种分离方法收集的菌丝体中均能提取出总RNA,并且RNA 的OD 值均在1.9~2.1。说明,采用这3种分离方法获得的菌丝体中的RNA 均能满足后续试验的质量要求。但对于同一菌种,3 种分离方法收集的等量菌丝体中提取的总RNA 的产量差异较大,其中,以采用纱布过滤法收集的菌丝体,其提取的总RNA 产量最高。说明,采用纱布过滤法分离菌丝体,比高速离心和减压过滤法能获得更高的核酸产量。
3 结论与讨论
研究建立了一种快速节能的菌丝体与发酵液分离方法——多层纱布过滤法。该方法具有操作简单、分离速度快,节能,成本低,收集的菌丝体含水量低,以及不影响菌丝体中提取的核酸质量等许多优点,非常实用,值得推广。
目前,实验室中多采用传统的高速离心法和减压抽滤法将菌丝体与发酵液分离。本研究选取6个不同种属具有代表性的生长性状差异极大的真菌菌株,分别采用高速离心、减压抽滤和纱布过滤3种不同的分离方法收集菌丝体的效果表明,高速离心法即使离心速度很高也很难将真菌发酵产物中的菌丝体完全密实地沉降到试管底部,导致分离上清液后收集到的菌丝体仍含有较多的水分,分离效果不好。而减压抽滤法对这6种真菌的菌丝体进行分离时,对有些菌种的菌丝体收集效果好,对有些菌丝体的收集效果差,如收集的真菌S.sclerotiorum和R.solani的菌丝体的含水量仍然较高。并且,高速离心法和减压抽滤法均须采用电动仪器设备(如高速离心机、真空抽滤泵等),存在操作步骤多、收集速度慢、耗电、成本高等问题。而本研究建立的纱布过滤法,操作简单、成本低廉,只需要折叠8层、折叠后大小近似为30cm×12cm 的纱布、1副乳胶手套和1个15cm 直径的培养皿即可。该方法广泛适用于分离各种真菌的菌丝体及发酵液,与同行采用的传统的高速离心法和减压抽滤法相比,具有许多优点。由此可见,多层纱布过滤收集菌丝体的方法非常实用,具有极大的推广价值。
[1]陈建爱,杜方岭.黄绿木霉T1010对樱桃番茄横向土壤环境性状改良效果研究[J].农学学报,2011(8):36-41.
[2]Aggarwal R,Sharma V,Kharbikar L L,et al.Molecular characterization ofChaetomiumspecies using URP-PCR[J].Genetics Molecular Biology,2008,31(4):943-946.
[3]Fernando W G D,Nakkeeran S,Zhang Y,et al.Biological control ofSclerotiniasclerotiorum(Lib.)de Bary byPseudomonasandBacillusspecies on canola petals[J].Crop Protection,2007,26:100-107.
[4]苏惠春,程 波,傅冷西,等.3 种破壁方法提取念珠菌总RNA 效果的比较[J].中国真菌学杂志,2007,2(5):286-288.
[5]徐 健,陶洪文,陈 荫,等.厚藤共生真菌(Fusarium oxysporumY24-2)胞外多糖的化学组成和结构研究[J].中国海洋大学学报,2011,41(10):87-92
[6]刘志恒.现代微生物学[M].第2版.北京:科学出版社,2008.
[7]左瑞娟,周雨泫,李丽娟,等.CTAB 法用于染病烟草植株中烟草丛顶病毒RNA 的提取[J].云南农业大学学报,2011,26(1):26-29.
