培元抗癌汤对小鼠大肠癌肝转移模型血清中IL-12水平的影响
2015-11-11摘要目的建立小鼠大肠癌CT26肝转移模型研究培元抗癌汤对小鼠大肠癌肝转移模型血清中白介素IL12的影响方法将50只昆明小鼠随机分为5组每组各10只模型对照组阳性药对照组安康欣胶囊组培元抗癌汤大小剂量组以小鼠大肠癌CT26细胞悬液接种于小鼠脾脏建立大肠癌肝转移模型观察各组一般情况对肝脏转移结节做小鼠大肠癌肝转移癌抑瘤率的计算检测小鼠大肠癌肝转移模型血清中IL12的表达结果与模型对照组相比各用药组肝脏转移瘤质量均减轻均P05其中各用药组间无显著差异05安
【摘要】目的建立小鼠大肠癌(CT26)肝转移模型,研究培元抗癌汤对小鼠大肠癌肝转移模型血清中白介素(IL)-12的影响。方法将50只昆明小鼠随机分为5组(每组各10只):模型对照组、阳性药对照组(安康欣胶囊组)、培元抗癌汤大、中、小剂量组。以小鼠大肠癌(CT26细胞)悬液接种于小鼠脾脏,建立大肠癌肝转移模型。观察各组一般情况,对肝脏转移结节做小鼠大肠癌肝转移癌抑瘤率的计算,检测小鼠大肠癌肝转移模型血清中IL-12的表达。结果与模型对照组相比,各用药组肝脏转移瘤质量均减轻(均P<0.05),其中各用药组间无显著差异(P>0.05);安康欣胶囊组、培元抗癌汤大、中、小剂量组IL-12含量较模型对照组明显升高(均P<0.05)。结论培元抗癌汤可通过升高小鼠大肠癌肝转移模型血清中IL-12的表达,进而抑制小鼠大肠癌肝转移的发生及发展。
【关键词】大肠癌肝转移培元抗癌汤大肠癌肝转移IL-12
·实验报告·
培元抗癌汤对小鼠大肠癌肝转移模型血清中IL-12水平的影响
王乾1张泳1杨兴武1王建华1时丹丹2△
(1.陕西中医学院附属医院,陕西咸阳712000;2.陕西中医学院第二附属医院,陕西咸阳712000)
【摘要】目的建立小鼠大肠癌(CT26)肝转移模型,研究培元抗癌汤对小鼠大肠癌肝转移模型血清中白介素(IL)-12的影响。方法将50只昆明小鼠随机分为5组(每组各10只):模型对照组、阳性药对照组(安康欣胶囊组)、培元抗癌汤大、中、小剂量组。以小鼠大肠癌(CT26细胞)悬液接种于小鼠脾脏,建立大肠癌肝转移模型。观察各组一般情况,对肝脏转移结节做小鼠大肠癌肝转移癌抑瘤率的计算,检测小鼠大肠癌肝转移模型血清中IL-12的表达。结果与模型对照组相比,各用药组肝脏转移瘤质量均减轻(均P<0.05),其中各用药组间无显著差异(P>0.05);安康欣胶囊组、培元抗癌汤大、中、小剂量组IL-12含量较模型对照组明显升高(均P<0.05)。结论培元抗癌汤可通过升高小鼠大肠癌肝转移模型血清中IL-12的表达,进而抑制小鼠大肠癌肝转移的发生及发展。
【关键词】大肠癌肝转移培元抗癌汤大肠癌肝转移IL-12
大肠癌是西方国家高发肿瘤之一,发病率位居第2。近20年来,我国大肠癌发病率以平均每年4.2%的速度增加[1]。大肠癌发病率上升至恶性肿瘤的第4位。大肠癌早期虽无明显症状,但就诊时却有15%~35%的患者已发生转移,其中肝脏是最常见也是最重要的转移部位,进展期患者肝转移发生率高达50%~70%左右,可切除者5年生存率为11.5%~45%,保守治疗患者平均生存期只有4~9个月,故肝脏转移是导致大肠癌患者死亡的重要原因之一[2]。因此,提高大肠癌肝转移的早期诊断及治疗,对提高大肠癌患者的生存率及改善预后有极其重要的意义。培元抗癌汤是具有扶正活血化瘀抗癌的方剂,其具有抑瘤、抗转移、防复发的作用。本实验通过培元抗癌汤对小鼠大肠癌细胞(CT26)肝转移模型血清白介素(IL)-12表达水平的影响,发现该方对小鼠大肠癌肝转移模型中小鼠肿瘤的生长有明显的抑制作用。现报告如下。
1 材料与方法
1.1药物经验方培元抗癌汤,由西洋参、白花蛇舌草、炒白术、黄芪、土茯苓、仙鹤草、厚朴、炙甘草等组成[3]。生药均购自陕西中医学院第一附属医院中药房,于冷水中浸泡2 h,加热至沸腾后2 h,滤液;再加入冷水加热煮沸1.5 h,滤液;将两次滤液混合,混合后的滤液放置水浴锅中制备使生药含量为3.0 g/mL的煎剂,高温消毒后于4℃冰箱保存备用。安康欣胶囊(安徽高山药业有限公司)。5%水合氯醛与注射用青霉素钠等(购自陕西中医学院第一附属医院)。
1.2动物健康昆明小鼠50只,雌雄各半,年龄6~8周,体质量18~22 g,由西安市长安区斗门实验动物养殖场提供。小鼠大肠癌细胞株CT26由(西安润德生物技术有限公司)提供。
1.3造模及给药小鼠CT26细胞用含10%小牛血清的RPMI1640培养基(内加10 mmol/L HEPES、4.5 g/L葡萄糖、1.0 mmol/L丙酮酸钠、0.1 mmol/L非必需氨基酸、0.4 mg/mL G418),置于37℃、50 mL/L CO2恒温箱中培养。取对数生长期细胞进行实验。取对数生长期细胞,用0.25%胰蛋白酶及0.02%EDTA消化收集细胞,PBS洗涤重悬制成单细胞悬液。台盼蓝染色测定活细胞率≥90%。术前进行麻醉预试验,根据麻醉预试验结果选取5%水合氯醛(5 mg/kg)麻醉,左肋缘下切口开腹,显露脾脏,用1 mL注射器于脾被膜下缓慢注射浓度为1×106个/mL的CT26单细胞悬液0.1 mL,止血后把脾脏送回腹腔,全层缝合关腹。50只昆明小鼠造模后第2日,随机分成5组:模型对照组9只,每日正常喂养;安康欣胶囊组10只,每日灌胃0.4 mL(27 mg/kg,每毫升含生药50 mg);培元抗癌汤小剂量组10只,每日灌胃0.4 mL(30 g/kg,每毫升含生药1.5 g);培元抗
1.3标本采集及检测(1)一般情况观察:造模用药后,观察每组小鼠的进食、饮水、毛色变化、活动情况、对刺激的反应,有无腹泻、消瘦、死亡等情况,并随时记录。(2)出瘤时间的观察。(3)测肝转移癌结节重及去瘤后体质量,计算抑瘤率:15 d后各组小鼠断颈处死,将血收集至离心管,迅速打开腹腔分离出肝脏,去除血污等非肿瘤组织,用天平(分析天平精确1/10000 g)称瘤重,计算抑瘤率。抑瘤率=(对照组平均瘤重-用药组平均瘤重)/对照组平均瘤重×100%。(4)ELISA法检测小鼠血清IL-12的表达。双抗体夹心法测定标本中小鼠IL-12水平。取纯化的小鼠IL-12抗体包被微孔板,制成固相抗体,将包被单抗的微孔中依次加入小鼠IL-12,再与HRP标记的羊抗鼠抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的IL-12呈正相关。酶标仪下450 nm波长测定吸光度(OD值),通过标准曲线计算样品中小鼠IL-12浓度。
1.4统计学处理应用SPSS18.0统计软件。计量资料以(±s)表示,多样本均数间比较用单因素方差分析,多样本均数间两两比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1一般情况观察造模前所有小鼠均活跃,体毛均匀致密,进食饮水良好,生长状况良好。第5日:各组小鼠均存活,培元抗癌汤组、安康欣胶囊组小鼠进食、饮水良好,活动灵活,反应敏捷,毛色欠光泽,未见腹泻及消瘦,未见恶液质出现;模型对照组小鼠消瘦,毛色枯槁,活动欠灵活,腹部出现不同程度膨隆,反应尚可。第7日:培元抗癌汤组、安康欣胶囊组小鼠开始出现饮食减少、消瘦,精神变差,腹部出现膨隆;模型对照组动物瘦弱明显,毛色干枯。第10日:培元抗癌汤组、安康欣胶囊组小鼠饮食明显减少、消瘦,精神变差;模型对照组动物瘦弱更明显,有个别动物恶液质现象发生。第15日:除模型对照组1只因恶液质死亡外,均存活。
2.2各组小鼠出瘤时间的观察见表1。培元抗癌汤组、安康欣胶囊组出瘤时间与模型组比较有显著差异(P<0.05),培元抗癌汤各组与安康欣胶囊组之间比较,差异无统计学意义(P>0.05)。
2.3各组间转移瘤质量和抑瘤率比较见表2。用药组转移瘤质量明显小于模型对照组(P<0.05),用药组之间比较,差异无统计学意义(P>0.05),表明培元抗癌汤与安康欣胶囊对转移瘤均有抑制作用。
2.4各组间小鼠血清IL-12表达水平的测定见表3。与模型对照组比较,培元抗癌汤各组和安康欣胶囊组均能升高小鼠大肠癌细胞(CT-26细胞)肝转移小鼠IL-12表达水平(P<0.05),培元抗癌汤各组和安康欣胶囊组比较,差异无统计学意义(P>0.05)。
表1 各组小鼠岀瘤时间比较(d,±s)

表1 各组小鼠岀瘤时间比较(d,±s)
与模型对照组比较,*P<0.05。下同。
组别n模型对照组9安康欣胶囊组10培元抗癌汤大剂量组10出瘤时间5.30±0.82 7.10±0.99*6.90±0.99*培元抗癌汤中剂量组106.40±0.84*培元抗癌汤小剂量组106.36±0.99*
表2 各组间转移瘤质量和抑瘤率比较(±s)
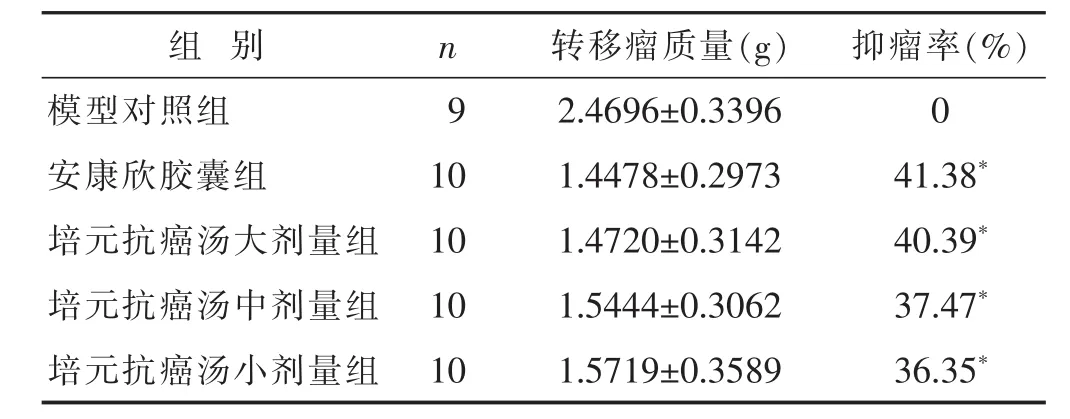
表2 各组间转移瘤质量和抑瘤率比较(±s)
组别n模型对照组9安康欣胶囊组10培元抗癌汤大剂量组10培元抗癌汤中剂量组10培元抗癌汤小剂量组10转移瘤质量(g)抑瘤率(%)2.4696±0.33960 1.4478±0.297341.38*1.4720±0.314240.39*1.5444±0.306237.47*1.5719±0.358936.35*
表3 各组小鼠血清IL-12表达水平比较(pg/mL,±s)

表3 各组小鼠血清IL-12表达水平比较(pg/mL,±s)
组别n模型对照组9安康欣胶囊组10培元抗癌汤大剂量组10 IL-12 25.87±0.97 27.67±1.03*27.78±1.73*培元抗癌汤中剂量组1028.01±2.13*培元抗癌汤小剂量组1027.41±1.58*
3 讨论
约20%大肠癌患者在确诊的同时发现有肝转移,40%发生异时肝转移。如不治疗,大肠癌肝转移生存4.8~9.8个月者仅50%,2年生存率仅3%,4年生存率为0,预后较差。因此,研究大肠癌转移及抗转移的机理对于大肠癌防治具有十分重要的意义。这些研究必需借助于适当的动物模型,为此本实验建立了小鼠CT26脾种植肝转移小鼠模型。在本研究中,经脾接种癌细胞的50只小鼠,除了1只造模后死亡外,其他小鼠均有不同程度的肝转移,其肝脏表面分布有大小不等的不规则结节,转移率为96%,成功率较高。
恶性肿瘤的发展过程中,肝脏是比较常见的转移器官之一,单发转移结节可积极外科手术治疗,但弥漫性多发肝转移结节则缺乏有效治疗方法。近年来,免疫治疗、基因治疗为肝转移肿瘤治疗开辟了新的路径。而IL-12被认为是细胞免疫应答过程中的关键调节因子[5-6],已成为肿瘤免疫治疗及综合治疗中的热点。
培元抗癌汤是根据中医基础理论,通过丰富的临床经验,在大量临床应用的基础上,结合现代药理学研究进展,精心研制成的抗恶性肿瘤发生、发展、复发和转移的中药制剂。“正气存内,邪不可干”,“邪之所凑,其气必虚”。疾病的发生、发展都是因正、邪相争,正气不足,正不胜邪而致,肿瘤的发生、发展和转移亦然,故治疗当以《难经》所言之“补不足,损有余”,即以扶正祛邪为立方原则。肿瘤从发生至转移必先因正气不足,后疾病发展而致正气更虚,因此,扶正固本抗癌在治疗肿瘤的过程中意义重大。肿瘤的主要特征是“肿块、固定不移、痛有定处”等,其从形成开始,就存在“瘀血内阻”的现象。“气为血之帅,血为气之母”,气能摄血行血,血能载气化气,气虚则血行无力而致瘀血,瘀血内阻化气受限,则气虚更重。气虚血瘀互为因果,形成恶性循环。故肿瘤早期以血瘀为主,中期气虚血瘀并重,到晚期则以气血两虚为主,基本病机是气虚血瘀,虚实夹杂,故以益气活血化瘀,扶正培本抗癌为治法。培元抗癌汤主要由西洋参、白花蛇舌草、炒白术、黄芪、土茯苓、仙鹤草、厚朴、炙甘草等组成,方中西洋参味甘、微苦,性凉,能益气养阴,清火生津;白花蛇舌草与西洋参同用可清热生津、补气养阴、解毒、抗癌,二者一攻一补,共奏益气养阴、活血化癖之效,且驱邪不伤正,共为君药。白术健脾化湿,研究表明其能使免疫功能低下的小鼠的TH细胞数明显增加,提高TH/TS比值,纠正TC细胞亚群分布紊乱状态,可使低下的IL-2水平显著提高,并能增加T淋巴细胞表面IL-2R的表达[6];黄芪,味甘,性微温,归肺、脾经,功能补中益气,益卫固表,健脾利水,托毒生肌;仙鹤草具有攻坚活血、化瘀散结止痛的功效,现代药理证实,仙鹤草有抑制肿瘤细胞增殖的作用;土茯苓具有解毒、除湿、利关节的功效,可用于治疗梅毒、淋浊、肿瘤等疾病,土茯苓总皂苷具有一定的抗肿瘤活性;甘草补脾益气、清热解毒、缓急止痛、调和诸药。诸药合用,共奏益气养阴,活血化瘀,解毒消积止痛,充分体现了扶正而不留邪,驱邪而不伤正的治疗原则。
综上所述,培元抗癌汤中诸药具有直接抑瘤或杀瘤细胞作用,能增强宿主免疫功能,抑制血栓形成及抗菌消炎。本研究结果示,培元抗癌汤对小鼠CT26肝转移小鼠肿瘤组织及肿瘤细胞的浸润转移具有抑制作用,提升血清中IL-12的表达,这可能是其抗恶性肿瘤发生发展的作用机理之一,其确切机理有待进一步研究。
[1]Xu XL,Yu J,Zhang HY,et al.Methylation profile of thepromoter CpGislands of 31genesthatmay contribute to colorectal carcinogenesis[J].World J Gastroenterol,2004,10(23):3441-3454.
[2]董志伟,谷铣之.临床肿瘤学[M].北京:人民卫生出版社,2002:941-969.
[3]王庆才.仲景方药与肿瘤临床[J].辽宁中医杂志,2000,27(8):344.
[4]秦伯益.新药评价概论[M].北京:人民卫生出版社,1998:339.
[5]Kobayashi M,Fitz L,Ryan M,et al.Identification and purification of naturalkiller cell stimulatory factor(NKSF),a cytokine withmultiple biologic effectson human lymphocytes[J]. J Exp Med,1989,170(3):827-845.
[6]顾奎兴.恶性肿瘤中医治疗[M].南京:江苏科学技术出版社,2005:9.
R285.5
A
1004-745X(2015)01-0109-03
10.3969/j.issn.1004-745X.2015.01.039
(电子邮箱:shidan0324@163.com)癌汤中剂量组10只,每日灌胃0.4 mL(40 g/kg,每毫升含生药2.0 g);培元抗癌汤大剂量组10只,每日灌胃0.4 mL(60 g/kg,每毫升含生药3.0 g)。每日给药1次,连续用药15 d。
2014-10-12)
