枸杞多糖对大鼠睾丸支持细胞体外增殖的影响*
2015-11-11南亚昀李阳雍学芳王礼星吕金捍
南亚昀 李阳 雍学芳 王礼星 吕金捍
(宁夏回族自治区人民医院,宁夏银川750002)
·研究报告·
枸杞多糖对大鼠睾丸支持细胞体外增殖的影响*
南亚昀李阳雍学芳王礼星吕金捍△
(宁夏回族自治区人民医院,宁夏银川750002)
目的观察枸杞多糖对体外培养的大鼠睾丸支持细胞的增殖作用。方法选8~9 d龄的大鼠,采用两步酶消化法获取原代大鼠睾丸支持细胞,加入不同质量浓度的枸杞多糖,采用MTT比色法、直接细胞计数及CFSE荧光标记,检测不同质量浓度枸杞多糖对体外培养别的睾丸支持细胞增殖的影响。结果与对照组相比,经枸杞多糖处理后的睾丸支持细胞数量明显增多,并呈剂量依赖性。结论枸杞多糖能够促进大鼠睾丸支持细胞体外增殖。
枸杞多糖睾丸支持细胞体外细胞增殖
枸杞子性平、味甘,具有滋补肝肾、益精明目的功效,现代临床广泛用于抗衰老、降血糖、保肝及提高机体免疫等多个方面。枸杞多糖是枸杞主要成分之一,近年来对枸杞多糖的药理作用进行了广泛的研究,证实其具有免疫调节[1]、抗骨质疏松[2]、抗肿瘤[3]等功能。睾丸支持细胞(SCs)在曲细精管中,各级生精细胞镶嵌在支持细胞上,SCs为生精细胞提供支架。同时,SCs能够分泌类固醇类、激素类、调节蛋白类、生长因子类、旁分泌因子、转运蛋白类等为生精细胞分化成熟提供稳定的环境及必须的能量物质,保证精子正常有序的发生。因此,笔者研究了枸杞多糖对大鼠SCs体外增殖的影响,以期为枸杞多糖治疗生殖障碍提供理论依据。
1 材料与方法
1.1材料CFSE(日本同仁化学研究所)、Trypsinase、Trypan blue(碧云天生物试剂有限公司)、MTT、CollagenaseⅣDimethyl sulfoxide(DMSO)、HEPES、BSA、Nitro Blue Tetrazolium(美国Sigma公司)、DMEM-F12 medium(Gibco Laboratories)、胎牛血清、青霉素和链霉素(美国Hyclone公司)、枸杞多糖(西安华萃生物科技有限公司)。SPF级雄性8~9 d SD大鼠(由第四军医大学实验动物中心提供)。
1.2原代SCs的分离及培养用脱颈法处死大鼠后无菌收集双侧睾丸,将睾丸放入盛有预冷PBS的培养皿中,剥除脂肪垫、附睾及白膜,将睾丸组织机械剪碎后采用两步酶消化法进行处理。将睾丸实质部分转入盛有3 mL 0.25%胰酶的离心管内,在37℃孵箱中消化15~20 min,至生精小管分散呈云雾状后终止消化,800×g离心5 min,D-hank’s液洗涤2次。在离心管中加入3倍于睾丸实质体积的CollagenaseⅣ(2 g/L),在37℃恒温振荡器中缓慢振荡消化40 min,至生精小管呈糊状后终止消化,向离心管中加入含10%胎牛血清的培养基DMEM/F12,吹打消化液,使细胞充分分离,200目尼龙筛网过滤,800 g离心5 min,弃去上清,以D-hank’s液重悬细胞,再以800×g离心5 min洗涤2次,用DMEM/F12培养液接种至25 mL培养瓶。体外培养4 h后,小心倾斜培养皿,将未贴壁的精原细胞随培养液一同吸去,加入含体积分数为10%胎牛血清的DMEM/F12完全培养液,37℃培养36~48 h,待Sertoli细胞伸出细胞突起,加入20 mmol/L Ttris-HCl低渗处理细胞3 min,用Hanks’s液清洗3次,加入DMEM/ F12完全培养液继续培养。
1.3实验分组空白对照组:细胞中只加入含10%胎牛血清的DMEM/F12培养液;给药组:25μg/mL、50μg/mL、100 μg/mL、200 μg/mL共5组。
1.4MTT细胞计数原代培养的SCs接种到96孔板中,细胞密度调整为1.0×104/孔,无血清培养36 h,加入LBP,使其终质量浓度分别为25、50、100、200 μg/mL,对照组每孔只加无血清培养基,每孔液体量均为200μL,置于饱和湿度、37℃、5%CO2培养箱中继续培养36 h后终止培养,弃去培养液,每孔加入5 mg/mL MTT 20 μL,继续孵育4 h,去上清加DMSO 150 μL/孔,充分振荡10 min,待结晶充分溶解,用酶标仪测定支持细胞570 nm波长的OD值。
1.5直接细胞计数将细胞以密度4×104接种于48孔板,待细胞完全贴壁,按照上述实验分组,每组加入相应质量浓度的药物。36 h后终止培养,加入胰酶消化,充分吹打细胞,显微镜下观察无细胞残留在培养板内即可。细胞悬液吸出少许,滴加在盖片边缘计数。细胞数计算公式:细胞数/mL=四大格细胞总数/4×104。
1.6流式细胞术计数将细胞接种于6孔板中,每组设至少3个复孔。将细胞加入适量PBS洗1遍。加入胰酶于37℃孵箱消化,800 r/min离心5 min,加入无Ca2+和Mg2+的PBS洗1遍,弃去上清,加入1 mL无Ca2+和Mg2+的PBS或无血清培养液,重悬细胞,在细胞中加入浓度为5 μmol/L CFSE工作液,于37℃孵育10~30 min后,用40%体积的冷小牛血清立即终止标记5~10 min或加入含血清的培养基于冰上或4℃终止消化,800 r/min离心5 min,洗涤两次后,加入上述药物干预36 h,收取细胞至1.5 mL的EP管中,于激发波长500 nm,发射波长520 nm处流式细胞仪检测荧光强度。
1.7统计学处理应用SPSS13.0统计软件。计量资料以(±s)表示。P<0.05为差异有统计学意义。
2 结果
2.1MTT实验结果见表1。由表1可以看出,随着枸杞多糖剂量的增加,细胞的吸光度值相应的升高,说明SCs随着枸杞多糖剂量的增加其增殖能力越强。当枸杞多糖质量浓度为25 μg/mL及50 μg/mL时,与对照组相比无明显差异(P>0.05),当增加至100 μg/mL以上时,与对照组相比,细胞增殖明显(P<0.05或P<0.01)。
2.2直接细胞计数的结果见表2。表2显示,枸杞多糖对SCs体外增殖的影响与MTT检测结果一致,SCs的体外增殖枸杞多糖之间呈量效关系,随着枸杞多糖剂量的增加(除了25 μg/mL及50 μg/mL组),枸杞多糖促进SCs增殖的作用更加明显(P<0.01)。
表1 MTT检测枸杞多糖对SCs增殖影响的结果(±s)
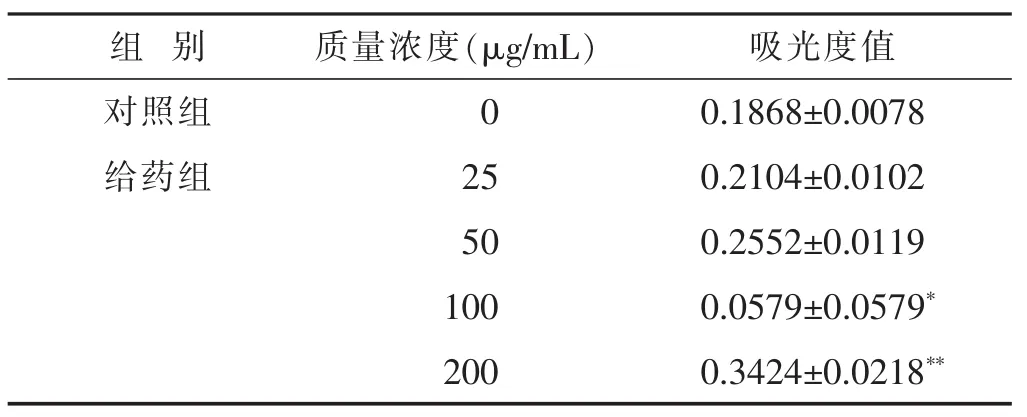
表1 MTT检测枸杞多糖对SCs增殖影响的结果(±s)
与对照组比较,*P<0.05,**P<0.01。下同。
组别质量浓度(μg/mL)对照组0给药组25 50吸光度值0.1868±0.0078 0.2104±0.0102 0.2552±0.0119 1000.0579±0.0579*2000.3424±0.0218**
表2 直接细胞计数检测枸杞多糖对SCs增殖影响的结果(×104/mL,±s)

表2 直接细胞计数检测枸杞多糖对SCs增殖影响的结果(×104/mL,±s)
组别质量浓度(μg/mL)对照组0给药组25 50细胞数量7.3516±0.0809 8.2506±1.0101 10.7162±2.5781 10014.7972±1.2790**20016.5831±2.3140**
2.3流式细胞仪检测结果见表3。随着枸杞多糖剂量的增加,除了25 μg/mL及50 μg/mL组之外(P>0.05),其余各组与对照组相比,SCs增殖更加明显(P<0.05或P<0.01),枸杞多糖能够显著促进SCs的体外增殖,与MTT及直接细胞计数的结果一致,3种实验方法互相补充,互相印证,更加证明了枸杞多糖促进SCs体外增殖的作用。
表3 流式检测枸杞多糖剂量与SCs荧光强度关系的结果(±s)

表3 流式检测枸杞多糖剂量与SCs荧光强度关系的结果(±s)
组别质量浓度(μg/mL)对照组0给药组25 50荧光强度1471.32±132.91 1038.01±129.87 970.08±105.88 100586.61±87.42*200265.82±59.43**
3 讨论
近年来研究发现枸杞多糖对雄性生殖系统具有保护作用。研究证实枸杞多糖能够降低高温所致的生精细胞损伤,并且枸杞多糖能提高半去势大鼠的性功能,其作用机制不仅是提高抗氧化作用,而且通过调节下丘脑-垂体-性腺轴的功能而实现的[4]。实验证实枸杞多糖能抑制细胞色素C(Cyt C)自线粒体的释放,从而使Caspase-3的活化减少,导致生精细胞的凋亡减少,推断其通过线粒体途径抑制生精细胞的凋亡而起到保护睾丸组织的作用[5]。在体外培养的精原干细胞培养液中单独加入枸杞多糖后其增殖能力明显增强[6]。
文献报道,SCs在雄性小鼠出生后10 d不再增殖[7],在雄性大鼠出生15 d后不再增殖[8],在男性出生10岁之后停止增殖[9],其数量处于恒定状态。同时SCs的数量决定着精子的数量,其功能又决定着精子的质量,所以不难看出,SCs在男性生殖系统中重要的作用。SCs及其形态结构是1985年由Enrico Sertoli首次发现并报道的存在于生精上皮中的一种大细胞。在胚胎发育时期,SCs在睾丸的结构发育方面有重要的作用[10]。然而,在成年时期,SCs只用于支撑精子的发生。成熟的SCs为干细胞提供结构与营养支持、辅助它们的移动、提供输精液及支持精子细胞的排放[11]。更重要的是一个SCs只能支持有限的干细胞数量,因此,最终成年睾丸的大小及精子数量与SCs的数量呈直接关系[12]。不仅在向生精上皮传递促性腺激素过程中发挥着不可取代的中枢作用,而且还具有分泌、营养、释放、支持、免疫豁免及吞噬等多种功能[13-14]。
本实验表明枸杞多糖能够明显促进大鼠SCs体外增殖,并且呈剂量依赖性,根据目前的实验结果推断其作用方式如下:(1)增加细胞营养。枸杞多糖含有微量元素、氨基酸及多种单糖,对体外培养的支持细胞进行营养供给;(2)抗氧化。枸杞多糖具有抗氧化的作用[15],支持细胞在体外培养过程中可能会受到氧自由基的损伤,枸杞多糖可能通过清除细胞体外培养环境中的氧自由基,保持细胞的增殖能力;(3)抑制细胞凋亡,延缓细胞衰老。本实验已明确枸杞多糖对体外培养的SCs的增殖作用,下一步将通过实验证实其作用机制。
[1]董永杰,单铁英,岳峰,等.枸杞多糖对淋巴细胞功能的影响[J].现代中西医结合杂志,2010,19(19):2362-2363.
[2]Ma Feng,Gao Jun,Wang Yi-nong,et al.Effects of serum containing Lycium barbarum polysaccharides on the intracellular Ca2+concentration and the expression of collagen typeⅠin MC3T3-E1 cells in vitro[J].Chinese Journal of Tissue Engineering Research,2012,16(20):3733-3736.
[3]马秀梓,孙润广,李佳媚,等.3种中药多糖抗肿瘤作用的研究[J].陕西师范大学学报,2012,40(6)77-80.
[4]罗琼,黄晓兰,李卓能,等.枸杞多糖对雄性大鼠性功能及生殖功能的影响[J].营养学报,2006,28(1):62-65.
[5]TAN Qiu-hui,AN Chang-xin,XIAO Yun,et al.Protective effect of lycium barbarum polysaccharides against heat stressinduced germ cell apoptosis in rats and its mechanism[J].National Journal of Andrology Zhonghua Nan Ke Xue Za Zhi,2012,18(1):88-92.
[6]Ma Liang-hong,Qiu Zhi-jun,Yan Sheng-nan,et al.Influence of lycium barbarum polysaccharides on proliferation of spermatogonial stem cells in vitro[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2011,15(23):4277-4281.
[7]刘红云,张才乔.禽类下丘脑—垂体—性腺轴的内分泌调节[J].中国兽医杂志,2006,42(9):41-43.
[8]于利.大鼠睾丸的Sertoli细胞的分离纯化及体外培养[J].辽宁医学院学报,2008,29(3):204-205.
[9]Stefanio S,Morena AR,Petersen C,et al.A rapid method of sertoli cell isolation by DSA lectin,allowing mitotic analyses[J].Mol Cellu Endocrinol,1998,146(1-2):121-127.
[10]Brennan J,Capel B.One tissue,two fates:molecular genetic events that underlie testis versus ovary development[J].Nat Rev Genet,2004,5,509-521.
[11]Jegou B.The Sertoli cell[J].Baillieres Clin Endocrinol Metab,1992,6:273-311.
[12]Orth JM,Gunsalus GL,Lamperti AA.Evidence from Sertoli cell-depleted rats indicates that spermatid number in adults depends on numbers of Sertoli cells produced during perinatal development[J].Endocrinology,1988,122:787-794.
[13]Touyz RM,Jianq L,Sairam MR.Follicle-stimulating hormone mediated calcium signaling by the alternatively spliced growth factor type l receptor[J].Biol Reprod 2000,62(4):1067-1074.
[14]Laslett AL,Li LH,Jester WF,et al.Thyroid hormone downregulates neural cell adhesion molecule expression and affects attachment of gonocytes in Sertoli cell-gonocyte cocultures[J].Endocrinology,2000,141(5):1633-1641.
[15]陈智松,吴志奎,陈玉英,等.枸杞多糖对衰老小鼠脑NO、NOS的影响[J].中药药理与临床,2000,16(6):16-18.
Effect of Lycium Bararum Polysaccharides on Rat Sertoli cells in Vitro
NAN Yayun,LI Yang,YONGXuefang,et al.Ningxia People′s Hospital,Ningxia,Yinchuan 750002,China
Objective:To detect the effect of lycium bararum polysaccharides(LBP)on the proliferation of sertoli cells(SCs)cultured in vitro.Methods:Primary SCs were separated from 8~9 days male mice by two-step enzyme digestion method.SCs were cultured with LBP at different concentrations in vitro.The quantity of live cells was determined by MTT assay,direct cell counting and fluorescence intensity methods.Results:Compared with the control group,cell viability was significantly promoted after treatment with LBP and the percentage of cell survival in a dose dependent manner.Conclusion:LBP promoted SCs proliferation both in concentration-effect manner in vitro.
Lycium barbarum polysaccharides;Sertoli cells;Vitro;Proliferation
R285.5
A
1004-745X(2015)01-0035-03
10.3969/j.issn.1004-745X.2015.01.012
2014-10-08)
宁夏回族自治区自然科学基金资助项目(NZ13187)
(电子邮箱:lvjhan_2014@yeah.com)
