卵转铁蛋白双抗夹心ELISA方法的建立
2015-11-01李晶王薇张燕陆旸王硕
李晶,王薇,张燕,陆旸,王硕,*
(1.天津出入境检验检疫局工业产品安全技术中心,天津300308;2.食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
卵转铁蛋白双抗夹心ELISA方法的建立
李晶1,王薇2,张燕2,陆旸2,王硕2,*
(1.天津出入境检验检疫局工业产品安全技术中心,天津300308;2.食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津300457)
卵转铁蛋白是鸡蛋中的主要过敏原,针对鸡蛋中主要过敏原卵转铁蛋白建立了双抗夹心ELISA方法,该方法检出限为(15.37±1.20)ng/mL。除白蛋白外,该方法对粘蛋白、溶菌酶、α-乳白蛋白、牛奶总蛋白、β-乳球蛋白、酪蛋白、花生总蛋白、大豆、杏仁和绿豆等致敏蛋白几乎没有交叉反应。板内重复性和板间重复性较好,因此所建立的方法可用于对卵转铁蛋白的检测。
卵转铁蛋白;双抗夹心ELISA方法;过敏原
鸡蛋是人们日常生活中最廉价的蛋白质来源。由于含有丰富的营养物质,其被广泛用于包括米粉等在内的婴幼儿辅食中[1-2]。然而近年来,对其过敏的人数却呈逐年上升趋势。鸡蛋的过敏原主要存在蛋清中分别是卵类粘蛋白、卵白蛋白、卵转铁蛋白和溶菌酶[3-6]。其中卵转铁蛋白来源于鸡血清中,占蛋清中蛋白总量的12%[7]。
目前对致敏蛋白的检测方法主要包括PCR法和免疫分析方法[8-12]。然而,普通PCR方法只用于定性或是半定量分析。相比之下,基于免疫学方法的酶联免疫检测技术能够实现定量检测,且具有高效、灵敏和低成本等优点。因此,本文利用此项技术建立并优化了用于食品中卵转铁蛋白含量对的双抗夹心ELISA检测方法。
1材料与方法
1.1材料
卵类黏蛋白、弗氏完全佐剂、弗氏不完全佐剂、牛血清白蛋白(BSA)、羊抗兔IgG辣根过氧化物酶标物、羊抗鼠IgG辣根过氧化物酶标物、三羟甲基氨基甲烷(Tris)、甘氨酸(含量≥99.9%)、甘氨酸,BCA蛋白定量试剂盒、十二烷基磺酸钠(SDS)、过氧化氢脲(CH6N2O3)、3,3',5,5'-四甲基联苯胺(TMB)、脱脂乳粉、鱼皮胶:购自Sigma公司;Tween 20:购自上海浦东化工试剂厂。丙三醇:天津市北方天医化学试剂厂;变色硅胶:天津市化学试剂一厂;β-环糊精和二甲基亚砜(DMSO):德国Merck公司;Protein A-Sepharose 4B和Protein G-Sepharose:美国Amersham公司;96孔酶标板:美国Thermo公司。
1.2方法
1.2.1卵类黏蛋白兔多克隆抗体的制备
以卵类黏蛋白过敏原蛋白为免疫原对新西兰大耳白兔进行免疫,并制备卵类黏蛋白特异性抗体。两周免疫1次,共免疫5次。从第3次开始耳缘静脉采血,最后1次采用股动脉采全血。并用间接ELISA法测定血清的效价。利用Protein A-Sepharose 4B免疫亲和层析柱对抗体进行纯化。
1.2.2卵类黏蛋白鼠多克隆抗体的制备
试验用BALB/c小鼠约为6周~7周大,雌性。免疫原与弗氏完全佐剂或者弗氏不完全佐剂以1∶1的体积混合,免疫剂量为100 μg/只,第4次免疫后取血并纯化后置于-20℃冰箱保存备用。
1.2.3卵转铁蛋白双抗夹心ELISA方法的建立
将卵转铁蛋白兔多抗包被于96孔聚苯乙烯酶标板中(100 μL/孔),然后4℃下孵育12 h~16 h。PBST洗液洗板3次后,在酶标板中加入封闭液(200 μL/孔),于37℃烘箱中封闭1 h。之后用PBST洗液洗板3次,每孔加入卵转铁蛋白标准溶液,于37℃烘箱中反应1 h,取出后用PBST洗液洗板3次。随后,将卵转铁蛋白鼠多抗加入到酶标板中(100 μL/孔),于37℃烘箱中反应1 h,取出后用PBST洗液洗板4次,然后将HRP标记的鼠二抗加入酶标板中(100 μL/孔),37℃下反应30 min。PBST洗液洗板5次后,向每孔中加入底物A和B的混合液(100 μL/孔),至于37℃烘箱中显色约15 min~20 min。然后加入终止液(50 μL/孔)并利用酶标仪采用双波长方式(450 nm~650 nm)读取吸光度值(OD值)。
1.2.4双抗夹心检测方法特异性的测定
抗体的特异性通过交叉反应测定。以PBS作为阴性对照,如果交叉反应物孔的吸光度值P,是阴性孔吸光度值N的2倍以上,即P/N>2时,则说明抗体对此蛋白有交叉。
2结果与讨论
2.1卵转铁蛋白双抗夹心ELISA方法的建立
2.1.1封闭液的优化
由于夹心ELISA方法检测限与空白值的大小紧密相关,因此首先通过封闭液的优化来降低空白值。试验选择了0.5%的脱脂乳粉、1%的脱脂乳粉、5%的脱脂乳粉、1%BSA溶液、0.5%鱼皮胶、1%明胶、0.5%酪蛋白作为封闭液,分别得到空白值,如表1所示。本试验选择了封闭效果较好,及空白值最小的0.5%乳粉作为封闭液。
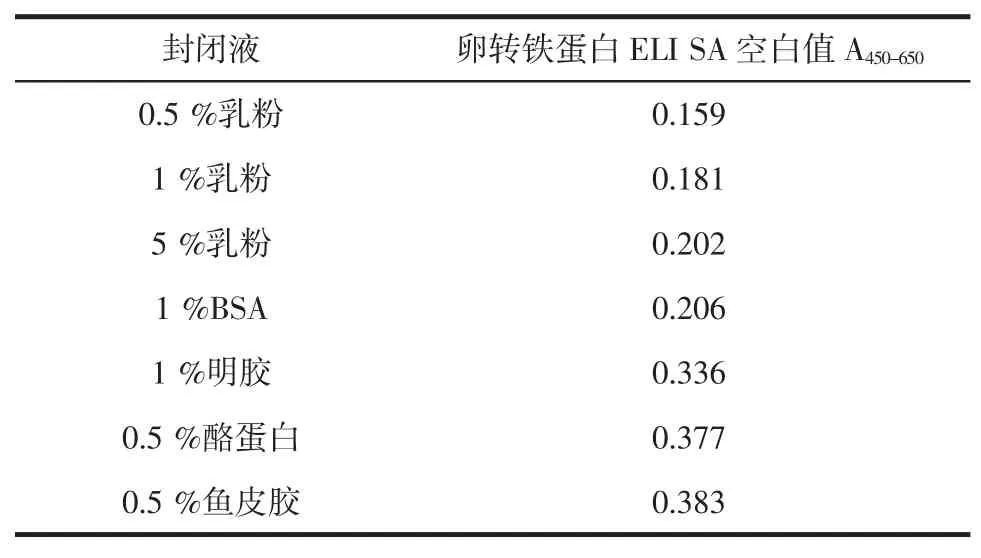
表1 不同封闭液下空白的平均吸光度值Table 1Absorption values at the different blocking buffer
2.1.2捕获抗体包被量的优化
试验选择0.05、0.075、0.1、0.3 μg/孔作为抗体包被量,绘制检测曲线见图1。
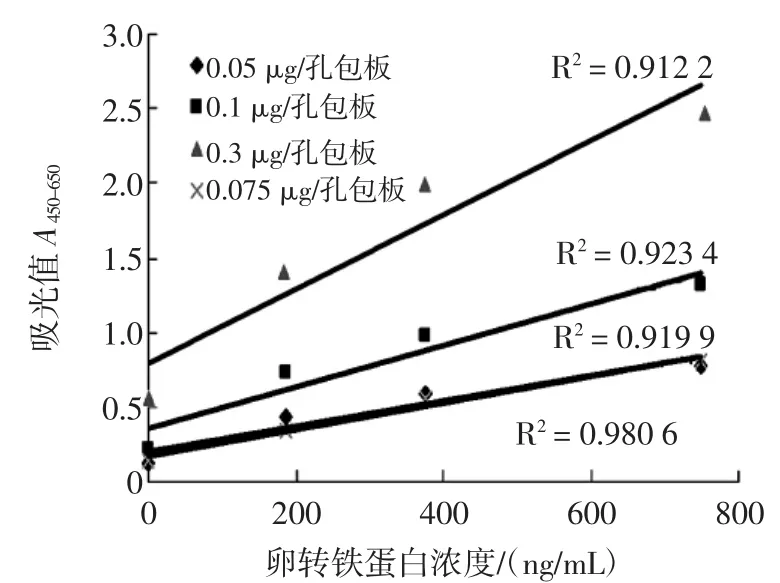
图1 不同捕获抗体包被量对卵转铁蛋白双抗体夹心酶联免疫检测的影响Fig.1Effect of different capture antibody coating quantity on OVT sandwich ELISA
如图1所示,包被量为0.075 μg/孔时空白值最低,且最大吸光度值接近1.0。因此选择兔抗卵转铁蛋白0.075 μg/孔作为捕获抗体的最终包被量。
2.1.3检测抗体稀释倍数的优化
将对应的鼠多抗检测抗体分别稀释1.7×105倍、2×105倍和2.4×105倍,固定其它的试验条件,绘制检测曲线图,结果通过线性相关系数以及空白值选择合适的检测抗体稀释倍数,结果见图2。
如图2所示。由于2×105倍时的线性相关系数较好且空白值较低,因此选择卵转铁蛋白检测抗体的稀释倍数为2×105倍。
2.1.4不同pH的优化
适宜的离子强度和pH能提高检测的灵敏度。不同pH对双抗体夹心酶联免疫检测的影响就见表2。
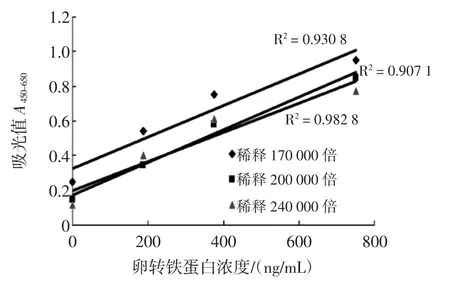
图2 不同检测抗体稀释倍数对卵转铁蛋白双抗体夹心酶联免疫检测的影响Fig.2Effect of different detect antibody dilution factor on OVT sandwich ELISA
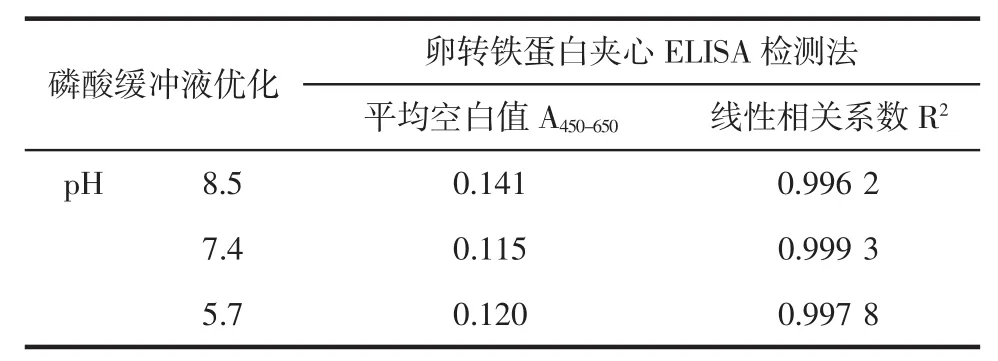
表2 不同pH对双抗体夹心酶联免疫检测的影响Table 2Effect of pH of PBS on sandwich ELISA
如表2所示,当pH=7.4时,空白值最低同时线性也最好,最终选择pH 7.4的缓冲液作为样品的稀释液。可见过酸或者过碱都会对待测蛋白的活性产生影响。这一结果与卵转铁蛋白的结构稳定性有一定关系[13-14]。
2.1.5卵转铁蛋白双抗夹心ELISA方法标准曲线的绘制
综合上述优化的结果,绘制吸光度值与蛋白浓度的标准曲线。图3为双抗体夹心ELISA检测卵转铁蛋白的标准曲线。
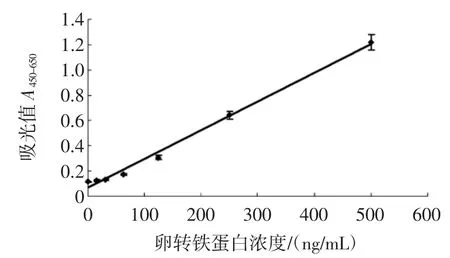
图3 卵转铁蛋白双抗体夹心酶联免疫检测的标准曲线(n=8)Fig.3Standard curve of OVT allergens on sandwich ELISA(n=8)
如图3所示,得到卵转铁蛋白的最低检出限(LOD)值为(15.37±1.20)ng/mL(n=8)。
2.1.6卵转铁蛋白双抗夹心ELISA方法的特异性
试验选择了11种常见致敏源(黏蛋白、白蛋白、溶菌酶、α-乳白蛋白、牛奶总蛋白、β-乳球蛋白、酪蛋白、花生总蛋白、大豆、杏仁和绿豆),将11种交叉反应物蛋白稀释至10、1、0.1μg/mL 3个浓度,计算得到P/N值,结果见表3。
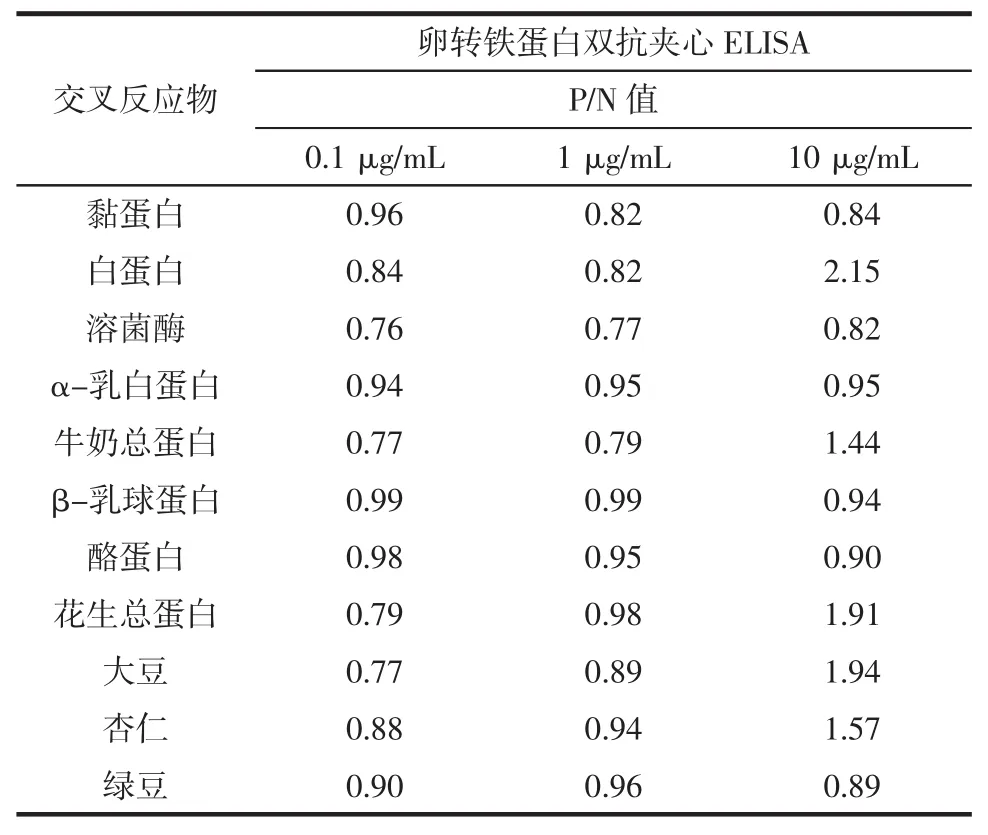
表3 双抗体夹心ELISA检测方法的特异性Table 3Cross-reactivity of selected common foods in the sandwich ELISA
由表3可知所建立的检测方法与白蛋白有交叉反应,与其他10种食物没有交叉反应。
2.2卵转铁蛋白双抗夹心ELISA方法的精密度
本试验选择7个不同浓度(0、7.812 5、15.625、31.25、62.5、125、250、500 ng/mL)的卵转铁蛋白溶液进行分析,分别考查板内变异和板间变异,对建立的双抗体夹心酶联免疫检测方法进行精密度测试。
2.2.1卵转铁蛋白双抗夹心板内变异
选择7个不同浓度的卵转铁蛋白溶液进行分析,根据每一个浓度对应得到的吸光度值计算平均值以及标准偏差,得到变异系数,结果如表4所示。

表4 卵转铁蛋白双抗体夹心酶联免疫检测法板内变异(n=5)Table 4Variance in-plate of sandwich ELISA for OVT allergen protein(n=5)
由表4可以看出其中A450-650值变异系数为大部分在2.37%~10.75%,均具有良好的板内重复性,具有较高的精密度。
2.2.2卵转铁蛋白双抗夹心板间变异
在相同条件下,取空白和7个不同浓度的卵转铁蛋白溶液,进行双抗体夹心酶联免疫检测方法分析,如表5所示。
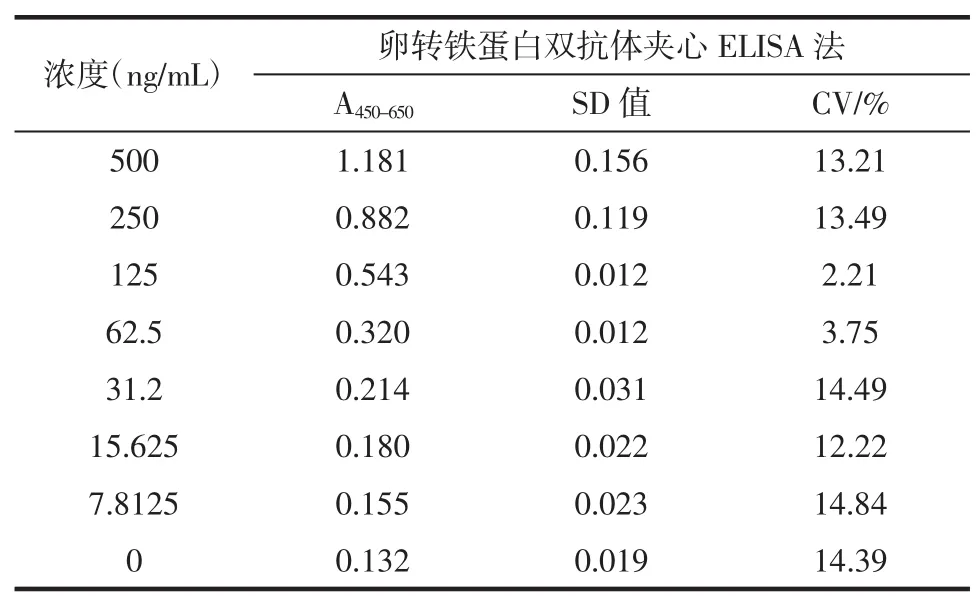
表5 卵转铁蛋白双抗体夹心酶联免疫检测法板间变异(n=5)Table 5Variance between-plate of sandwich ELISA for OVT allergen protein(n=5)
由表5可以看出其中A450-650值变异系数为2.21%~14.84%,具有良好的板间重复性,表明方法精密度高。
3结论
本试验通过对封闭液浓度,捕获抗体的包被浓度,检测抗体的稀释倍数以及pH的优化,建立了卵转铁蛋白的双抗夹心ELISA方法。优化的方法选用0.5%乳粉作为封闭液,包被浓度为0.075 μg/孔,检测抗体的稀释倍数为2×105倍,检测pH为7.4。该方法的最低检出限达到(15.37±1.20)ng/mL,且对卵转铁蛋白具有良好的特异性和板间板内重现性,可用于对卵类黏蛋白的定量检测。
[1]Rothenberg M E.Eosinophilic gastrointestinal disorders(EGID)[J]. Journal of Allergy and Clinical Immunology,2004,113(1):11-28
[2]Minli X.Traditional Chinese herbal remedies for asthma and food allergy[J].Journal of Allergy and Clinical Immunology,2007,120(1): 25-31
[3]Anet J,Baek J F,Baker R S,et al.Allergens in the white and yolk of hen's egg:A study of IgE binding by egg proteins[J].International archives of allergy and applied immunology,1985,77(3):364-371
[4]Hofflnan D R.Immunochemical identification of the allergens in egg white[J].Journal of Allergy and Clinical Immunology,1983,71(5): 481-486
[5]Langeland T A.A clinical and immunological study of allergy to hen's egg white III:Allergens in hen's egg white studied by crossed radio-immunoelectrophoresis(CRIE)[J].Allergy,1982,37(7):521-530
[6]Langeland T A.A clinical and immunological study of allergy to hen's egg white.IV:Specific IgE-antibodies to individual allergens in hen's egg white related to clinical and immunological parameters in egg allergic patients[J].Allergy,1983,38(7):493-500
[7]Williams J,Elleman T C,Kingston I B,et al.The primary structure of hen ovotransferrin[J].European Journal of Biochemistry,1982,122(2):297-303
[8]Monaci L,ViscontiI A.Immunochemical and DNA-based methods in food allergen analysis and quality assurance perspectives[J].Trends in Food Science and Technology,2010,21(6):1-12
[9]余清,黄红霞,刘绍文.食品过敏原及其检测分析技术[J].质量技术监督研究,2009(2):27-31
[10]Hei W,Li Z,Ma X.Determination of beta-conglycinin in soybean and soybean products using a sandwich enzyme-linked immunosorbent assay[J].Analytica Chimica Acta,2012,734(13):62-68
[11]吴序栎,吉坤美,李佳娜,等.双抗体夹心ELISA法测定食物中虾过敏原成分[J].食品科技,2009,34(8):240-243
[12]詹政科,刘萍,吉坤美,等.双抗体夹心ELISA法测定食物中牛奶过敏原蛋白成分[J].中国乳品工业,2009,34(8):44-47
[13]Wolf W J,Sathe,S K.Ultracentrifugal and polyacrylamide gel Electrophoretic studies of extractability and stability of almond meal proteins[J].Journal of Agricultural and Food Chemistry,1998,78:511-521
[14]Nowak W A,Bloom K A,Wanich N.Tolerance to extensively heated milk in children with cow’s milk allergy[J].Journal of Allergy and Clinical Immunology,2008,122(2):342-347
The Development of Sandwich Enzyme-linked Immunosorbent Assay(ELISA)for Detecting Ovotransferrin
LI Jing1,WANG Wei2,ZHANG Yan2,LU Yang2,WANG Shuo2,*
(1.Tianjin Entry-Exit Inspection and Quarantine Bureau of Industrial Product Safety Technical Center,Tianjin 300308,China;2.Key Laboratory of Food Nutrition and Safety Ministry of Education of China,The School of Food Engineering and Biotechnology of Tianjin University of Science and Technology,Tianjin 300457,China)
Ovotransferrin was one of the main allergen in egg.A sandwich ELISA was developed for detecting ovotransferrin.The limit of detection was(15.37±1.20)ng/mL.Except albumin,the assay had no cross-reaction with mucin,lysozyme,alpha-lactalbumin,milk protein casein,beta-lacto globulin,total protein,soy,peanuts,almonds and green beans.The assay showed good repeatability and reproducibility,which could be used for detecting ovotransferrin.
ovotransferrin;sandwich ELISA;allergen
10.3969/j.issn.1005-6521.2015.17.004
2015-05-08
质检公益性行业科研专项(201310067)
李晶(1976—),女(满),研究员,博士,生物技术与食品工程专业。
