苦瓜皂苷的纯化及降血糖活性的研究
2015-11-01尤玲玲刘金福王媛王娜张平平葛怀娜
尤玲玲,刘金福,王媛,王娜,张平平,葛怀娜
(1.天津农学院食品科学与生物工程学院,天津300384;2.天津市农副产品深加工技术工程中心,天津300384)
苦瓜皂苷的纯化及降血糖活性的研究
尤玲玲1,2,刘金福1,2,王媛1,王娜1,2,张平平1,2,葛怀娜1
(1.天津农学院食品科学与生物工程学院,天津300384;2.天津市农副产品深加工技术工程中心,天津300384)
主要研究纯化后苦瓜皂苷的成分组成及对HepG2胰岛素抵抗的缓解效果,为苦瓜皂苷降血糖活性的深入研究提供参考。本试验利用AB-8大孔吸附树脂纯化苦瓜皂苷粗提物,以人参皂苷Rg1和Rb1为参照物,通过薄层层析(TLC)技术初步分析纯化后样品的组成,然后利用高效液相色谱-蒸发光散射检测器(HPLC-ELSD)验证分析的结果,最后采用高浓度胰岛素诱导HepG2细胞建立胰岛素抵抗模型,考察不同剂量的苦瓜皂苷对葡萄糖消耗量的影响。结果表明,经AB-8大孔吸附树脂纯化后苦瓜皂苷含量由35.8%提高到了69.1%,薄层层析显色分析提取物中至少含有5种皂苷类物质,HPLC-ELSD得出纯化后苦瓜皂苷样品中除含有人参皂苷Rg1和人参皂苷Rb1外,还有含有其他6种组分。与模型组细胞相比,纯化后的苦瓜皂苷在一定程度上可以改善产生HepG2/IR细胞的葡萄糖消耗量,其中300 μg/mL的苦瓜皂苷效果最好。
苦瓜皂苷;纯化;薄层层析;高效液相色谱-蒸发光散射检测器;胰岛素抵抗
苦瓜(Momordica charantia L.)又名凉瓜,为葫芦科苦瓜属植物,果实药食兼用,具有悠久和广泛的药用历史和记载。中医认为它性味苦寒,具有清凉解热的作用。随着人们对苦瓜皂苷的进一步研究,苦瓜皂苷药理活性越来越受到人们的关注,文献报道苦瓜皂苷具有降血糖[1-2]、抗氧化[3]、提高免疫功能[4]、抗肿瘤[5]等活性。近年来,国内外学者采用不同方法对苦瓜食用部分进行了分离提取及鉴定,从苦瓜中分离出苷类、蛋白质、多糖、生物碱、有机酸等多种化学成分,其中苦瓜皂苷是其活性物质中的有效成分之一。
目前皂苷类物质纯化的方法较多,有泡沫分离法[6]、有机溶剂沉淀法[7]、膜分离法[8]等,但由于皂苷亲水性大,与杂质分离较困难,加之有些皂苷结构差别不大,因此,要想获得纯度较高的皂苷就需要借助大孔吸附树脂,其具有吸附容量大、再生简单、效果可靠等特点,此外对除去水溶性多糖、色素等杂质显出了独特的效果。
而对于苦瓜皂苷类物质的检测,都是基于HPLC在200 nm~210 nm波长下检测,但在这些波长下,皂苷以外的成分可能会与皂苷重叠造成检测结果的不同。2,3-二氢-2,5二羟基-6-甲基-4吡喃酮共轭的大豆皂苷在295 nm有最大吸收波长,甘草酸苷类和葫芦素能在紫外识别检测器中被成功检测,其他缺少发色团的皂苷会影响其在紫外光下的检测。为了克服这个问题本实验采用灵敏度更高的蒸发光散射检测器来尝试分析纯化后的苦瓜皂苷[9]。探讨其对HepG2肝癌细胞产生的胰岛素抵抗的影响,为苦瓜皂苷的深入开发和综合利用提供参考。
1材料与方法
1.1原料
新鲜苦瓜:天津市王顶堤农贸市场;AB-8大孔树脂:购于沧州宝恩吸附材料有限公司;硅胶板GF254:购于青岛鼎康硅胶有限公司。
1.2仪器与试剂
RE-5000旋转蒸发器:上海振捷实验仪器设备有限公司;TD5A-WS型台式低速离心机:湖南湘仪离心机仪器有限公司;UNIC7200紫外-可见分光光度计:上海光谱仪器有限公司;LGJ-18s冷冻干燥机:北京松源华兴科技发展有限公司;Aglient-1200高效液相色谱仪:安捷伦科技有限公司;Alltech-2000ES蒸发光散射检测器:奥泰公司;凝胶成像系统:美国伯乐公司;IX51倒置相差荧光显微镜:日本Olympus公司;超净工作台:苏州净化设备有限公司;3111型二氧化碳细胞培养箱:美国Thermo Forma公司;Bio-Tek ELX800型全自动酶标仪:美国宝特公司。
1.3方法
1.3.1苦瓜皂苷的纯化及含量测定
以鲜苦瓜阴干成苦瓜干,按照前期实验总结的方法[10]制备苦瓜皂苷粗提液。将5 mg/mL粗提液上预先处理好的AB-8大孔树脂静态吸附4 h,用蒸馏水洗脱除糖,洗脱过程中随时取洗脱液,分别加入molish试剂和浓硫酸,待界面无紫环出现说明样液中多糖已去除干净。接着用3.5 BV 80%的乙醇以2 BV/h流速洗脱柱子,收集洗脱液后,蒸发浓缩,冷冻干燥得苦瓜皂苷纯品。
采用香草醛-高氯酸显色法,以人参皂苷Rg1为对照品绘制标准曲线,测定纯化前后苦瓜总皂苷的含量[11]。
1.3.2薄层层析法分析皂苷组成
用毛细管取甲醇溶解的苦瓜皂苷样品液、人参皂苷Rg1和Rb1标准品,在距薄层板底边约1.5 cm处,点样于活化好的硅胶板上,将薄层板置于装有氯仿-甲醇-水-冰乙酸[12]展开剂(65∶35∶10∶2)的层析缸中,上行法进行展开,当展层剂前沿距薄层上方1 cm处,取出玻璃板,60℃烘箱中烘干,喷以10%的硫酸乙醇溶液,在60℃烘至斑点清晰,置日光和紫外光灯(365 nm)下检视。
1.3.3高效液相色谱法验证苦瓜皂苷组分
参考有关文献资料[13]并对方法进行改进,对纯化后苦瓜皂苷样品的含量测定进行试验研究,确定色谱条件如下:
色谱柱:Eclipse XDB-C18柱(4.6 mm×150 mm,5 μm);柱温:35℃;皂苷样品浓度:1mg/mL;标准品浓度:人参皂苷Rg1和人参皂苷Rb1均配制成0.1 mg/mL;进样体积:5 μL;ELSD检测器漂移管温度:110℃;喷雾气体流速:3.0 L/min。以流动相A(水)、流动相B(乙腈)进行梯度洗脱。HPLC梯度洗脱程序见表1。

表1 线性梯度洗脱表Table 1The linear elution process
1.3.4苦瓜皂苷对HepG2/IR葡萄糖消耗量的影响
肝癌细胞HepG2培养细胞于37℃,5%CO2饱和湿度环境下的二氧化碳培养箱中(15%胎牛血清,1‰青-链霉素的DMEM培养液),胰酶消化后将细胞制成105个/mL单细胞悬液,接种于96孔板,每孔100 μL,二氧化碳培养箱继续培养12 h,准备进行试验。
分别设立HepG2细胞阴性对照组,HepG2/IR模型组、阳性对照组、苦瓜皂苷干预组,每组6个复孔。在阴性对照组中只加入50 μL DMEM培养液,HepG2/IR模型组、阳性对照组以及苦瓜皂苷干预组每孔加入50 μL 30 μg/mL胰岛素溶液,孵育36 h后,即建立HepG2/IR模型[14]。然后,阴性对照组和HepG2/IR模型组中加入50 μL DMEM培养液,阳性对照组中加入50 μL盐酸吡格列酮溶液(终浓度为4 μg/mL),苦瓜皂苷干预组分别加入50 μL终浓度为100、300、500、700 μg/mL的苦瓜皂苷样液,孵育12 h后3 600 r/min离心10 min,吸取出每孔的培养液,按葡萄糖试剂盒测定方法测定培养液中葡萄糖的含量。
1.3.5数据统计及图形分析
实验数据用SPSS 13.0统计软件进行统计学分析,数据以x±s表示,采用单因素差异性分析以及多重比较组间差异。
2结果与讨论
2.1苦瓜皂苷的纯化
根据人参皂苷标准曲线y=0.002 6x-0.005 0(R2= 0.992 5),计算出苦瓜皂苷粗提物中皂苷含量为35.8%,经过AB-8大孔树脂纯化后皂苷含量可提高到69.1%。
2.2薄层色谱法鉴别纯化后苦瓜皂苷组分
为进一步确定纯化后苦瓜皂苷样品中的组分数量及种类,用甲醇将纯化后的苦瓜皂苷样品、人参皂苷Rg1标准品和人参皂苷Rb1标准品配分别平行两次点样,进行TLC检测,并在日光及365 nm紫外灯下进行检视,结果见图1。
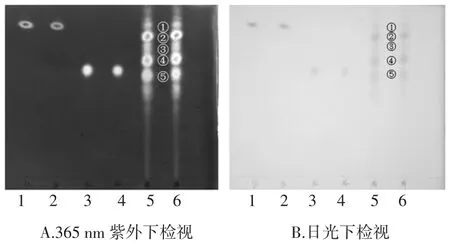
图1 纯化后苦瓜皂苷样品的TLC图Fig.1TLC of purified saponin
经测量计算,人参皂苷Rg1的Rf值为0.86,人参皂苷Rb1的Rf值为0.60,纯化后的苦瓜皂苷样品(见图1,第5道和第6道)从上到下的Rf值依次为0.86,0.80,0.74,0.67,0.58。与标准品比较,初步推断纯化后的苦瓜皂苷样品中含有人参皂苷Rg1及与人参皂苷Rb1极性非常相近的一种组分,除此之外还有可能存在其它3种皂苷类物质。
2.3HPLC-ELSD法分析纯化后苦瓜皂苷样品
由于HPLC-ELSD法的色谱条件中的流动相为水和乙腈,而配制苦瓜样品和标准品的溶剂为甲醇,因此检测供试苦瓜皂苷样品时选用甲醇作为阴性对照液,以便后期将溶剂峰排除。
精密吸取人参皂苷标准品溶液、苦瓜皂苷样品溶液、甲醇溶液,按1.2.3中的色谱条件进样。苦瓜皂苷色谱图见图2。
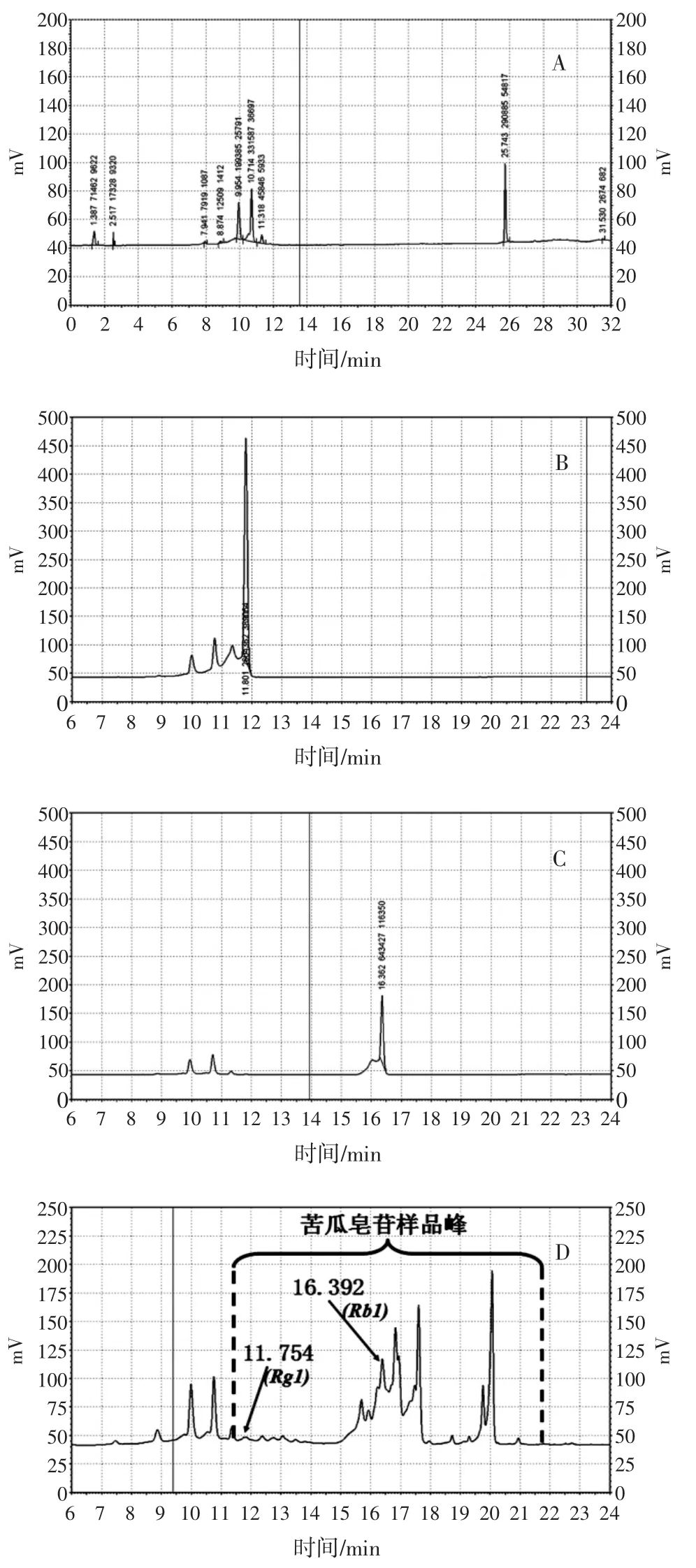
图2 高效液相色谱图Fig.2HPLC-ELSD chromatograms of different sample
由图2(B和C)可以看出人参皂苷Rg1在11.846 min有非溶剂峰的强峰出现,人参皂苷Rb1在16.362 min有非溶剂峰的强峰出现,从苦瓜皂苷样品的色谱图中可以看出在11.754、15.689、16.232、16.392、16.827、17.469、17.609、20.062 min有显著峰,与人参皂苷标准品的色谱图进行比较后得出,纯化后的苦瓜皂苷样品在人参皂苷标准品的保留时间11.846和16.362 min处均有对应峰出现,可以得出纯化后苦瓜皂苷样品中含有人参皂苷Rg1和Rb1,除此之外,还有至少6种组分。
2.4不同浓度苦瓜皂苷对HepG2/IR细胞葡萄糖消耗量的影响
成功建立HepG2/IR细胞模型后,设立不同浓度的苦瓜皂苷作用HepG2/IR细胞,测定葡萄糖消耗量结果见图3。
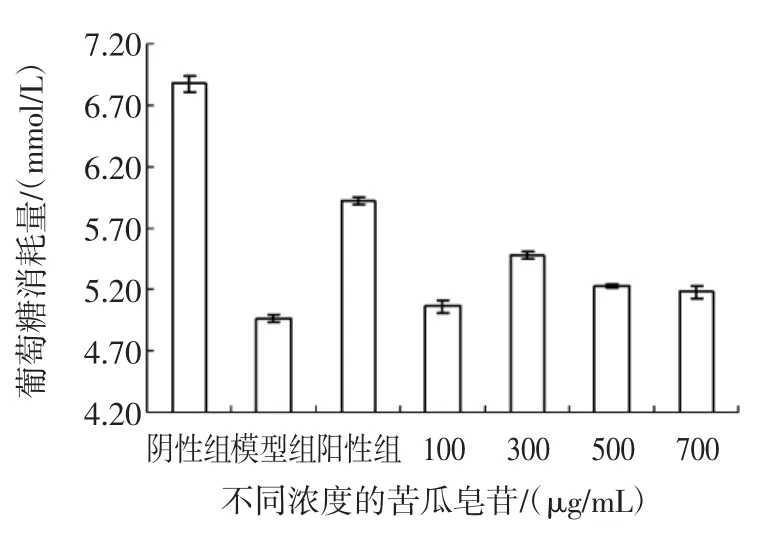
图3 不同浓度的苦瓜皂苷对HepG2/IR细胞葡萄糖消耗量的影响Fig.3Effect of different concentration Momordica charantia saponin to the glucose consumption of HepG2/IR
当苦瓜皂苷浓度低于300 μg/mL时,随着皂苷浓度的增大,细胞葡萄糖消耗量也从5.061 mmol/L(P<0.01)极显著增加至5.475 mmol/L(P<0.05)。苦瓜皂苷各剂量组中,300 μg/mL的苦瓜皂苷剂量组葡萄糖消耗量最大,具有统计学意义(P<0.05),此剂量与盐酸吡格列酮阳性对照组相比较,差异最小(P<0.05)。
但当苦瓜皂苷浓度高于300 μg/mL时,葡萄糖消耗量整体呈现下降趋势,尽管葡萄糖消耗量随着浓度的增加有所减少,但葡萄糖消耗量与HepG2/IR模型组相比较仍有一定程度提高,说明苦瓜皂苷还是在不同程度上促进了HepG2/IR细胞消耗葡萄糖,缓解了胰岛素抵抗现象。
3结论
经过AB-8大孔树脂,上样浓度为5 mg/mL,上样流速为2 BV/h,洗脱液为80%乙醇,洗脱柱体积为3.5 BV的上样条件进行纯化后,苦瓜皂苷含量由35.8%提高到69.1%。
经过TLC和HPLC-ELSD法对纯化后的苦瓜皂苷样品组分进行检测,从色谱图中可以看出纯化后的样品含有人参皂苷Rg1和Rb1,除此之外还有至少6种组分。
采用高浓度的胰岛素诱导HepG2细胞出现葡萄糖代谢异常后,以不同浓度纯化后的苦瓜皂苷作用于HepG2/IR细胞,发现在一定浓度范围内苦瓜皂苷可以缓解胰岛素抵抗,其中300 μg/mL的苦瓜皂苷作用极显著,差异具有统计学意义(P<0.05)。
[1]Wang ZQ,Zhang XH,Yu Y,et al.Bioactives from bitter melon enhance insulin signaling and modulate acyl carnitine content in skeletal muscle in high-fat diet-fed mice[J].J Nutr Biochem,2011,22(11):1064-1073
[2]Tan MJ,Ye JM,Turner N,et al.Antidiabetic activities of triterpenoids isolated from bitter melon associated with activation of the AMPK pathway[J].Chem Boil,2008,15(3):263-273
[3]Tsung-Hsien Tsai,Ching-Jang Huang,Wen-Huey Wu,et al.Antioxidant cell-protective,and anti-melanogenic activities of leaf extracts from wild bitter melon(Momordica charantia Linn.var.abbreviata Ser.)cultivars[J].Botanical Studies,2014,55(1):78-88
[4]Leung SO,Yeung KN.The immunosuppressive activities of two abortifacient proteins isolated from the seeds of bitter melon(Momordica charantia)[J].Immunopharmacology,1987,13(3):159-171
[5]I Ahmed,E Adeghate,AK Sharma,et al.Effects of Momordica charantia fruit juice on islet morphology in the pancreas of the streptozotocin diabetic rat[J].Diabetes Research and Clinical Practice,1998,40(3):145-151
[6]魏凤玉,方菊,张静,等.连续泡沫分离法纯化无患子总皂苷的研究[J].中草药,2011,42(9):1728-1731
[7]计红芳,李健,张令文.溶剂沉淀法纯化苦瓜总皂苷工艺的研究[J].食品科技,2009,34(4):204-207
[8]易克传,岳鹏翔,曾其良,等.超滤膜纯化绞股蓝皂苷的工艺[J].生物加工过程,2012,10(4):35-37
[9]W Oleszek,Z Bialy.Chromatographic determination of plant saponins-an update(2002-2005)[J].Journal of Chromatography A,2006,1112(1/2):78-91
[10]张平平,刘金福,韩慧,等.水溶性苦瓜皂甙和苦瓜多糖提取方法的研究[J].食品研究与开发,2007,128(6):12-15
[11]朱群娣,吴康郁,袁伟彬.苦瓜中总皂苷的比色法测定[J].中医学报,2014,29(10):1469-1472
[12]Panneerselvam Krishnamurthy,Chigen Tsukamoto,Seung Hwan,et al.An improved method to resolve plant saponins and sugars by TLC[J].Chromatographia,2012,75(23/24):1445-1449
[13]Shuli Man,Wenyuan Gao,Yanjun Zhang,et al.Qualitative and quantitative determination of major saponins in Paris and Trillium by HPLC-ELSD and HPLC-MS/MS[J].Journal of Chromatography B,2010,878(29):2943-2948
[14]尤玲玲,陈永慧,刘金福,等.苦瓜皂苷对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响[J].食品工业科技,2014,35(5):338-345
Purification and Hypoglycemic Activity of Saponins Extracted from Momordica Charantia in Vitro
YOU Ling-ling1,2,LIU Jin-fu1,2,WANG Yuan1,WANG Na1,2,ZHANG Ping-ping1,2,GE Huai-na1
(1.Tianjin Agricultural University College of food science and biotechnology,Tianjin 300384,China;2.Tianjin Engineering and Technology Research Center of Agricultural Products Processing,Tianjin 300384,China)
The components and insulin resistance ability of purified Momordica charantia saponins were investigated to further study the hyperglycemic effect of it.AB-8 macroporous adsorption resin was used to purify crude saponins.The components of purified saponins were analyzed by thinlayer chromatography(TLC)and high performance liquid chromatography-evaporative light-scattering detector(HPLC-ELSD).The insulin resistant HepG2 cell model was established by high concentration insulin.Different concentration Momordica charantia saponins were added to measure glucose consumption by glucose oxidase method(GOD).These results showed that the content of saponins increased from 35.8%to 69.1%.There were less than 5 kinds of saponins based on TLC technique.By HPLC-ELSD,there were other 6 kinds of saponins,besides Ginsenoside Rg1 and Rb1.Compared with HepG2/IR group,treatment with 300 μg/mL Momordica charantia saponins could enhance glucose consumption of HepG2 cells/IR.
Momordica charantia saponins;purification;thin-layer chromatography(TLC);high performance liquid chromatography-evaporative light-scattering detector(HPLC-ELSD);insulin resistance(IR)
10.3969/j.issn.1005-6521.2015.17.008
2015-07-03
天津市科技支撑计划项目(No.13ZCZDNC01800)
尤玲玲(1981—),女(汉),讲师,硕士,研究方向:生物资源开发与功能性食品。
刘金福(1961—),男,教授,硕士,研究方向:天然产物化学及生物活性。
