Xist基因抑制对牛SCNT早期胚胎发育的影响
2015-10-25刘黎明孙伟张金吨赵丽霞李树裕王标陈杨林胡树香吴宝江李喜和
刘黎明孙伟张金吨赵丽霞李树裕王标陈杨林胡树香吴宝江李喜和,
(1.内蒙古大学蒙古高原动物遗传资源研究中心,呼和浩特010021;2.内蒙古赛科星繁育生物技术股份有限公司,呼和浩特011517)
Xist基因抑制对牛SCNT早期胚胎发育的影响
刘黎明1孙伟2张金吨1赵丽霞2李树裕2王标1陈杨林1胡树香2吴宝江2李喜和1,2
(1.内蒙古大学蒙古高原动物遗传资源研究中心,呼和浩特010021;2.内蒙古赛科星繁育生物技术股份有限公司,呼和浩特011517)
Xist是与X染色体失活相关的非编码基因,它在合子期基因组开始表达,是胚胎发育早期表达的第一个印记基因。探讨了特异性抑制Xist的TALER-REPRESSOR(TALER)载体转染到胎牛成纤维细胞对Xist基因的抑制作用,并以抑制Xist基因表达的细胞作为核供体制作克隆胚胎,研究Xist基因抑制对牛克隆胚早期发育的影响。结果显示,与对照组细胞相比,TALER载体将Xist相对表达量下调了93.85%,说明本试验设计的载体转染系统能够有效抑制Xist基因的表达。选取Xist抑制表达阳性的转染细胞用于体细胞核移植试验,克隆胚胎发育结果显示,试验组和对照组的卵裂率、8细胞发育率、桑葚胚发育率和囊胚发育率分别为78.8% vs 75.1%(P>0.05,无显著差异)、54.4% vs 50.6%(P>0.05,无显著差异)、12.3% vs 27.8%(P<0.01,差异极显著)、0 vs 26.6%(P<0.01,差异极显著)。综上所述,试实验设计的特异性抑制Xist表达的TALER载体可有效抑制雌性胎牛成纤维细胞中Xist的表达。供体细胞Xist这种基因下调可使克隆胚胎2-8细胞率略有提升,但囊胚期和桑葚胚率明显降低。因此,其机制尚待于进一步探讨。
Xist基因;TALER载体;胎牛成纤维细胞;克隆胚胎早期发育
Xist(X-inactive specific transcript)是一个与X染色体失活相关的非编码RNA基因,在受精合子期开始激活,是胚胎早期发育表达的第一个印记基因[1]。尽管Xist是在雌性动物中参与X染色体失活,但Xist RNA的功能尚未被完全认知[2]。在动物克隆胚胎发育中,许多的基因表达异常[3],Xist也是这些异常表达基因之一[4]。前期研究表明,利用Xist基因缺陷型供体细胞用于克隆试验,可成功将小鼠克隆效率提高8-9倍[5]。目前,尚未有研究抑制牛供体细胞Xist基因表达水平对牛体细胞核移植影响的研究。
TALER(TALE-REPRESSOR)技术是利用TALE(Transcription activator-like effector)蛋白特异性识别DNA序列的特性将转录抑制因子REPRESSOR结合到目标基因上进而抑制基因转录的技术[6-8]。TALE蛋白的DNA结合结构域由33-35个氨基酸的重复序列组成,每一个重复序列的第12、13是两个不同的氨基酸,可以识别不同的碱基。根据目标基因将若干个重复序列顺序组装就可以对目标基因进行特异性识别。REPRESSOR 是来自于Krüppel家族锌指蛋白中广泛存在且十分保守的KRAB(Krüppelassociated box)结构域,由75个氨基酸构成,具有转录抑制功能[9,10]。将人工组装的TALE蛋白与转录抑制结构域KRAB融合,即构成TALER载体[11],实现对目标基因的转录抑制。
本研究利用特异性识别牛Xist基因的TELER载体,研究抑制牛成纤维细胞Xist基因表达效果,并进一步探讨了对牛克隆胚胎早期发育的影响,以期为进一步提高牛体细胞克隆效率提供基础技术支撑。
1 材料与方法
1.1 材料
细胞总RNA提取试剂盒(74104)、PCR试剂盒(200403)、基因组DNA提取试剂盒购自QIAGEN公司,反转录试剂盒(A3500)购自Promega公司,细胞转染试剂盒(VPI-1002)购自LONZA公司。强力霉素(Dox)诱导型Xist mCherry-TALER载体、rtTa载体、pBase载体由英国Sanger研究所刘鹏涛实验室提供。胎牛成纤维细胞为本实验室建立储存;牛卵巢由呼和浩特屠宰厂提供。
1.2 方法
1.2.1 PCR试验 分别用基因组DNA提取试剂盒与总RNA提取试剂盒提取牛胎儿成纤维细胞的基因组DNA、总RNA,并将总RNA反转录为cDNA,作为PCR反应的模板。根据NCBI中牛Xist cDNA序列(NR_001464.2),应用primer5.0设计Xist引物、SRY引物,并由Invitrogen公司合成,引物序列及扩增片段大小见表1。根据PCR试剂盒说明书配制反应体系,采用以下条件扩增:94℃,4 min;94℃,30 s;60-68℃,30 s;72℃,30 s;30个 循 环;72℃,5 min。扩增产物用1%的琼脂糖凝胶进行检测。根据SYBR®Premix Ex TaqTM试剂盒(TaKaRa)配制反应体系,以β-actin为内参用Real-time PCR仪(CFX96,BIO-RAD)检测Xist基因表达量。选取相同来源、相同代次的雌性胎牛成纤维细胞作为对照,所得数据用2(-ΔΔCt)进行计算。
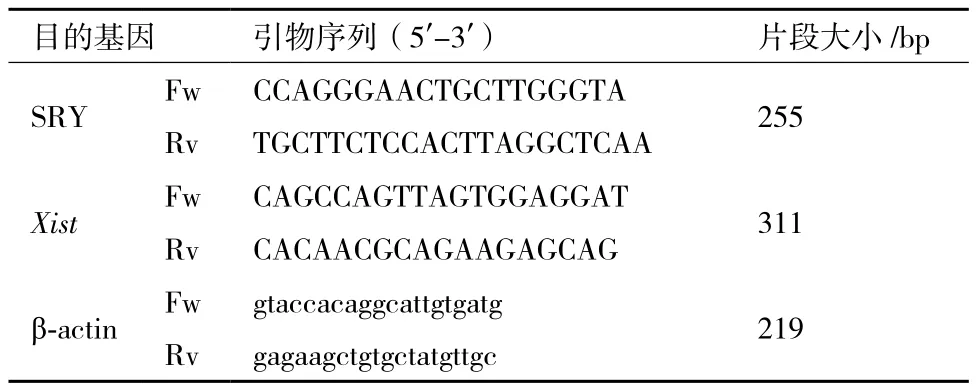
表1 PCR引物
1.2.2 胎牛成纤维细胞电转染 培养雌性胎牛成纤维细胞至汇合度80%-90%时收集细胞并进行计数。取1×106个细胞,加入100 μL电转液重悬,向细胞悬液中加入5 μg Xist mCherry-TALER、5 μg rtTa、5 μg pBase载体,将细胞悬液转入电转杯中,采用电转仪(amaza Nucleofector II,LONZA)U023程序电转。电转后将电转杯中的细胞悬液接入10 cm皿中,置于38.5℃,5% CO2培养箱。
1.2.3 流式细胞仪分选细胞 将转染后5 d的胎牛成纤维细胞(细胞汇合度达80%-90%)用0.25%胰酶消化细胞,将细胞浓度稀释为1×106个/mL。利用BD FACS Aria II流式细胞仪分选表达红色荧光蛋白的细胞,提取RNA,反转录扩增cDNA,进行Xist表达量检测。
1.2.4 体细胞核移植 核移植操作前,将培养3-4d汇合度达100%的供体细胞——胎牛成纤维细胞及转染后胎牛成纤维细胞,用0.25%胰蛋白酶消化收集,最后用100 μL操作液重悬,制备成单细胞悬液,置于4℃ 备用。屠宰场取牛卵巢,置于25℃生理盐水,3 h内带回实验室。生理盐水洗涤3遍卵巢,用10 mL注射器吸取2-6 mm卵泡,显微镜下拣A级、B级卵丘卵母细胞复合体(COCs)用于核移植试验。待卵母细胞成熟17 h后,采用盲吸法去核,再将供体细胞注入卵母细胞。细胞核移植后的重构胚在融合液中平衡2 min后进行电融合,融合后洗净培养15 min后观察融合情况。将融合的重构胚胎用5 μmol/L离子霉素处理5 min,2 mmol/L 6-DMAP联合激活处理4 h,然后将重构胚置于覆盖石蜡油的SOF培养液的4孔板中培养,培养气相条件一种是置于38.5℃、5%CO2饱和湿度,48 h后观察发育情况。
2 结果
2.1 胎牛成纤维细胞性别鉴定
分别以荷斯坦种公牛(M)与荷斯坦高产母牛(F)的DNA为对照,扩增两个胎牛成纤维细胞(F1,F2)的SRY基因。琼脂糖凝胶电泳显示,胎牛成纤维细胞F1有,而F2没有SRY基因扩增(图1),因此胎牛成纤维细胞F1为雄性,F2为雌性。
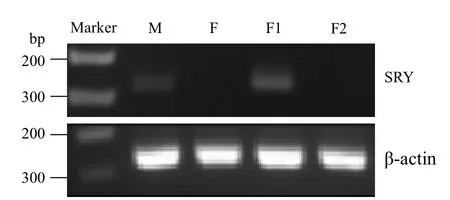
图1 性别鉴定结果
2.2 胎牛成纤维细胞转染结果
Xist mCherry-TALER、rtTA与pBase载体共转染雌性胎牛成纤维细胞F2后,培养液加入Dox。荧光显微镜下观察发现转染后20 h细胞阳性率(红色荧光细胞,颜色标识见电子版)在90%以上,培养5 d后阳性细胞比例逐渐下降(图2)。

图2 细胞转染后20 h结果
2.3 流式细胞分选
将转染后培养至5 d的细胞用胰酶消化,用不含血清的培养液重悬,使细胞密度为1×106个/mL,利用流式细胞仪进行检测及筛选。先对对照细胞进行筛选确定阴性细胞区域,再对转染后的细胞进行筛选,结果阳性率为18.4%(图3)。经分选得到约5×105个阳性细胞,用于RNA提取,进行后续试验。

图3 流式细胞仪进行阳性率检测转染后培养5 d的细胞
2.4 Xist表达抑制效果检测
用SYBR Premix Ex TaqTM扩增反转录得到的cDNA模板,β-actin为内参、未转染细胞为对照,检测Xist 表达量。试验重复3次,结果见表2,图4。

表2 Xist 表达抑制效果检测结果

图4 Xist 相对表达量检测
2.5 体细胞核移植获得早期胚胎效率比较
选取表达红色荧光的细胞用于体细胞核移植试验,用正常胎牛成纤维细胞做对照。试验组和对照组的卵裂率、8细胞发育率、桑葚胚发育率和囊胚发育率分别为78.8% vs 75.1%、54.4%及50.6%、 12.3% vs 27.8%、26.6% vs 0。
3 讨论
本试验使用特异性抑制Xist基因的TALER载体转染雌性胎牛成纤维细胞,并通过流式细胞仪进行分选获得阳性细胞后检测Xist基因的表达水平。结果发现Xist TALER 载体可以成功转染胎牛成纤维细胞并能显著下调Xist基因表达量。Cong等[12]将识别多能性基因Sox2的TALE分别与KRAB和SID(一种转录抑制因子)融合构建TELER载体,转染细胞后发现,TELER载体可以显著下调Sox2 的表达。Garg等[7]将识别CMV启动子的TELER载体与CMV-CFP载体共转染细胞,发现TELER可以显著抑制CFP表达,同时与RNA干扰试验比较发现TELER的抑制效率比RNA干扰高5倍以上。综上所述,本试验所使用Xist TALER载体适合在牛体细胞水平抑制Xist基因表达,能够用于进一步研究。

表3 体细胞核移植获得早期胚胎效率比较

图5 发育到4细胞阶段的克隆胚胎
图6 发育到8细胞阶段的克隆胚胎
Xist基因主要参与雌性动物的X染色体失活[2],但Xist RNA的功能还需进一步深入研究。Matoba等[13]用siRNA方法降低植入前的早期胚胎Xist RNA,尽管Xist RNA下调的效果是暂时的,但可以提高重构胚胎的早期发育能力;但在胚胎植入后期仍有负面影响。有研究将Xist 的干扰序列片段整合到牛基因组中,在 8 细胞时期加入诱导剂四环素诱导干扰片段的表达,成功纠正雄性动物某些异常表达的基因[14]。Dean等[15]发现,牛体外受精胚胎从受精卵至8细胞,甲基化程度逐步下降,到16细胞时又开始再甲基化。克隆胚胎在单细胞时期甲基化程度下降,但之后的发育并未进一步去甲基化,而是提前开始甲基化。克隆桑葚胚阶段卵裂球核高度甲基化,程度和供核细胞胎牛成纤维细胞相同。本试验选取阳性的转染细胞作为核供体进行SCNT试验,与对照组相比,桑葚胚和囊胚发育率都显著降低,可能与DNA非正常甲基化相关。但是关于确切的牛X染色体基因表达失活时期及其与DNA甲基化、组蛋白修饰等的关系,目前还没有确定[16]。
前期研究显示经过药物筛选的转基因细胞做核供体会降低哺乳动物克隆的效率[17,18],本试验未使用G418药物筛选转染阳性的胎牛成纤维细胞,排除了药物筛选对供体细胞以及对早期克隆胚胎的不良影响。本试验结果表明,经Xist TALER转染获得的Xist被抑制胎牛成纤维细胞作为供体时存在影响克隆早期胚胎发育的因素,其深层机理有待进一步研究。在今后的研究中,进一步探讨抑制Xist基因表达对克隆胚胎的DNA甲基化、组蛋白修饰等的影响及其与早期克隆胚胎发育的相关性,为提高牛体细胞克隆效率和产业化应用提供理论和技术支撑。
4 结论
本研究使用mCherry-TALER载体转染胎牛成纤维细胞,并通过红色荧光仪进行流式分选。分选细胞中Xist的表达量被mCherry-TALER载体极显著地抑制。后续的核移植试验表明,抑制Xist基因表达,可以克隆胚8-细胞发育率,但是降低桑椹胚和囊胚发育率。由Xist抑制引起的克隆胚发育及相关表观遗传学修饰变化还需进一步研究。
[1] Zuccotti M, Boiani M, Ponce R, et al. Mouse Xist expression begins at zygotic genome activation and is timed by a zygotic clock[J]. Molecular Reproduction and Development, 2002, 61(1):14-20.
[2] Payer B, Lee JT. X chromosome dosage compensation:how mammals keep the balance[J]. Annual Review of Genetics, 2008, 42:733-772.
[3]Fukuda A, Cao F, Morita S, et al. Identification of inappropriately reprogrammed genes by large-scale transcriptome analysis of individual cloned mouse blastocysts[J]. PLoS One, 2010, 5(6):e11274.
[4] Nolen LD, Gao S, Han Z, et al. X chromosome reactivation and regulation in cloned embryos[J]. Developmental Biology, 2005,279(2):525-540.
[5]Inoue K, Kohda T, Sugimoto M, et al. Impeding Xist expression from the active X chromosome improves mouse somatic cell nuclear transfer[J]. Science, 2010, 330(6003):496-499.
[6] Mahfouz MM, Li L, Piatek M, et al. Targeted transcriptional repression using a chimeric TALE-SRDX repressor protein[J]. Plant Molecular Biology, 2012, 78(3):311-321.
[7] Garg A, Lohmueller JJ, Silver PA, et al. Engineering synthetic TAL effectors with orthogonal target sites[J]. Nucleic Acids Research,2012, 40(15):7584-7595.
[8] Konermann S, Brigham MD, Trevino AE, et al. Optical control of mammalian endogenous transcription and epigenetic states[J]. Nature, 2013, 500(7463):472-476.
[9] Iyengar S, Farnham PJ. KAP1 protein:an enigmatic master regulator of the genome[J]. Journal of Biological Chemistry, 2011,286(30):26267-26276.
[10] O’Geen H, Squazzo S L, Iyengar S, et al. Genome-wide analysis of KAP1 binding suggests autoregulation of KRAB-ZNFs[J]. PLoS Genetics, 2007, 3(6):e89.
[11] Mahfouz MM, Li L, Shamimuzzaman M, et al. De novo-engineered transcription activator-like effector(TALE)hybrid nuclease with novel DNA binding specificity creates double-strand breaks[J]. Proceedings of the National Academy of Sciences, 2011, 108(6):2623-2628.
[12] Cong L, Zhou R, Kuo Y, et al. Comprehensive interrogation of natural TALE DNA-binding modules and transcriptional repressor domains[J]. Nature Communications, 2012, 3:968.
[13] Matoba S, Inoue K, Kohda T, et al. RNAi-mediated knockdown of Xist can rescue the impaired postimplantation development of cloned mouse embryos[J]. Proceedings of the National Academy of Sciences, 2011, 108(51):20621-20626.
[14] 鲁成龙. pIKX-EGFP-C1 载体的构建及其对克隆胚 X 相关基因的影响[D]. 杨凌:西北农林科技大学, 2012.
[15]Dean W, Santos F, Stojkovic M, et al. Conservation of methylation reprogramming in mammalian development:aberrantreprogramming in cloned embryos[J]. Proceedings of the National Academy of Sciences, 2001, 98(24):13734-13738.
[16] Ferreira AR, Machado GM, Diesel TO, et al. Allele-specific expression of the MAOA gene and X chromosome inactivation in in vitro produced bovine embryos[J]. Molecular Reproduction and Development, 2010, 77(7):615-621.
[17] Ogura A, Inoue K, Ogonuki N, et al. Production of male cloned mice from fresh, cultured, and cryopreserved immature Sertoli cells[J]. Biology of Reproduction, 2000, 62(6):1579-1584.
[18] Zakhartchenko V, Mueller S, Alberio R, et al. Nuclear transfer in cattle with non-transfected and transfected fetal or cloned transgenic fetal and postnatal fibroblasts[J]. Molecular Reproduction and Development, 2001, 60(3):362-369.
(责任编辑 李楠)
《中国食物与营养》2015年征稿征订启事
中国科技核心期刊 中国农业核心期刊
《中国食物与营养》创办于1995年,由农业部主管,中国农业科学院、国家食物与营养咨询委员会主办的食物与营养领域相结合的综合性月刊,国内外公开发行。
办刊宗旨:立足于农业、食物、营养领域的结合,报道国家在食物与营养相关领域的方针、政策、法规、标准等;刊登食物生产、食物消费、食品工业、食物营养等方面的发展动态和科技成果;普及宣传营养保健、膳食指南等方面的知识等。
本刊主要栏目有:专题论坛、食物安全、资源与生产、食品工业、消费与流通、新技术新产品、营养与保健、膳食营养调查等。
《中国食物与营养》杂志由北京报刊发行局发行,邮发代号为82-597。本刊为月刊,每期定价15元,全年180元。也可直接汇款到编辑部订阅(免费邮寄)。
地 址:北京市海淀区中关村南大街12号《中国食物与营养》编辑部
电 话:(010)82109761 传 真:(010)82106285 邮 编:100081
网 址:http://aii.caas.cn/xzqk/zgswyyy/index.htm
E-mail:foodandn@263.net
Effect of Xist Gene Repression on Early Development of Bovine SCNT Embryos
Liu Liming1Sun Wei2Zhang Jindun1Zhao Lixia2Li Shuyu2Wang Biao1Chen Yanglin1Hu Shuxiang2Wu Baojiang2Li Xihe1,2
(1.Research Center for Animal Genetic Resources of Mongolia Plateau,Inner Mongolia University,Hohhot 010021;2. Inner Mongolia Saikexing Reproductive Biotechnology Co.,Ltd.,Hohhot 011517)
Xist is an X-inactivation related gene that produces a noncoding RNA, and it is one of the first imprinted genes to be expressed in the early embryo with expression beginning at zygotic genome activation. This experiment aimed at investigating Xist repression in fetal bovine fibroblast by TALE-REPRESSOR(TALER)which contains mCherry as reporter, and the impact of Xist repression on early development of cloned cattle embryos using the transfected cells as nuclei donor. The results showed TALER repressed Xist gene expression by 93.85% in fluorescence-activated sorted cells compared with wild type fibroblast, indicating the TALER vector designed in this experiment effectively suppressed expression of Xist. The mCherry positive cells were selected for somatic cell nuclear transfer(SCNT). The 2-cell, 8-cell, morula and blastocyst rates of suppressed group vs. control group were 78.8% vs 75.1%(P>0.05), 54.4% vs. 50.6%(P>0.05), 12.3% vs. 27.8%(P<0.01)and 0 vs. 26.6%(P<0.01), respectively. These results indicated that TALER vectors effectively inhibited Xist gene expression in female fetal bovine fibroblast. Suppression of Xist gene promotes the 2-8 cell embryonic development of cloned embryo, however, development of morula/blastocyst decreased significantly. Therefore, the mechanism by which Xist gene expression regulates early embryonic development of cloned embryos needs further investigation.
Xist gene;TALER vector;fetal bovine fibroblast;early embryonic development
10.13560/j.cnki.biotech.bull.1985.2015.01.033
2014-05-27
内蒙古自治区家畜性控精液技术熟化与产业化开发(20111701)
刘黎明,男,硕士,研究方向:动物生殖生物学与生物技术;E-mail:nmgdxllm@163.com
李喜和,男,博士,教授,研究方向:动物生殖生物学与生物技术;E-mail:Lixh@life.imu.edu.cn
