甲胎蛋白的原核表达及复性优化
2015-10-25才蕾矫丽媛王继华唐时幸
才蕾 矫丽媛 王继华 唐时幸
(广州万孚生物技术股份有限公司,广州 510660)
甲胎蛋白的原核表达及复性优化
才蕾 矫丽媛 王继华 唐时幸
(广州万孚生物技术股份有限公司,广州 510660)
构建甲胎蛋白的原核表达载体pET32a-AFP,对包涵体形式表达的甲胎蛋白进行复性优化。将构建的重组质粒pET32a-AFP转化入E.coli,IPTG诱导表达后,经亲和层析纯化获得AFP包涵体,通过对复性过程、pH、添加剂等的研究摸索,获得最佳复性条件。当采用添加0.5 mol/L L-精氨酸的一步法透析复性方法,且透析液pH值为8.5,重组人AFP包涵体蛋白起始浓度为1.0 mg/mL时,复性效率最高。该复性方法获得蛋白质具有较高的回收率且操作简便。
甲胎蛋白;原核表达;复性
甲胎蛋白(Alpha fetoprotein,AFP)是存在于人胚胎血清中的主要糖蛋白,其蛋白质部分包含590个氨基酸残基,与维生素D结合蛋白,人L-白蛋白以及人血清白蛋白共同组成血清样蛋白家族。这类蛋白质高度同源并且具有相似的分子量,均为65-70 kD间。甲胎蛋白可以作为多种疾病的检测标志物,如妇科肿瘤、肝癌[1]以及甲状腺功能减退和神经退行性疾病等[2]。
甲胎蛋白质的重组表达已有文献报道,如刘继洪等[3]构建表达载体以大肠杆菌表达甲胎蛋白,邓小玲[4]和Yamamoto等[5]成功将甲胎蛋白在真核细胞中,包括哺乳动物细胞和酵母中进行表达等。已有的文献均显示,原核表达的AFP均以包涵体形式存在于大肠杆菌[6],而蛋白质的复性条件对其构象和活性有着重要的影响[7]。包涵体蛋白复性是一个复杂的过程,除了对复性条件和过程进行控制外,很大程度上与蛋白自身的氨基酸组成和结构特性相关。本研究在成功以原核方式表达重组人甲胎蛋白(rhAFP)并获得纯化蛋白之后,对影响rhAFP复性进程和条件等进行研究,最终摸索出可获得较高复性率的复性条件。
1 材料与方法
1.1 材料
限制性核酸内切酶Hind III、BamH I和T4 DNA ligase购自TaKaRa公司;蛋白质分子量Marker购自Fermentas公司;琼脂糖凝胶DNA回收试剂盒和小量质粒提取试剂盒购自TIANGEN公司;纯化树脂购自GE公司。
控温控速摇床(智诚ZHWY-200B);超声波细胞粉碎机(宁波新芝);台式低温离心机(Thermo Legend RT+);微量分光光度计(Thermo NanoDrop 2000c);电泳仪(Bio-Rad PowerPac Basic);凝胶成像仪(Bio-Rad Gel Doc XR+);蛋白质纯化系统(GE AKTA Purifier 100)。
1.2 方法
1.2.1 表 达 质 粒pET32a-AFP的 构 建 根 据Genbank:NM_001134.2的人甲胎蛋白基因mRNA的编码序列,合成可表达该蛋白质的DNA长片段。为便于克隆,在5'端和3'端分别设计加入BamH I和Hind III酶切位点,酶切位点两侧各加3个保护碱基。将上述合成片段和pET32a载体分别进行双酶切,回收目的片段并连接,构建重组质粒pET32a-AFP,并转化E.coli DH5α,通过提质粒和质粒双酶切来验证阳性克隆,最后测序。
1.2.2 rhAFP蛋白在大肠杆菌BL21(DE3)中的表达 将测序正确的pET32a-AFP重组质粒转化大肠杆菌BL21(DE3),培养挑取单菌落,接种至5 mL含氨苄青霉素的LB培养基中,37 ℃培养过夜,以1%接种量接种至200 mL LB培养基中,待OD600nm达到0.8时,加入终浓度为0.1 mmol/L的IPTG进行诱导。诱导结束离心收集菌体,超声破碎后取裂解产物,进行SDS-PAGE电泳分析。
1.2.3 rhAFP蛋白的提取、变性与纯化 BL21(DE3)表达的rhAFP主要以包涵体形式存在于超声后沉淀中。将诱导后菌体在4℃,8 000 r/m离心10 min,收集菌体沉淀,以超声缓冲液(20 mmol/L Tris-HCl,pH8.0,含100 mmol/L NaCl和2% Tween20)重悬,超声裂解菌体(超声时长15 min,超声2 s,间断4 s,功率300 W)后再以4 ℃,12 000 r/min离心10 min,收集沉淀并将该沉淀进行洗涤(20 mmol/L Tris-HCl,pH8.0,含2 mol/L尿素,2%TritonX-100和500 mmol/L NaCl),4℃,12 000 r/min离心10 min,获得洗涤后的沉淀即为AFP包涵体粗提物,将该粗提物溶于8 mol/L尿素缓冲液中(20 mmol/L Tris-HCl,pH 8.0,8 mol/L尿素),充分溶解后静置室温放置2 h,4℃,12 000 r/min离心30 min取上清即为AFP包涵体蛋白液。pET32a表达的AFP蛋白带有6×His标签,可使用GE Healthcare的Ni-NTA填料进行装柱,亲和层析纯化变性后的AFP包涵体蛋白。
1.2.4 rhAFP蛋白的复性优化 rhAFP包涵体蛋白复性采用透析复性法,考察了复性进程(多步尿素梯度透析复性和一步法透析复性)对AFP包涵体复性后活性的影响。多步尿素梯度透析复性方案为,将上述制备好的AFP包涵体蛋白液装入透析袋中,依次放置在4 mol/L尿素、2 mol/L尿素、1 mol/L尿素和0 mol/L尿素溶液中,分别在4℃磁力搅拌条件下透析12 h,最后将透析袋放置在蛋白保存液中继续透析,最终获得有活性的AFP蛋白;而一步法透析复性是直接将装有AFP包涵体蛋白液的透析袋放置在0.8 mol/L尿素溶液中,4℃磁力搅拌条件下透析24 h,之后同样将透析袋放置在蛋白保存液中继续透析获得有活性的AFP蛋白。
多步尿素梯度透析复性方案所选用的缓冲液配方分别为:(1)4 mol/L尿素溶液:4 mol/L尿素,20 mmol/L Tris-HCl,1 mmol/L EDTA,1 mmol/L DTT,0.015% SDS,pH 8.0;(2)2 mol/L尿素溶液:2 mol/L尿素,20 mmol/L Tris-HCl,1 mmol/L EDTA,2 mmol/L DTT,0.015%SDS,pH 8.0;(3)1 mol/L尿素溶液:1 mol/L尿素,20 mmol/L Tris-HCl,1 mmol/L EDTA,2 mmol/L DTT,0.015%SDS,1 mmol/L GSH-0.2 mmol/L GSSG,pH 8.0;(4)0 mol/L尿素溶液:20 mmol/L Tris-HCl,1 mmol/L EDTA,2 mmol/L DTT,0.015% SDS,1 mmol/L GSH-0.2 mmol/L GSSG,pH 8.0;
一步法透析复性选用的缓冲液配方为:(1)0.8 mol/L尿素溶液:0.8 mol/L尿素,20 mmol/LTris-HCl,1 mmol/L EDTA,1.33 mmol/L GSH-1.33 mmol/L GSSG,pH 8.0;(2)蛋白保存液:20 mmol/L Tris-HCl,1 mmol/L EDTA,20%甘油,0.02%NaN3,pH 7.5。并在以上复性方案的基础上,考察添加精氨酸、透析复性起始蛋白质量浓度以及透析液pH值对复性后rhAFP活性的影响,进而在优化的复性条件下,实现rhAFP的最高复性效率。
1.2.5 rhAFP蛋白的分子量以及纯度鉴定 配制浓度为12%的SDS-PAGE电泳胶,分别将诱导后、超声上清与纯化后蛋白溶液进行上样检测,电泳后染色脱色,以Bio-Rad凝胶成像仪记录电泳情况。
1.2.6 透析复性后rhAFP蛋白的活性检测及复性效果评价 将透析复性后的rhAFP蛋白用蛋白保存液进行稀释,使用Wondfo甲胎蛋白(AFP)定量检测试剂盒(荧光免疫层析法,检测范围5-400 ng/mL)对稀释后的rhAFP蛋白进行活性检测,并计算AFP复性效率(具有AFP活性的蛋白质量/全部蛋白总量)作为评价透析复性方法。
2 结果
2.1 pET32a-AFP表达质粒的鉴定
将提取的质粒pET32a-AFP用BamH I和Hind III双酶切,鉴定酶切后的条带与载体片段和基因片段大小吻合(图1),且质粒测序结果正确,重组质粒pET32a-AFP构建成功。

图1 表达质粒pET32a-AFP的酶切鉴定
2.2 表达产物的鉴定
AFP基因编码590个氨基酸,其理论分子量为66.3 kD,选用的pET32a载体上含有硫氧还蛋白融合蛋白和多肽(Trx-tag)及S-tag、His-tag等,所以最终获得AFP融合蛋白的理论分子量约为85.5 kD。图2-A所示在85 kD左右有明显的蛋白表达条带,以未诱导基因工程菌株作为对照,可证实为目的蛋白,与预期结果一致,且目的蛋白主要以包涵体形式表达。凝胶扫描成像,Bio-Rad软件分析显示目的蛋白表达量可达细菌总蛋白的20.1%。通过Ni亲和纯化后,可获得纯度达90%以上的AFP蛋白(图2-B)。

图2 AFP表达产物及其纯化后蛋白的SDS-PAGE分析
2.3 复性过程对rhAFP活性的影响
包涵体蛋白复性过程是一个去除变性剂,使蛋白由完全伸展状态恢复到正常折叠结构的过程,大多数包涵体蛋白进行折叠发生在尿素浓度为4 mol/L到2 mol/L之间,但是由于蛋白自身的氨基酸组成和结构特性的差异,复性过程也不尽相同,选择合适的复性进程和方案对最终获得有活性的蛋白至关重要。另外,L-精氨酸可以通过提高蛋白折叠中间体的溶解性或者阻碍聚集体的形成来促进包涵体蛋白的有效复性。
试验考察了多步尿素梯度和一步法透析复性,以及在一步法透析复性缓冲液中添加0.5 mol/L L-精氨酸,对rhAFP复性后活性的影响。设置最高AFP蛋白活性为100%,以相对蛋白活性来表征各透析复性方案对其复性后活性的影响,图3所示,rhAFP蛋白复性,一步法的快速透析复性方案较多步尿素梯度缓慢复性效果好,且添加精氨酸有助于rhAFP的复性,可提高rhAFP蛋白活性。
2.4 rhAFP起始浓度对AFP复性的影响
rhAFP包涵体蛋白采用添加0.5 mol/L L-精氨酸的一步法透析复性,复性透析液pH8.0,设置不同起始蛋白质量浓度(0.1-1.5 mg/mL),以最高的AFP蛋白活性为100%,用相对蛋白活性来表征各起始蛋白质量浓度对其复性后活性的影响。结果如图4所示,不同浓度rhAFP蛋白液对其透析复性后的活性影响较大,活性随着浓度升高,先升高后降低,在1.0 mg/mL时,活性值为最大。

图3 各包涵体蛋白透析复性方案对AFP活性的影响

图4 起始蛋白质量浓度对复性后活性的影响
2.5 pH对rhAFP复性的影响
复性透析液中rhAFP起始浓度为1.0 mg/mL,检测不同pH值对复性后AFP活性的影响,以最高的AFP蛋白活性为100%,用相对蛋白活性来表征各pH值对其复性后活性的影响,结果如图5所示,不同pH值的透析液对其复性后的活性影响较大,活性随着透析液pH值升高而逐渐提高,且pH值在8.5时活性值趋于平衡,碱性条件有利于AFP包涵体蛋白复性。
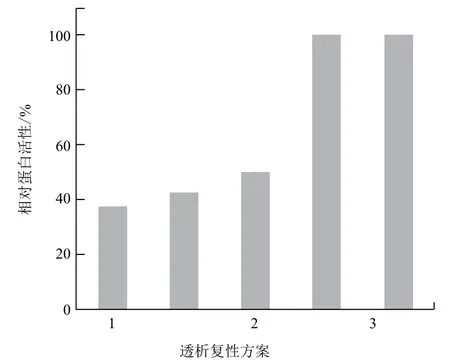
图5 复性pH值对AFP复性后活性的影响
2.6 优化后的rhAFP透析复性效率
综合以上优化的AFP包涵体蛋白透析复性条件,对rhAFP进行复性,即添加0.5 mol/L L-精氨酸的一步法透析复性,透析液pH8.5,rhAFP包涵体蛋白浓度1.0 mg/mL,4℃透析24 h后,放入蛋白保存液中继续透析,最后收集并测定AFP活性。此条件下,AFP复性效率达10%,即具有AFP活性的蛋白占蛋白总量的10%。
3 讨论
甲胎蛋白是多种疾病,包括妇科肿瘤和肝癌等的检测标志物。获得具有反应活性的AFP蛋白质不仅可以用作免疫原来免疫动物制备抗体,而且可应用在定量检测试剂中作为质控品使用。
原核表达体系不仅为蛋白质研究提供了必要的工具,其成本低、周期短、易获取的优点使得其成为蛋白质研究和生产的重要手段。但由于蛋白质异源表达宿主可能缺乏某些蛋白质折叠所需的辅助因子或调节蛋白折叠机制,以及环境不适等,使得折叠过程中无法形成正确的次级键,蛋白质失去原有的特性和功能,最终以包涵体形成存在。包涵体蛋白复性方法的探索将最终决定其复性率的大小和获得重组蛋白生物活性的高低,然而对于不同的包涵体,其自身结构和特性的不同,决定了其特定的复性途径[8]。而对于复性方法,被采用最多的方法包括稀释复性[9]、透析复性以及柱上复性[10]等。对于包涵体蛋白,没有哪一种方法是可以适用于所有蛋白的“万金油”,只有针对相应蛋白的特性,摸索最佳方法才可获得更好的复性收率。甲胎蛋白的结构和性质曾有多人报道[11],复性方法的研究也有文献报道[12]。本研究着重摸索最佳复性条件以获得最高收率,同时也考虑了操作的简便性,最终对表达的AFP包涵体蛋白进行透析复性方案和条件的研究,获得了最佳AFP复性率可达到10%左右。
4 结论
利用pET-32a载体表达的甲胎蛋白以包涵体形式存在于大肠杆菌中,表达量约占总蛋白含量的25%。甲胎蛋白复性采用一步透析法,在透析液pH为8.5,添加终浓度为0.5 mol/L的L-精氨酸,且包涵体蛋白起始浓度为1.0 mg/mL时,复性效率最高。
[1]Xu JB, Qi FZ, Xu G, et al. Value of alpha-fetoprotein and clinical characteristics in patients with liver neoplasm[J]. Neoplasma,2014, 61(2):218-224.
[2] Schieving JH, de Vries M, van Vugt JMG, et al. Alpha-fetoprotein, a fascinating protein andbiomarker in neurology[J]. Eur J Paediatr Neurol, 2014,18(3):243-248.
[3] 刘继洪, 朱海红, 陈智, 等. 人甲胎蛋白基因的克隆和表达[J].科技通报, 2004, 20:241-246.
[4]邓小玲, 蔡美英, 魏大鹏, 等. 人AFP全长基因编码序列的克隆及表达[J]. 四川大学学报:医学版, 2004, 35(5):612-614.
[5]Yamamoto R, Takashi S, Nishi S, et al. Expression of human α-fetoprotein in yeast[J]. Life Science, 1990, 46:1679-1686.
[6]李振东, 谷华玮, 王海鹰, 等. 人甲胎蛋白AFP在大肠杆菌中表达和鉴定[J]. 现代食品科技, 2013, 29(10):2415-2419.
[7] Papaneophytou P, Kontopidis G. Statistical approaches to maximize recombinant protein expression in Escherichia coli:A general review[J]. Protein Expression and Purification, 2014, 94:22-32.
[8]刘秀侠, 杨雄, 陈红英. 单链抗体2F5和4E10的原核表达、纯化和鉴定[J]. 生物技术通报, 2013(10):177-183.
[9]吕海丽, 姬晓南, 冯丽亚, 等. 抗甲胎蛋白单链抗体在大肠杆菌中表达条件的优化及活性鉴定[J]. 中国药科大学学报, 2012,43(5):460-465.
[10]Rane AM, Jonnalagadda S, Li ZY. On-column refolding of bone morphogenetic protein-2 using cation exchange resin[J]. Protein Expression and Purification, 2013, 90:135-140.
[11]Gillespie JR, Uversky VN, Structure and function of α-fetoprotein:a biophysical overview[J]. Biochimica et Biophysica Acta, 2000,1480:41-56.
[12] SHarapova OA, Pozdnykova NV, Laurinavichyute DK, et al. Highefficient expression, refolding and purification of functional recombinant C-terminal fragment of human alpha-fetoprotien[J]. Protein Expression and Purification, 2010, 73:31-35.
(责任编辑 李楠)
Prokaryotic Expression of Alpha Fetoprotein and Optimization of Renaturation
Cai Lei Jiao Liyuan Wang Jihua Tang Shixing
(Guangzhou Wondfo Biotech Co.,Ltd,Guangzhou 510660)
Plasmid pET32a-AFP was constructed to express recombinant human alpha fetoprotein, which was in the form of inclusion body, and the protein was obtained after renaturing optimization. The recombinant plasmid pET32a-AFP was transformed in E.coli, after induced by IPTG and purified by affinity column, the inclusion body was renatured under different conditions, including renature method, pH and addictives. The results showed that it had the highest renature efficiency when 1.0 mg/ml AFP was processed under one-step dialysis renature method and the pH is 8.5, with 0.5 mol/L L-Arg. This renature process made the recombinant AFP protein having the highest efficiency and easy to manipulate.
alpha-fetoprotein;prokaryotic expression;renaturation
10.13560/j.cnki.biotech.bull.1985.2015.01.029
2014-05-07
才蕾,女,工程师,博士,研究方向:诊断试剂研发;E-mail:leicai@wondfo.com.cn
唐时幸,男,高级工程师,博士,研究方向:诊断试剂研发;E-mail:tang.shixing@wondfo.com.cn
