脑心肌炎病毒VP1蛋白酵母双杂交诱饵载体的构建及验证
2015-10-25谢晶莹冯若飞徐雷张海霞李向茸侯兰新马忠仁
谢晶莹冯若飞徐雷张海霞李向茸侯兰新马忠仁
(1.西北民族大学生物工程与技术国家民委重点实验室,兰州 730030;2.甘肃省动物细胞工程技术研究中心,兰州 730030;3.西北民族大学生命科学与工程学院,兰州 730030)
脑心肌炎病毒VP1蛋白酵母双杂交诱饵载体的构建及验证
谢晶莹1,3冯若飞1,2徐雷3张海霞2李向茸2侯兰新3马忠仁2
(1.西北民族大学生物工程与技术国家民委重点实验室,兰州 730030;2.甘肃省动物细胞工程技术研究中心,兰州 730030;3.西北民族大学生命科学与工程学院,兰州 730030)
为筛选与脑心肌炎病毒VP1蛋白相互作用的靶细胞cDNA文库蛋白,构建VP1蛋白的诱饵载体pDHB1-VP1。扩增EMCV的VP1基因并克隆至pMD18-T载体中,经测序验证正确后定向克隆至酵母双杂交诱饵载体pDHB1。将重组pDHB1-VP1载体进行酶切验证和测序分析,并转化酵母报告菌株NMY51,检测其在酵母细胞中有无表达和自激活作用。结果表明,构建的pDHB1-VP1基因可以在酵母细胞中正确表达,产物大小约66 kD,而且可以与兔抗EMCV血清发生特异性结合,有较好免疫原性。成功构建了诱饵载体pDHB1-VP1,可以在酵母细胞中表达且其对报告基因无自激活作用,可以应用于酵母双杂交筛选试验中。
脑心肌炎病毒;VP1蛋白;酵母双杂交;诱饵蛋白
脑心肌炎病毒(Encephalomyocarditis Virus,EMCV)是可引起心肌炎的病原体,其可感染多种动物和人[1]。该病毒是于1945年在一只患急性致死性心肌炎黑猩猩体内发现并首次分离得到,并在1958年确诊为猪的致死性疾病病因之一[2-6]。EMCV可以造成母猪的繁殖障碍、仔猪产生急性致死性心肌炎,并且仔猪感染后死亡率可达100%[7,8],鼠类对于EMCV较为敏感,死亡率接近100%,多被视为病毒传播源头或者中间宿主[9]。目前已有研究表明EMCV在小鼠、鸡、猴、仓鼠等的胚胎细胞中生长,并能产生细胞病变[10]。EMCV基因组为单股正链RNA病毒,全长约7.8 kb,有一个较大的开放阅读框(ORF),该阅读框长约6 879 nt,编码由2 292个氨基酸组成的多聚蛋白[11]。EMCV的衣壳粒子有4种结构蛋白,分别为VP1、VP2、VP3和VP4。其中VPl抗原性最强,参与病毒抗原位点形成、受体吸附及脱壳,还与病毒粒子表面的抗原性有关,可刺激机体产生中和抗体[12],具有重要的免疫保护作用,这可能与VP1蛋白处于病毒粒子最表面有关[13,14]。但目前关于病毒与靶细胞如何作用尚无明确的报道,其相互作用的机制机理也不明确。
本研究以VP1蛋白基因构建诱饵载体,应用酵母双杂交系统筛选EMCV的细胞结合蛋白,以期揭示病毒与靶细胞相互作用的机制机理。
1 材料与方法
1.1 材料
EMCV 毒株(PV21株,ATCC)由西北民族大学生物工程与技术国家民委重点实验室提供,大肠杆菌BL21感受态细胞由重点实验室保存;兔抗EMCV盐析血清,由西北民族大学生物工程与技术国家民委重点实验室制备(制备方法参照李向茸等[15])DUALHunter starter kit购自瑞士Dualsystems Biotech公司;培养基YPAD,SD/-Leu,SD/-Leu/-Trp,SD/-Leu/-Trp/-His,SD/-Leu/-Trp/-His/-Ade等营养缺陷型培养基均购自Clontech公司;限制性内切酶Sfi I,克隆载体pMD18-T购自TaKaRa公司;dNTP,Taq酶,10×Taq reaction buffer,病毒总RNA提取试剂盒购自TIANGEN公司;质粒小提试剂盒购自上海生工生物工程技术公司;DNA Gel Extraction Kit试剂盒购自AXYGEN公司;酵母细胞总蛋白提取试剂盒和酵母质粒小提试剂盒购自北京庄盟国际生物基因科技有限公司。
1.2 方法
1.2.1 引物设计与合成 根据GenBank EMCV毒株(登录号X74312)VP1基因序列设计引物,序列如下:
VP1-F:TCGCGGCCATTACGGCCGGAGTAGAA AACGCTGAA,VP1-R:TCGCGGCCGAGGCGGCCATC AAGACTCCAGCTCTCG。
引物中引入Sfi I酶切位点(下划线部分),这样可以确保将目的基因定向克隆入诱饵载体pDHB1。引物由上海生工生物工程技术公司合成。
1.2.2 VP1 基因扩增 参照相关的操作说明提取EMCV病毒总RNA,以两步法进行反转录,第一步反应体系为dNTPs(10.0 mmol/L)2.0 μL,Oligo(dT)18(10 mmol/L)2.0 μL,RNAsafe(20×)1.0 μL,RNA模板10.0 μL,总体系15 μL进行如下反应:70℃ 5 min,快速冰浴3 min。待第一步反应结束,向反应完成的溶液中加入5×First strand Buffer 4.0 μL,0.1 mol/L DTT 1.0 μL,DEPC H2O 4.0 μL,M-MLV逆转录酶1.0 μL,混匀各组分进行第二步反应,反应条件为:42℃ 1 h,95℃ 5 min。待反应结束则得到单链cDNA。
以cDNA为模板扩增VP1基因。PCR反应体系:10×PCR reaction buffer 2.5 μL,dNTPs(2.5 mmol/L)2.0 μL,引物VP1-F/VP1-R各0.5 μL,Taq DNA Polymerase 0.5 μL,cDNA模板2.0 μL,DEPC H2O补足至25 μL。反应条件:94℃ 5 min,94℃变性30 s、67℃复性45 s、72℃延伸60 s,共35个循环,72℃延伸10 min。扩增出两端带有Sfi I酶切位点的目的DNA片段。取10 μL产物进行1%琼脂糖凝胶电泳,紫外灯下观察结果。
1.2.3 pMD18-T-VP1重组质粒的构建与鉴定 将PCR产物进行10 g/L 琼脂糖凝胶电泳,并应用AXYGEN胶回收试剂盒进行DNA纯化,纯化后产物构建入克隆载体pMD18-T,并转化大肠杆菌BL21感受态细胞。挑取阳性克隆接种于Amp+ LB液体培养基中,振荡培养8-10 h 后参照上海生工质粒小提试剂盒的相关操作说明进行大肠杆菌质粒的提取。质粒经PCR及Sfi I酶切验证正确后送上海生工生物工程技术公司进行测序,构建正确的重组质粒命名为pMD18-T-VP1。
1.2.4 诱饵载体pDHB1-VP1的构建与鉴定 将测序正确的pMD18-T-VP1质粒以及诱饵载体质粒pDHB1分别进行Sfi I双酶切,凝胶回收目的基因VP1片段以及诱饵载体片段,应用T4连接酶对载体及扩增片段进行连接。连接产物转化大肠杆菌BL21,挑取阳性单克隆进行菌液扩增及质粒提取。将酶切验证正确的质粒送上海生工生物有限公司测序,确定pDHB1-VP1诱饵载体构建成功。
1.2.5 诱饵载体pDHB1-VP1转化酵母报告菌株NMY51 参照Dualsystems公司酵母双杂交试验说明书以TE/LiOAc法制备酵母菌NMY51细胞。
向预冷的EP管中分别加入1.5 μg诱饵质粒DNA,5 μL预变性carrier DNA,100 μL制备好的酵母菌感受态细胞,轻轻混匀;EP管中再加入300 μL PEG/LiOAc,轻轻混匀,置于30℃恒温培养箱孵育30 min(每隔10 min轻微震荡混匀1次细胞);向管中加入20 μL DMSO,轻微混匀,置于42℃水浴中热激15 min(每隔5 min轻微震荡混匀一次细胞);12 000 r/min高速离心15 s,倒掉上清;向细胞沉淀中加入1 mLYPAD培养基重悬细胞,30℃,220 r/min摇床震荡培养90 min;培养后的酵母菌悬液12 000 r/min高速离心15 s,倒掉上清,用0.9% NaCl溶液重悬细胞;吸取100 μL涂于直径为100 mm的SD/-Leu固体选择培养基平板上,置于30℃恒温培养箱中,培养3-5 d至长出红色菌落;挑取数个单克隆进行SD-leu液体培养,参照北京庄盟酵母质粒小提试剂盒说明书进行质粒提取,PCR进一步确认诱饵质粒是否转化入酵母报告株NMY51。
1.2.6 诱饵载体pDHB1-VP1在酵母细胞中的表达 将转化诱饵质粒pDHB1-VP1的NMY51酵母菌克隆于10 mL SD/-Leu 液体培养基中进行过夜培养至OD6000.6-1.0。参照酵母细胞总蛋白提取试剂盒相关操作说明提取总蛋白,分别进行SDS-PAGE以及Western blotting 分析。方法如下:将提取的蛋白与与2×上样缓冲液等体积混合后上样,电泳后考马斯亮蓝R250染色;将SDS-PAGE的胶湿转于硝酸纤维素膜上,一抗为兔抗EMCV盐析血清,二抗为山羊抗兔的辣根过氧化物酶复合物,应用DAB试剂盒显色。
1.2.7 诱饵载体pDHB1-VP1功能验证 将转化了诱饵质粒pDHB1-VP1的NMY51酵母菌应用TE/LiOAc法制备感受态细胞,分别将pOst-NubI和pPR3-N质粒转化入NMY51感受态细胞,方法同1.2.5所述。酵母菌液分别涂布SD/-Leu/-Trp,SD/-Leu/-Trp/-His, SD/-Leu/-Trp/-His/-Ade不同营养缺陷型固体培养基平板,30℃恒温培养箱倒置培养4 d,观察菌落生长情况,检测VP1蛋白能否在酵母细胞内正确表达。
2 结果
2.1 VP1基因的扩增
PCR产物经琼脂糖电泳时,出现一条特异性区带,位于分子质量标准800 bp附近,与预期的片段大小(824 bp)一致(图 1)。
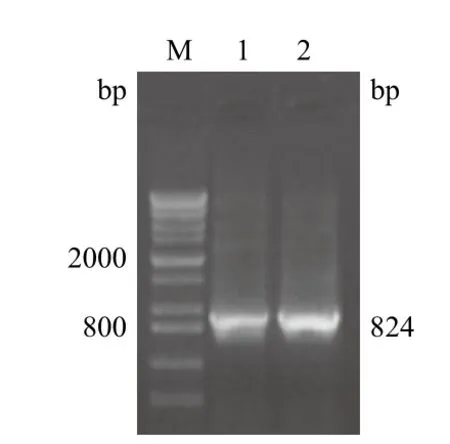
图1 VP1基因PCR产物电泳图
2.2 诱饵载体pDHB1-VP1的构建及鉴定
挑取阳性克隆,提取重组质粒。重组质粒经Sfi I双酶切后,可见800 bp附近的插入片段,提示重组质粒含有VP1基因(图2),测序结果与GenBank上公布的EMCV VP1 基因碱基序列一致。
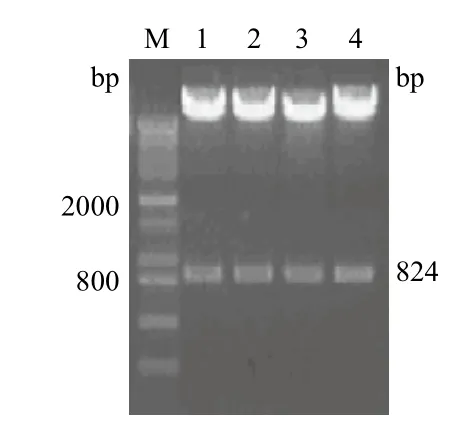
图2 重组质粒双酶切电泳图
2.3 pDHB1-VP1转化酵母菌NMY51
转化诱饵质粒pDHB1-VP1的酵母菌株NMY51在SD/-Leu培养基上长出红色菌落(图3),而未转化诱饵质粒的NMY51酵母菌在SD/-Leu平板上无菌落生长。随机挑取4个菌落进行PCR验证,凝胶电泳可以看到扩增产物,片段大小正确(图4),表明质粒已经成功转化进了酵母报告株NMY51中。

图3 诱饵载体pDHB1-VP1转化NMY51 SD/-Leu平板上生长克隆
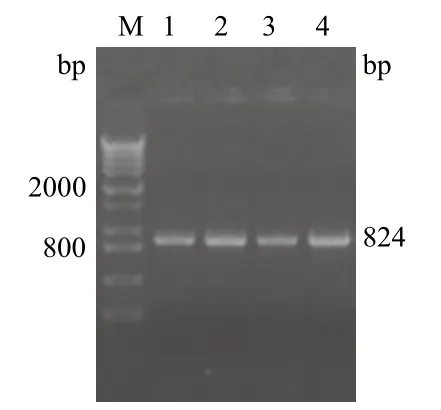
图4 诱饵载体pDHB1-VP1转化NMY51酵母菌后菌落PCR验证
2.4 pDHB1-VP1在酵母细胞中的表达
成功转化pDHB1-VP1诱饵载体的阳性菌在约66 kD 处有一条带,空载体阴性对照菌未见该条带;阳性菌表达产物经Western blotting分析及DAB显色后,显棕色结果(图5),证明表达产物具有天然VP1蛋白的免疫原性,能被兔抗EMCV的血清所识别。

图 5 表达产物的 Western blotting 图
2.5 pDHB1-VP1功能验证
将诱饵质粒分别与pOst1-NubI 、pPR3-N 共转化酵母报告株NMY51,诱饵质粒上含有泛素C末端编码序列,pOst1-NubI 质粒上含有泛素 N 末端序列,若诱饵质粒正确表达,完整的泛素蛋白将在酵母细胞内形成,启动报告基因的翻译,在酵母缺陷平板上长出菌落;pPR3-N 质粒上的泛素N 末端序列已被突变,与诱饵质粒共转化后不能在酵母细胞内翻译为泛素蛋白。
由诱饵质粒功能性验证试验(图6)可以看到,pDHB1-VP1+pOst1-NubI 在SD-D、SD-T和SD-Q 平板上均有大量白色菌落长出,pDHB1-VP1+pPR3-N只在SD-D 平板上有红色菌落长出,在SD-T和SD-Q平板上无明显菌落生长,说明诱饵质粒功能正常,对报告基因无自激活作用,可用于酵母双杂交系统筛选与VP1相互作用的靶细胞的蛋白。
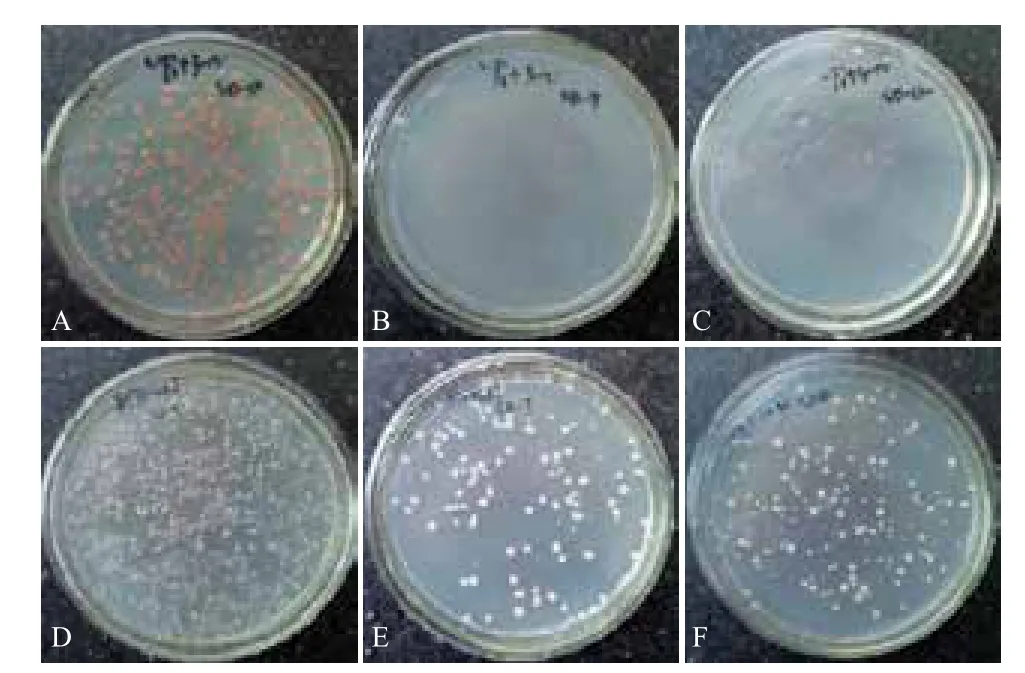
图6 诱饵质粒功能验证
3 讨论
酵母双杂交系统可以检测两个独立的蛋白是否可以发生相互作用,此外,也利用该系统在蛋白文库中筛选与已知蛋白相互作用的蛋白[16-18]。Huang等[19]利用酵母双杂交系统构建了丙肝病毒F蛋白诱饵质粒,从人肝细胞cDNA文库中筛选出了细胞结合蛋白。Regan 等[20]应用分裂泛素酵母双杂交系统,以HPV16E5蛋白为诱饵,筛选 Hela 细胞cDNA 文库,得到 HPV16E5的一个新的相互作用蛋白 B-cell-associated protein 31(Bap31)。
病毒感染细胞主要经过吸附,穿入与脱壳,合成,组装和释放等步骤,这些步骤是病毒与细胞蛋白相互作用的结果。EMCV的结构蛋白VP1,VP2和VP3在病毒感染及宿主识别过程中起着极为重要的作用[21]。这些蛋白中仅出现一个氨基酸突变就能对病毒的致病性产生重要影响[22]。本试验以VP1基因构建诱饵质粒,转化NMY51之后,其可在细胞中正常表达,产物大小约66 kD,而且有较好的免疫原性。同时诱饵质粒对报告基因无自激活作用,可用于酵母双杂交系统筛选与VP1相互作用的蛋白,为寻找EMCV细胞结合蛋白奠定基础。
4 结论
成功构建了pDHB1-VP1酵母双杂交诱饵载体,转化酵母报告菌株NMY51后,其可在细胞中正常表达,同时诱饵质粒对报告基因无自激活作用,可用于酵母双杂交系统。
[1]Margot C, Labib BK. The encephalomyocarditis virus[J]. Virulence, 2012, 3(4):351-367.
[2]Helwig FC, Schmidt CH. A filter-passing agent producing interstitial myocarditis in anthropoid apes and small animals[J]. Science,1945, 102(2637):31- 33.
[3]陆承平. 兽医微生物学[M]. 第3版, 北京:中国农业出版社,2001:559- 564.
[4]Garkavenko O, Muzina M, Muzina Z, et al. Monitoring for potentially xenozoonotic viruses in New Zealand pigs[J]. J Med Virol, 2004,72(2):338-344.
[5]Kume K, Sawata A, Nakase Y. Relationship between protective activity and antigen structure of Haemophilus paragallinarum serotypes 1 and 2[J]. Am J Vet Res, 1980, 41(1):97-100.
[6] Murnane TG, Craighead JE, Mondragon H, et al. Fatal disease of swine due to encephalomyocarditis virus.[J]. Science, 1960, 131(3399):498-499.
[7]Straw BE, Allaire SD, William L, et al. Diseases of Swine[M]. Ames, Iowa, USA:Iowa State University Press, 1999:139-144.
[8]Zimmermann A, Nelsen-Salz B, Kruppenbacher JP, et al. The complete nucleotide sequence and construction of an infectious cDNA clone of a highly virulent encephalomyocarditis virus[J]. Virol, 1994, 203(2):366-372.
[9]Psalla D, Psychas V, et al. Pathogenesis of experimental encephalomyocarditis:a histopathological, immunohistochemical and virological study in rats[J]. J Comp Pathol 2006, 134(1):30-39.
[10]施开创. 猪脑心肌炎病毒病原学及诊断方法的研究[D]. 北京:中国农业科学院, 2012:7.
[11]凡静静, 冯若飞, 马忠仁. 脑心肌炎病毒及其蛋白结构和功能研究进展[J]. 动物医学进展, 2012, 33(2):67-70.
[12]王丹, 冯若飞, 张海霞, 等.脑心肌炎病毒还介导等温扩增快速检测方法的建立及初步应用[J].中国兽医科学, 2013, 43(10):1067-1072.
[13]Sin JI, Sung JH, Suh YS, et al. Protective immunity against heterologous challenge with encephalomyocarditis virus by VP1 DNA vaccination:effect of coinjection with a granulocytemacrophage colony stimulating factor gene[J]. Vaccine, 1997,15(17-18):1827- 1833.
[14]Suh YS, Ha SJ, Lee CH, et al. Enhancement of VP1-specific immune responses and protection against EMCV-K challenge by co-delivery of IL-12 DNA with VP1 DNA vaccine[J]. Vaccine,2001, 19(15-16):1891-1898.
[15]李向茸, 冯若飞, 谢晶莹, 等.人血白蛋白的原核表达及应用[J].生物技术通报, 2013(11):130-135.
[16]Fields S, Song O. A novel genetic system to detect protein-protein interactions[J]. Nature, 1989, 340(6230):245-246.
[17]Chen T, Li M, Ding Y, et al. Identification of zinc-finger BED domain-containing 3(Zbed3)as a novel Axin-interacting protein that activates Wnt/beta-catenin signaling[J].J Biol Chem, 2009,284(11):6683-6689.
[18] Serebriiskii I. Yeast two-hybrid system for studying protein-protein interactions-stage 4:Isolation of library plasmid insert and second confirmation of positive interactions[J]. Cold Spring Harbor Protocols, 2010, 2010(5):pclb.prot5432.
[19]Huang YP, Cheng J, Zhang SL, et al. Screening of hepatocyte proteins binding to F protein of hepatitis C virus by yeast two-hybrid system[J]. World J Gastroenterol, 2005, 11(36):5659-5665.
[20]Regan JA,Laimins LA. Bap31 is a novel target of the human papilloma virus E5 protein[J]. Virol, 2008, 82:10042-10051.
[21]Whitton JL, Cornell CT, Feuer R. Host and virus determinants of picornavirus pathogenesis and tropism[J]. Nat Rev Microbiol,2005, 3:765-776.
[22]Jun HS, Kang Y, Notkins AL, et al. Gain or loss of diabetogenicity resulting from a single point mutation in recombinant encephalomyocarditis virus[J]. J Virol, 1997, 71:9782-9785.
(责任编辑 李楠)
Construction and Identification of Bait Vectors with VP1 Gene of Encephalomyocarditis Virus in Yeast Two-hybrid System
Xie Jingying1,3Feng Ruofei1,2Xu Lei3Zhang Haixia2Li Xiangrong2Hou Lanxin3Ma Zhongren2
(1. Key Bio-engineering and Technology Laboratory of the Northwest University for Nationalities,Lanzhou 730030;2.Gansu Engineering Research Center for Animal Cell,Lanzhou 730030;3. Life Science and Engineering College of Northwest University for Nationalities,Lanzhou 730030)
Bait vector pDHB1-VP1 was constructed for screening cellular proteins interacting with VP1 protein of encephalomyocarditis virus from yeast two-hybrid cDNA library of target cells in this study. VP1 gene was amplified and cloned into pMD18-T vector. After being verified by sequencing, it was directional cloning into bait vector pDHB1 of yeast two-hybrid system. Then the recombinant plasmid was identified by enzyme digestion and sequencing and transformed into yeast cells NMY51.The bait vectors’ expression and self-activation to reporter genes were tested.The results showed that the bait plasmid pDHB1-VP1 could express in yeast cells, and product size was 66 kD. It was specific binding with rabbit anti EMCV serum, which showed better immunogenicity. Bait plasmid pDHB1-VP1 was successfully constructed, could express in yeast cells and proved to be no self-activation to reporter genes.It could be used in the yeast two-hybrid system screening test.
encephalomyocarditis virus;vp1 protein;yeast two-hybrid;bait
10.13560/j.cnki.biotech.bull.1985.2015.01.030
2014-09-26
国家自然科学基金项目(31460665,31160033),教育部“长江学者和创新团队发展计划”项目(IRT13091),西北民族大学研究生科研创新项目(ycx13180)
谢晶莹,女,硕士研究生,E-mail:xjy_1314@126.com
马忠仁,男,教授,研究方向:人畜共患病;E-mail:mazhongren@xbmu.edu.cn
