细胞密度和营养供给对H1N1流感病毒产率的影响
2015-10-25孔文刚黄锭罗剑周琳婷陈则刘旭平谭文松邓献存
孔文刚黄锭罗剑周琳婷陈则刘旭平谭文松邓献存,3
(1.华东理工大学 生物反应器工程国家重点实验室,上海 200237;2.上海生物制品研究所有限责任公司,上海200052;3.浙江海正药业股份有限公司,杭州 311404)
细胞密度和营养供给对H1N1流感病毒产率的影响
孔文刚1黄锭1罗剑2周琳婷2陈则2刘旭平1谭文松1邓献存1,3
(1.华东理工大学 生物反应器工程国家重点实验室,上海 200237;2.上海生物制品研究所有限责任公司,上海200052;3.浙江海正药业股份有限公司,杭州 311404)
探究细胞培养生产流感病毒过程中,高细胞密度引起低单位细胞病毒产率(Svy)的原因及找到解决方法。通过增加微载体浓度以及换液操作获得较高的细胞密度;考察了感染时细胞密度(CCI)和病毒感染用维持培养基对病毒产量和单位细胞病毒产率的影响。在12.6 g/L微载体培养过程中,通过换液操作,可获得高细胞密度,达到1.47×107cells/mL。在CCI为1×107cells/mL条件时,选择合适的维持培养基,其Svy最高达到5.14×103virions/cell,比同等条件下用DMEM维持培养基的Svy值提高了近一倍。高密度培养MDCK细胞生产流感病毒时,充分考虑不同阶段的培养条件和营养需求,可以提高细胞密度和单位细胞病毒产率,进而提高流感病毒的产量。该研究结果为工业化生产流感病毒疫苗提供了基础数据。
高密度培养;MDCK;流感;病毒
流感病毒(Influenza virus)具有高传染性,极易发生流行,疫苗是应对流感流行最好的方法,有效的流感疫苗是预防和控制流感大流行的基石。由于传统鸡胚生产流感病毒存在产量低,批次间差异大,质量不稳定等问题[1],1995年WHO建议各流感疫苗生产企业使用哺乳动物细胞培养流感病毒来替代鸡胚培养以快速制备流感疫苗,使其抗原性更接近自然流行株[2,3]。其中,连续细胞系犬肾细胞(MDCK)已被用于生产流感疫苗[4-7]。
利用细胞培养生产流感病毒的过程中,提高病毒感染时的细胞密度(CCI)和单位细胞病毒产率(Svy)可以提高病毒的总产量[8,9]。因此,工业化生产疫苗过程中,为了获得更多的流感病毒液,往往追求较高的细胞密度。通常情况下通过优化培养条件,如提高培养过程中微载体的浓度[2,3],细胞生长后期更换新鲜培养液,都可以获得较高的细胞密度。但高细胞密度条件下并不一定能获得高病毒产量,在细胞密度高的情况下进行接毒,单位细胞病毒产率反而下降,即“高细胞密度低病毒产率”的现象,该现象被称为 “细胞密度效应”[10]。目前,大多数学者认为“细胞密度效应”可能是由于培养环境中营养物(如谷氨酰胺,葡萄糖等)的不足或代谢副产物(如乳酸、氨等)累积引起的。为此,通过灌注,多次流加的方式可以解除营养物不足或代谢副产物累积的限制,消除细胞密度效应,使得单位细胞病毒产率得到提高[3]。但同时,这些操作模式都需要特殊的细胞截留装置以及合适的补料控制策略,增加了生产的技术难度和培养污染的机会,提升了生产工艺的复杂性,这些都不利于大规模工业化生产流感疫苗[11,12]。因此,如果能通过合适的营养供给,采用简单的批式培养方式就能解除细胞密度效应,达到较高的病毒产率,具有显著的创新和应用价值。
本研究通过研究微载体浓度及细胞培养过程中更换新鲜培养基对细胞生长代谢的影响,以期获得较高的细胞密度。进而,研究高细胞密度和病毒复制阶段营养供给对流感病毒产量和单位细胞产病毒效率的影响,选择合适的营养供给策略,提高高细胞密度条件下的病毒产量,为高密度培养MDCK细胞大规模工业化生产流感病毒工艺开发工作提供基础数据。
1 材料与方法
1.1 材料
1.1.1 细胞株和病毒株 犬肾上皮连续细胞系MDCK(Madin-Daby canine kidney cells)细胞,购自ATCC。病毒株:甲型流感病毒株A/PR8/34(H1N1)来源于上海生物制品研究所有限责任公司。
1.1.2 培养基 基础培养基:DMEM(Gibco公司)补加3700 mg/L碳酸氢钠(Amresco公司)和和10%(V/V)胎牛血清FBS(Fatal Bovine Serum,Gibco公司),渗透压为300 mOsm/kg。
病毒感染用维持培养基:A:1.5×(DMEM/F12),渗透压为472 mOsm/kg;B:1.5×DMEM,渗透压443 mOsm/kg;C:DMEM,补加葡萄糖至45 mmol/L,谷氨酰胺至15 mmol/L,渗透压为330 mOsm/kg;D:DMEM,补加葡萄糖至50 mmol/L,谷氨酰胺至14 mmol/L,氨基酸和维生素的量按F12培养基的5倍量添加,渗透压为372 mOsm/kg。
1.2 方法
1.2.1 细胞培养方法 MDCK细胞搅拌瓶培养:将消化后的细胞接种至装有微载体的无菌搅拌瓶,接种密度为5×105-6×105cells/mL,微载体用量为3 g/L或12.6 g/L,搅拌转速为60 r/min,工作体积为150 mL,置于37 ℃、5% CO2的培养箱中培养。每24 h取样计数,取上清液测营养物及代谢副产物浓度。
MDCK细胞换液培养:基本操作与MDCK细胞搅拌瓶培养相同,每24 h去除旧的培养基,并加入等体积新鲜培养基。
不同CCI条件下流感病毒的生产:基本操作与MDCK细胞搅拌瓶培养相同,细胞培养至72 h时调整细胞密度至1×106,5×106,10×106cells/mL,去除旧培养基,换为等体积病毒染维持培养基,以MOI为0.01接入病毒种子液进行培养。
1.2.2 细胞计数 以结晶紫染色,用血球计数板计数,每个样重复3次,取平均值。
1.2.3 葡萄糖、乳酸和氨浓度的测定 葡萄糖浓度采用葡萄糖试剂盒(购自上海科欣生物技术研究所)测定。乳酸浓度用乳酸测定试剂盒(购自南京建成生物工程研究所)测定。氨浓度采用尿素氮试剂盒(购自上海申索试剂有限公司)测定,操作按使用说明书进行。
1.2.4 HA的检测方法 采用 HA血凝效价试验测定。首先将病毒悬液在第一个孔中与PBS等量混合,再依次半数倍比稀释至后续孔中;分别加入0.5%(V/V)的鸡血红细胞悬液进行震荡混匀,约30 min后观察结果,计算病毒HA血凝效价。单位细胞病毒产率Svy(virions/cell)的计算方法见文献[3]。
2 结果
2.1 微载体浓度和换液操作对MDCK细胞生长的影响
图1是两种微载体浓度条件下批式培养和换液培养过程中MDCK的生长曲线。批式培养过程中,在3 g/L,12.6 g/L 两种微载体浓度条件下,72 h时细胞密度都达到最大值,分别为42.8和51.7×105cells/mL,之后细胞密度下降,进入衰亡期。换液培养过程中,3 g/L条件下,72 h时达到最高细胞密度为52.73×105cells/mL,随后细胞数稍有下降,144 h时细胞密度为37.85×105cells/mL。而在12.6 g/L条件下,96h时细胞达到最高密度为147.75×105cells/mL,之后细胞稍有下降,144 h时细胞密度为131.35×105cells/mL。与批式培养过程比较,换液操作条件下3 g/L和12.6 g/L微载体浓度条件下最高细胞密度相应提高了23%和185 %。
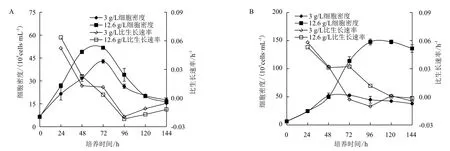
图1 3 g/L,12.6 g/L微载体浓度条件下批式培养(A)与换液培养(B)中MDCK细胞的生长曲线
2.2 病毒感染时细胞密度(CCI)对病毒扩增的影响
通过提高微载体浓度和换液操作两个策略能获得较高的细胞密度,可达107cells/mL。在此基础上,本研究进一步考察了不同CCI条件下MDCK细胞生长、流感病毒生产特征(如图2,3所示),同时也分析了其对培养过程中营养物代谢及代谢副产物生成的影响(图4)。从图2可以看出,3种CCI条件对接毒后MDCK细胞的生长无明显影响。在接入病毒后 24 h内,3种CCI条件下细胞密度均急剧下降,24 h时已低于接种病毒时密度的50%,接毒72 h后活细胞数几乎为零。
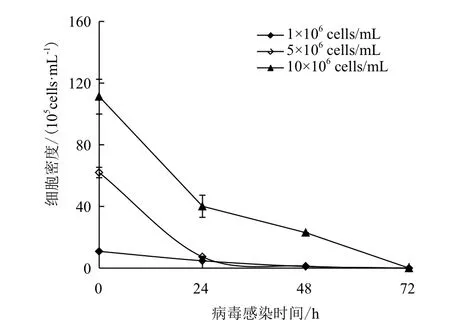
图2 接毒后3种CCI条件下MDCK的生长曲线
由图3可知,CCI越大,HA的值越大,10×106cells/mL条件下的HA值比1×106cells/mL提高了2.5个单位,较5×106cells/mL只提高了0.5个单位。分析相对应的Svy值可知,CCI越高,Svy越低。10× 106cells/mL条件下的Svy值仅为1×106cells/mL条件下的50 %,5×106cells/mL条件下的72 %。
从图4可以看出,在CCI为1×106cells/mL条件下,接毒后72 h葡萄糖浓度为10.72 mmol/L,谷氨酰胺为1.19 mmol/L;CCI为5×106cells/mL条件下,接毒后72 h葡萄糖为4.61 mmol/L,谷氨酰胺为0.93 mmol/L;而CCI为10×106cells/mL条件下,接毒后48 h时葡萄糖,谷氨酰胺的浓度分别为0.72,0.05 mmol/L,72 h的浓度都为0 mmol/L。3种CCI下乳酸浓度都在18-29 mmol/L,氨在1.7-2.5 mmol/L范围内波动。以上结果说明,后期营养供给不足,可能是高CCI条件下,单位细胞病毒产率下降的主要原因。
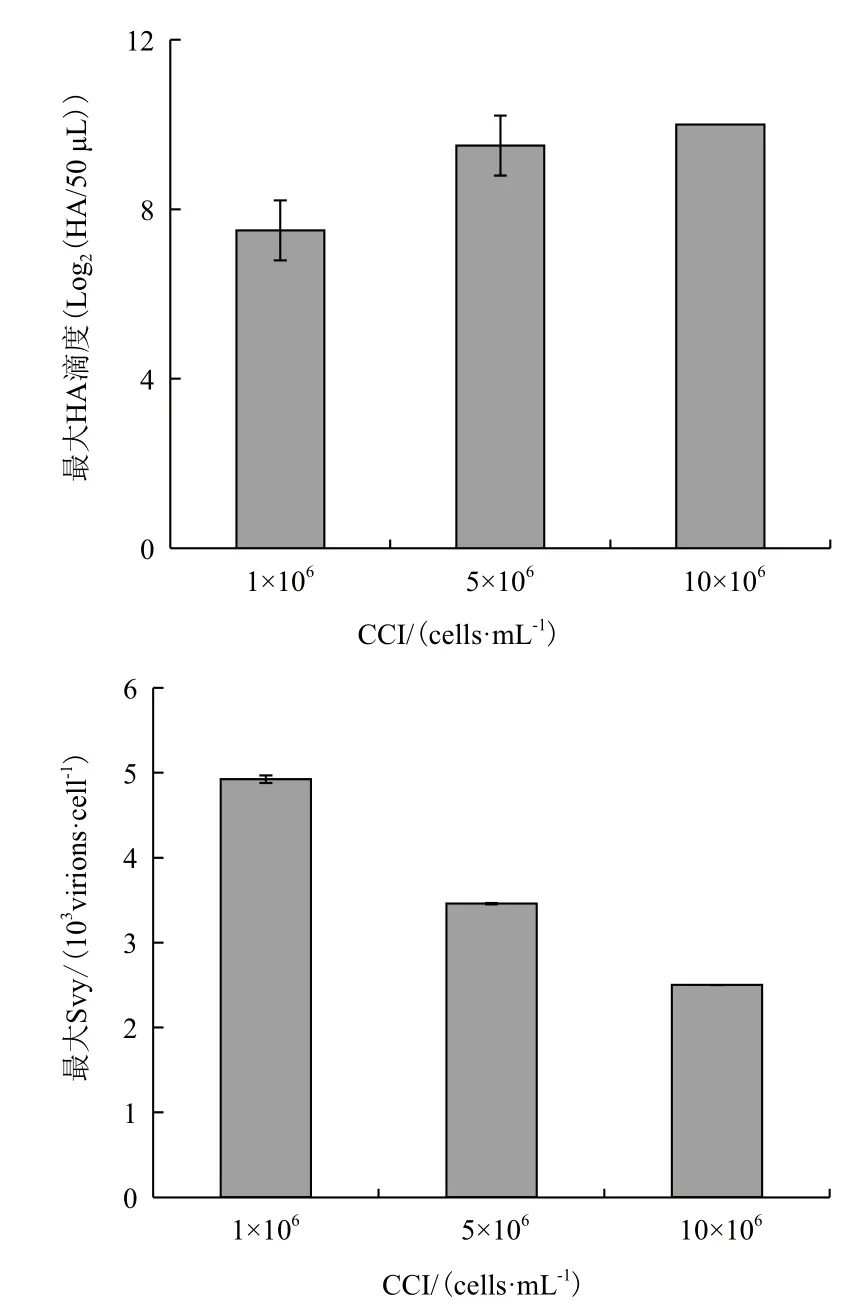
图3 不同CCI条件下MDCK细胞中流感病毒最大HA滴度与Svy值
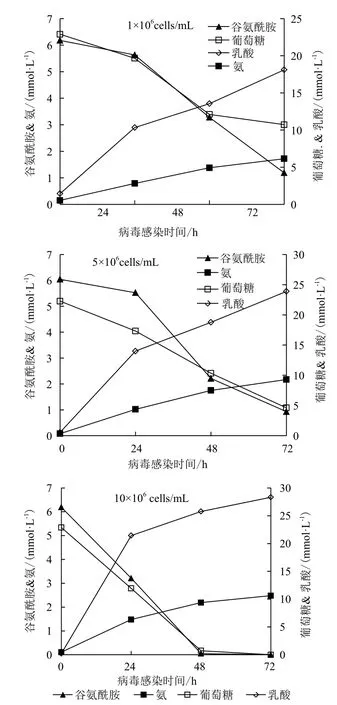
图4 不同CCI条件下MDCK细胞培养中谷氨酰胺、氨、葡萄糖和乳酸的浓度变化
2.3 病毒感染过程中营养对病毒扩增的影响
随着CCI的提高,相对应的Svy值不增反降低。如上分析,该现象可能是由培养后期营养供给不足造成的,需要对维持培养基中营养组分进行合理调整。为此,本研究考察了不同维持培养基对细胞生长和病毒复制扩增的影响(图5,图6)。由图5可知,在A、B、C、D四种条件下,病毒感染后细胞生长特征相似,接毒48 h后细胞密度均低于初始密度的50 %,感染72 h后基本细胞几乎完全死亡。
测定病毒的最大HA滴度和计算相应的Svy值可以发现(图6),A、B、C、D四种条件下最大的HA值分别为9、8.5、10、11 log2(HA/50 μL),相 应 的Svy分 别 为1.29、1.04、2.57、5.14×103virions/cell。A和B组Svy均低于以DMEM基础培养基作为病毒复制维持液的对照组的Svy值(2.5×103virions/cell);C组与DMEM对照组Svy值差不多;而D组Svy值则比DMEM对照组提高了将近1倍。至于A和B提高了营养组分却引起Svy下降的主要原因可能是培养基渗透压过高引起的。当渗透压高于400 mOsm/kg[13]时,将会对细胞生长产生不利影响,进而影响病毒的复制扩增。
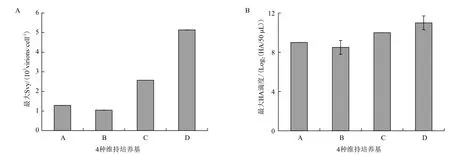
图6 四种维持培养基条件下流感病毒最大的Svy值(A)与HA滴度(B)
3 讨论
贴壁细胞的最大细胞密度会受到微载体表面积的影响,一般可通过增加微载体的用量来提高细胞最大密度。在批式培养过程中,12.6 g/L微载体上的细胞密度只比3 g/L微载体上的细胞高20%。通过换液操作,3 g/L微载体上的细胞密度提高了23%,而12.6 g/L的细胞密度提高了185 %,达到1.47×107cells/mL,为3 g/L的3.9倍。可以看出在低浓度微载体条件下,细胞密度的主要限制因素为微载体的表面积,而在高微载体浓度条件下主要限制因素为营养物的耗竭。由此推断,在高微载体浓度下加强营养供给能够获得较高的细胞密度。
不同CCI条件下接入病毒种子液发现,HA滴度随着CCI的提高而提高,但病毒的Svy不升反降,即存在“细胞密度效应”。究其原因,在病毒感染48 h后时,培养液的葡萄糖和谷氨酰胺已经耗尽,后期营养物的耗竭很可能是Svy降低的原因。为此,在CCI为1×107cells/mL条件下考察了不同维持培养基对Svy值的影响。结果表明充足的营养供给可以提高Svy值,D组的营养方式下,Svy值较DMEM对照组提高了近一倍,达5.14×103virions/cell。Bock等[3]通过灌注或多次流加等复杂培养方式来提高流感病毒产量,其Svy为2.4×103virions/cell,仅比其批式培养过程Svy值(2.1×103virions/cell)提高了14.29%。本研究通过维持培养基的选择,应用简单的批式培养模式便使Svy得到大幅提升。由此可见,简单的增强营养供给并不一定能够使流感病毒生产效率得到显著,选择合适的维持培养基更重要。
4 结论
本研究通过微载体浓度选择和和换夜培养操作提高了批式培养过程中MDCK细胞密度,并通过维持培养基的选择及简单的营养调整策略解除了高细胞密度培养生产流感病毒过程中的细胞密度效应,提高了单个细胞的产毒能力,从而获得较高的病毒产量,为工业化生产流感疫苗提供了数据参考。
[1] George M, Farooq M, Dang T, et al. Production of cell culture(MDCK)derived live attenuated influenza vaccine(LAIV)in a fully disposable platform process[J]. Biotechnology and Bioengineering, 2010, 106(6):906-917.
[2] Hu AYC, Weng TC, Tseng YF, et al. Microcarrier-based MDCK cell culture system for the production of influenza H5N1 vaccines[J]. Vaccine, 2008, 26:5736-5740.
[3]Bock A, Schulze-Horsel J, Schwarzer J, et al. High-density microcarrier cell cultures for influenza virus production[J]. Biotechnology Progress, 2011, 27(1):241-50.
[4]Genzel Y, Behrendt I, Konig S, et al. Metabolism of MDCK cells during cell growth and influenza virus production in large-scalemicrocarrier culture[J]. Vaccine, 2004, 22(17-18):2202-2208.
[5]Genzel Y, Reichl U. Continuous cell lines as a production system for influenza vaccines[J]. Vaccine, 2009, 8(12):1681-1692.
[6]Schulze-Horsel J, Schulze M, Agalaridis G, et al. Infection dynamics and virus-induced apoptosis in cell culture-based influenza vaccine production-Flow cytometry and mathematical modeling[J]. Vaccine, 2009, 27(20):2712-22.
[7]Sun B, Yu X, Kong W, et al. Production of influenza H1N1 vaccine from MDCK cells using a novel disposable packed-bed bioreactor[J]. Applied Microbiology and Biotechnology, 2013, 97(3):1063-70.
[8]Lohr V, Genzel Y, Behrendt I, et al. A new MDCK suspension line cultivated in a fully defined medium in stirred-tank and wave bioreactor[J]. Vaccine, 2010, 28(38):6256-64.
[9]Aggarwal K, Jing F, Maranga L, et al. Bioprocess optimization for cell culture based influenza vaccine production[J]. Vaccine, 2011, 29(17):3320-3328.
[10] Maranga L, Brazão TF, Carrondo MJT. Virus-like particle production at low multiplicities of infection with the baculovirus insect cell system[J]. Biotechnology and Bioengineering, 2003, 84(2):245-253.
[11] Henry O, Dormond E, Perrier M, et al. Insights into adenoviral vector production kinetics in acoustic filter-based perfusion cultures[J]. Biotechnology and Bioengineering, 2004, 86(7):765-774.
[12] Pohlscheidt M, Bodeker B, Langer U, et al.. Interpretation data for bioreactors for the increase of scale of a microcarrier-based virus production process[J]. Chemie Ingenieur Technik, 2008, 80:821-830.
[13] de Zengotita VM, Schmelzer AE, Miller WM. Characterization of hybridoma cell responses to elevated pCO2and osmolality-intracellular pH, cell size, apoptosis, and metabolism[J]. Biotechnology and Bioengineering, 2002, 77(4):369-380.
(责任编辑 李楠)
Effect of Cell Density and Nutrition Supply on Cell-specific Virus Yields of Influenza Virus H1N1
Kong Wengang1Huang Ding1Luo Jian2Zhou Linting2Chen Ze2Liu Xuping1Tan Wensong1Deng Xiancun1,3
(1. State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237;2. Shanghai Institute of Biological Products,Shanghai 200052;3. Zhejiang Hisun Pharmaceutical(Hangzhou)Co.Ltd,Hangzhou 311404)
It was to investigate the phenomenon that high cell density with low cell-specific virus yields and find out the solution. Methods:High cell density was achieved by increasing the microcarrier concentration and enhancing nutrition supply, then the effect of cell concentration at infection(CCI)and virus maintenance medium(VMM)on virus titer and cell-specific virus yield(Svy)was studied. Results:The maximum cell density was up to 1.47×107cells/mL in 12.6 g/L microcarrier culture using medium exchange strategy. Under high CCI(1×107cells/mL)condition, the Svy was up to 5.14×103virions/cell by choosing appropriate virus maintenance medium, which is nearly twice of Svy in DMEM. Conclusion:In order to achieve higher influenza virus titer, culture conditions and nutrition demands at different stages of influenza production should be taken into consideration. The results in this work provide guidance for further development of industrial-scale vaccine production processes.
high-density culture;MDCK;influenza production;virions
10.13560/j.cnki.biotech.bull.1985.2015.01.031
2014-10-28
国家自然科学基金项目(21106045,21206040),国家“863”计划(2012AA02A303),国家重大专项(2013ZX10004003-003-003),中央高校基本科研业务费(WF1214035)
孔文刚,男,硕士研究生,研究方向:动物细胞的大规模培养;E-mail:abcd669855@126.com
刘旭平,E-mail:xupingliu@ecust.edu.cn;谭文松,E-mail:wstan@ecust.edu.cn
