固定化酶法测定微量组分
2015-10-16柳畅先
宁 静, 柳畅先
(中南民族大学化学与材料科学学院,分析化学国家民委重点实验室,湖北武汉 430074)
固定化酶是用适当方法将酶固定于一定空间内,在保持自身特性时又能再回收和重复使用的酶制品,上世纪70年代以来对于固定化酶的研究非常活跃[1,2],其领域多为应用基础、工业生产等[3 - 6]。酶法测定具有高灵敏度和专一性,但游离酶的催化反应易受高温破坏和其它环境因素的影响,固定化酶稳定性较游离酶好,所以在分析测定方面也是研究热点[7,8]。壳聚糖是甲壳素的脱乙酰基产物,分子链中存在大量的氨基和羟基,可通过改性和交联,使其具有更多的功能[9 - 12]。
本文从酶法测定的角度探讨固定化酶的制备及性质,以微米级的壳聚糖作为载体,采用共价结合法制备固定化醇脱氢酶(ADH)和脲酶(UASE),对两种酶进行催化动力学研究,利用固定化酶测定试样中的微量组分。
1 实验部分
1.1 仪器与试剂
721-2A型分光光度计(湖南益阳市仪表厂);752型紫外-可见分光光度计(上海光谱仪器有限公司);JJ-1型精密增力电动搅拌器(金坛市科兴仪器厂);pHS-3C型精密pH计(上海雷磁仪器厂);FA-2004型分析天平(上海精科天平);CS-501型超级恒温水浴槽(武汉实验仪器厂);DF-101S型集热式恒温加热磁力搅拌器(河南省予华仪器有限公司);SHZ-D型循环真空泵(上海东玺制冷仪器设备有限公司);XYJ81-1型电动离心机(金坛市恒丰仪器厂);SHA-C型水浴恒温振荡器(江苏医疗仪器厂)。
壳聚糖(国药集团化学试剂有限公司),25%戊二醛水溶液(上海国药集团化学试剂有限公司),Span80(上海国药集团化学试剂有限公司),液体石蜡(上海国药化学试剂有限公司),醇脱氢酶(ADH,Sigma公司),脲酶(UASE,BDH chemicals公司),0.05 mol/L氧化型烟酰胺腺嘌呤二核苷酸(NAD),0.1 mol/L三羟甲基氨基甲烷(Tris)-HCl缓冲溶液,0.25 mol/L 磷酸盐缓冲溶液,1.7 mol/L乙醇标准溶液,0.010 mol/L Ag+标准溶液,0.50 mol/L尿素标准溶液。
1.2 实验方法
1.2.1固定化酶的制备在0.6 g壳聚糖中加入20 mL 5%HAc,搅拌溶解后倒入加有80 mL液体石蜡和3 mL Span80的三颈瓶中,25 ℃ 搅拌30 min,加入10 mL 7%戊二醛,40 ℃ 搅拌1 h,用NaOH溶液调节pH=10~11,70 ℃ 搅拌2 h。将溶液倒入烧杯中,加入30 mL石油醚和30 mL丙酮,搅拌后静置分层,弃去上层油相,用石油醚和丙酮分次洗涤并抽滤,4 ℃干燥,得到固定化酶载体。取0.25 g该载体于锥形瓶中,加入30 mL 0.1 mol/L Tris-HCl缓冲液(pH=6.5),10 mL 35 U/mL ADH溶液,室温搅拌2.5 h,水洗并抽滤,得固定化ADH。另取0.1 g该载体于装有10 mL 0.25 mol/L磷酸盐缓冲溶液(pH=5.0)的锥形瓶中,加入10 mL 45 U/mL UASE溶液,室温搅拌1.5 h,经水洗抽滤得到固定化UASE。
1.2.2酶活力的测定于比色皿中加入3 mL 0.05 mol/L Tris-HCl缓冲液(pH=8.0),80 μL 0.05 mol/L NAD溶液,50 μL 1.7 mol/L乙醇标准溶液,10 μL ADH溶液,快速混匀后在340 nm处测定吸光度变化值,计算游离酶活力。称取100 mg固定化ADH于离心管中,加入3 mL 0.1 mol/L Tris-HCl缓冲液(pH=8.4),100 μL 0.05 mol/L NAD溶液,80 μL 17 mol/L乙醇标准溶液后快速混匀,静置2 min并离心2 min,取上层清液1 mL到加有2 mL 0.05 mol/L Tris-HCl缓冲液(pH=8.4)的比色皿中,在340 nm处测定吸光度变化值,计算固定化酶活力和酶固载量。
于微量离心管(EP管)中加入200 μL 0.25 mol/L 磷酸盐缓冲溶液(pH=7.0),500 μL 0.50 mol/L尿素标准溶液,10 μL UASE溶液后混匀,反应2 min,加入300 μL 1 mol/L H2SO4并快速混匀,移入10 mL比色管中,用水稀释至刻度,加入1 mL纳氏试剂,测定425 nm处吸光度变化值,计算游离酶活力。于离心管中加入3 mL 0.25 mol/L 磷酸盐缓冲溶液(pH=7.0),50 mg固定化UASE,500 μL 1.50 mol/L尿素标准溶液后快速混匀,静置1 min并离心2 min,取1 mL上清液至10 mL比色管中,用水稀释至刻度,加入1 mL纳氏试剂,测定425 nm处吸光度变化值,计算固定化酶活力和酶固载量。酶活力计算公式为:v=△A×V/(△t×ε×b),ρ=v/m。式中,v为酶活力(μmol/min);△A为吸光度变化值;V为反应液体积(mL);△t为时间变化值(min);ε为摩尔吸收系数(L/(mmol·cm));b为光程(cm),ρ为酶固载量(U/g),m为载体质量(g)。相对酶活力=(酶活力/酶活力最大值)×100%。
根据米氏方程:1/v=Km/vmaxcsub+1/vmax。式中,v为酶促反应速度(μmol/min);Km为米氏常数(mol/L);vmax为最大酶促反应速度(μmol/min);csub为底物浓度(mol/L)。可以求出底物或抑制剂的浓度1/v=a+bcinh。式中,v为酶促反应速度(μmol/min);cinh为抑制剂浓度(mmol/L);a和b为常数。
2 结果与讨论
2.1 固定化条件
偶联时间长可使酶分子和载体充分接触,与活性基团发生共价偶联,但时间过长时,可能载体孔径变小后底物不容易与酶结合,导致酶促反应速度降低而使酶固载量下降。随着交联剂戊二醛浓度的增加,酶固载量相应增大,但戊二醛浓度过高时酶固载量则降低。在不同pH值的溶液中制备固定化酶,酶吸附量和活性会受电性的影响,pH的改变也会影响溶液中载体的电性。固定化的最适条件:ADH和UASE的偶联时间分别为2.5 h和1.5 h,交联剂戊二醛浓度为0.6%和0.5%,偶联pH值为6.8和5.0。ADH的酶固载量为4~4.5 U/g,UASE的酶固载量为170~200 U/g。
2.2 酶学性质
2.2.1反应温度对酶活力的影响在不同温度下分别对游离酶和固定化酶进行活力测定,游离和固定化UASE分别在60 ℃和72 ℃时活力最大,游离和固定化ADH在33 ℃和35 ℃时活力最大,如图1所示。温度升高有利于酶催化反应,但是温度过高又会导致酶的高级结构遭到破坏,使得活力降低。固定化ADH对温度的变化较敏感,但只需在酶法测定时控制好条件,如使用恒温水浴,就能够得到准确结果。
2.2.2反应pH对酶活力的影响在不同pH值的缓冲体系中分别对游离酶和固定化酶的活力进行测定,如图2所示,游离和固定化UASE均在pH=7.0时活力最大;游离和固定化ADH分别在pH=8.0和pH=8.4时活力最大。
2.2.3米氏常数米氏常数(Km)在数值上等于酶促反应达到其最大速度一半时的底物浓度,显示了酶和底物之间的亲和力。测出游离和固定化UASE的Km为0.4 mmol/L和2 mmol/L;游离和固定化ADH的Km为48 mmol/L和13 mmol/L,见图3。
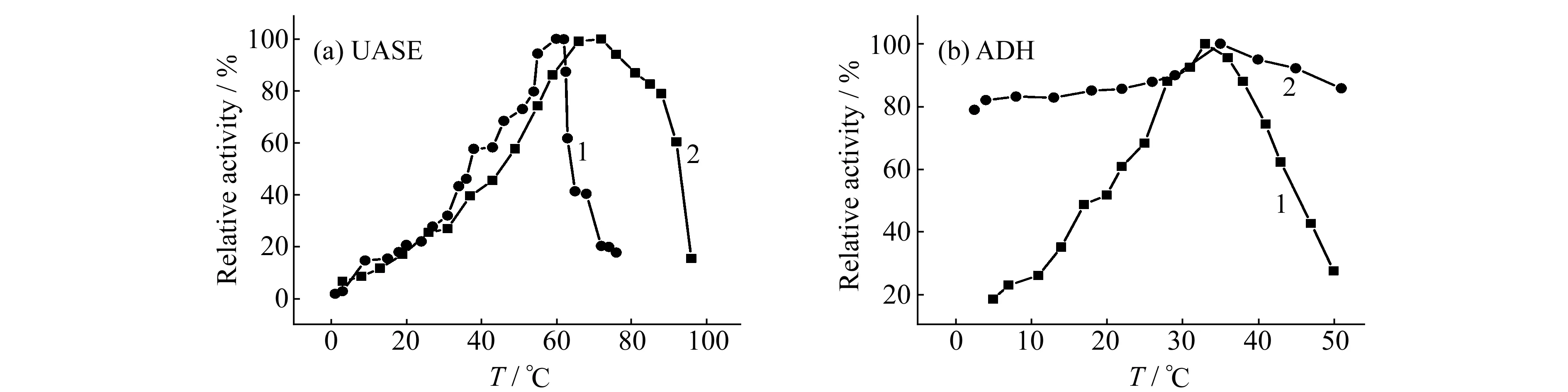
图1 温度对酶活力的影响Fig.1 Effect of temperature on the enzymatic activity 1.immobilized enzyme(UASE:pH=7.0,curea=10 mmol/L,ADH:pH=8.4,calc=0.22 mol/L,cNAD=1.6 mmol/L);2.free enzyme(UASE:pH=7.0,curea=25 mmol/L,ADH:pH=8.0,calc=27 mmol/L,cNAD=1.3 mmol/L).

图2 pH对酶活力的影响Fig.2 Effect of pH on the enzymatic activity1.immobilized enzyme(UASE:curea=10 mmol/L,ADH:calc=0.22 mol/L,cNAD=1.6 mmol/L);2.free enzyme(UASE:curea=25 mmol/L,ADH:calc=27 mmol/L,cNAD=1.3 mmol/L).
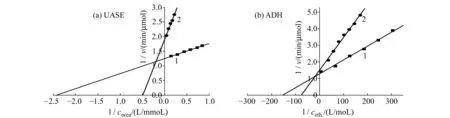
图3 Lineweaver-Burk曲线Fig.3 Lineweaver-Burk curves1.immobilized enzyme(UASE:pH=7.0,ADH:pH=8.4,cNAD=1.6 mmol/L);2.free enzyme(UASE:pH=7.0,ADH:pH=8.0,cNAD=1.3 mmol/L).
2.2.4固定化酶的复用性将两种固定化酶在室温下分别连续进行催化反应,使用8次后,UASE活力保持了50%,ADH活力保持了70%,ADH比UASE有更好的操作稳定性。而游离酶进行催化反应时只能使用1次,所以相对于游离酶来说,固定化酶具有较大的优越性。
2.3 用固定化酶进行试样测定
2.3.1固定化UASE酶法测定底物按实验方法测出尿素标准溶液的酶促反应速度,标准曲线在0.4~3 mmol/L 范围内呈线性关系。回归方程为:1/v=1.74/c+0.42,r=0.9936。测定了小牛血清试样中尿素含量并进行加标回收,结果见表1。
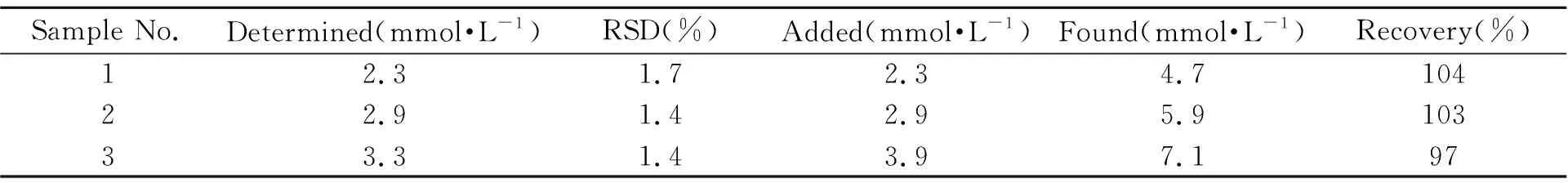
表1 尿素测定结果(n=5)
2.3.2固定化ADH酶法测定抑制剂按实验方法测出Ag+标准溶液的酶促反应速度,标准曲线在10~100 nmol/L范围内有线性关系。回归方程为:1/v=26.2c+1.80,r=0.9949。测定了模拟试样(基体为湖水)中Ag+含量,结果见表2。

表2 Ag+的测定结果与回收率(n=5)
3 结论
实验得到酶的最佳固定化条件是:ADH和UASE的偶联时间分别为2.5 h和1.5 h,戊二醛浓度为0.6%和0.5%,偶联pH值为6.8和5.0。ADH酶促反应的最适宜pH为8.0和8.4,温度为33 ℃和35 ℃,Km为48、13 mmol/L;UASE酶促反应的最适宜pH均为7.0,温度为60 ℃和72 ℃,Km为0.4、2 mmol/L。
