固相萃取-高效液相色谱法测定饮料中多菌灵和噻菌灵
2015-10-16吴剑虹
吴剑虹, 王 珏
(1.武汉纺织大学化学与化工学院,湖北武汉 430200;2.上海分子治疗与新药创制工程技术研究中心,华东师范大学,上海 200062)
图1 多菌灵与噻菌灵的结构式Fig.1 Structure of carbendaizin and thiabenzole
2012年,美国饮料巨头-百事可乐和可口可乐在自检中发现旗下品牌的橙汁中含有微量杀菌剂多菌灵,其来源是从巴西进口的橙汁原料。我国的橙汁75%左右依赖进口,其中2011年巴西向中国出口橙汁(66°糖度)达5.3952万吨[1]。多菌灵(Carbendazim,CBZ)和噻菌灵(Thiabendazole,TBZ)属于苯并咪唑类杀菌剂(Benzimidazole Fungicide)中的代表性农药,结构见图1。它们是广谱内吸性杀菌剂,广泛应用于果树、蔬菜、花卉及大田农作物病害的防治。多菌灵毒性不强,但半衰期却长达20多天,在哺乳动物胃内能发生亚硝化反应,形成亚硝基化合物,会增加动物肝脏患肿瘤的风险[2]。
美国环境保护局规定橙汁残渣里多菌灵的含量标准为80 μg/L;欧盟制订的标准是200 μg/L;澳大利亚的标准更苛刻,是不超过10 μg/L。我国的农业部和卫生部在《食品中多菌灵最大残留限量标准》中规定柑橘的最大残留限量为5 000 μg/L,远远低于欧美标准。因此,为保障人们的健康,建立果汁中多菌灵和噻菌灵的快速、高效的检测很有必要。
目前,对多菌灵和噻菌灵的检测方法主要是经C18、混合弱阳离子交换(MCX)或强阳离子交换(SCX)等小柱纯化后,用高效液相色谱-紫外检测法或其它方法进行检测[3 - 11]。本研究采用HiCapt CT固相萃取(SPE)柱对食品中的多菌灵和噻菌灵进行富集净化,建立了高效液相色谱-紫外检测法测定饮料中的农药多菌灵和噻菌灵残留的分析方法。该方法可以有效除去果汁中的基质干扰,同时具备简单、快速、灵敏的优点,可用于果汁中多菌灵和噻菌灵的检测,对制定果汁中多菌灵和噻菌灵检测的国家标准有一定的参考价值。
1 实验部分
1.1 仪器、试剂及材料
FL 2200-2高效液相色谱系统(浙江福立分析仪器有限公司),附FL 2200-2二元泵及FL 2200-2紫外可见检测器;HSE-12B固相萃取装置(天津恒奥科技发展有限公司);WH-3微型涡旋混合器(上海沪西分析仪器厂有限公司);高速离心机(上海安亭仪器公司);HGC-12 A型氮吹仪(北京中科三环仪器公司)。HiCapt CT SPE柱(500 mg/6mL,武汉维泰克科技有限公司)。
多菌灵购于美国Sigma-Aldrich公司,噻菌灵购于上海农药研究所。标准溶液的配制:分别称取50 mg 多菌灵和噻菌灵于50 mL棕色容量瓶中,用甲醇定容,再取500 μL于50 mL棕色容量瓶中,用甲醇稀释到50 mL,浓度为10 μg/mL,于4 ℃避光保存,且每周重新配制。甲醇、Na2HPO4、NaH2PO4、氨水均为分析纯,购自国药集团化学试剂有限公司。pH=6.8的磷酸盐缓冲溶液(PBS):称取1.40 g Na2HPO4和1.41 g NaH2PO4溶于1 L水中。实验所用纯水由艾柯纯水仪(中国台湾)制备。
果汁样品购自某大型超市。
1.2 色谱条件
色谱柱:Weltech HiSep C18-T(250×4.6 mm,i.d.,5 μm);流动相:甲醇-PBS(25∶75,V/V);流速:1 mL/min;紫外检测波长:285 nm;柱温:40 ℃;进样量:20 μL。
1.3 样品处理
果汁(不含果粒):直接取10 mL作为上样液(pH=3.1);果汁(含果粒):取10 mL果汁离心,取上清液5 mL作为上样液;浓缩果汁:取5 mL浓缩果汁,加5 mL的0.1 mol/L HCl,混匀,作为上样液。
1.4 固相萃取步骤
HiCapCT SPE柱使用前用2 mL甲醇和2 mL水活化。将上样液加入萃取柱,保持整个过程流速2~3 mL/min。然后加入3 mL水和3 mL甲醇,最后用3 mL 5%氨水的甲醇溶液解吸。解吸液在50 ℃下氮气吹干,加入200 μL流动相溶解后待测。
2 结果与讨论
2.1 萃取条件的优化
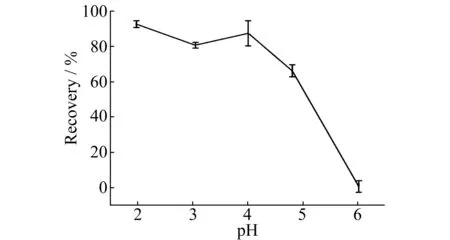
图2 上样液pH值对多菌灵回收率的影响Fig.2 Influence of pH on the recovery of carbendazim
2.1.1上样液的优化上样液的pH值会影响目标物的萃取效率。实验用0.1 mol/L HCl配制一系列pH值的多菌灵标准溶液考察pH值的影响,发现pH<4时,用5%氨水的甲醇溶液解吸,其回收率均大于80%(图2)。多菌灵在低pH值时带正电,与SPE柱填料间存在离子交换作用。但随着pH值增高,pH=5~6,多菌灵趋于中性分子状态,与SPE柱填料间的离子交换相互作用逐渐减弱甚至消失,因此多菌灵的回收率降低。分别考察了10 mL橙汁(pH=3.22), 10 mL橙汁+10 mL 0.1 mol/L HCl(pH=1.44),10 mL橙汁+20 mL 0.1 mol/L HCl(pH=1.25)混合溶液对萃取效率的影响,发现多菌灵的回收率均大于80%。为简化实验步骤,采用10 mL橙汁直接上样(浓缩果汁采用体积比为1∶1的橙汁和0.1 mol/L HCl混合上样)。
2.1.2清洗液的优化橙汁中含有大量的色素等物质,如果不清洗掉,会在解吸的时候被洗脱下来,对色谱柱造成污染,同时可能会影响目标物质的回收率。实验表明,经3 mL水和3 mL甲醇清洗,其回收率较高。
2.1.3解吸液的优化采用5%氨水的甲醇作为解吸液,考察了不同解吸液体积对回收率的影响。结果显示,增大解吸液体积,多菌灵回收率稍有提高,但是解吸液体积过大会增加吹干所需要的时间,实验选择3 mL 5%氨水的甲醇溶液作为解吸液。
2.2 标准曲线与检出限
将10 μg/mL多菌灵和噻菌灵储备液用流动相逐级稀释配制了0.05~5 μg/mL混合标准溶液。按照选定的色谱条件测定,以峰面积对质量浓度进行线性回归。由表1可见,多菌灵和噻菌灵具有良好的线性关系,其相关系数R2均为0.9999。以信噪比(S/N)=3和信噪比(S/N)=10分别计算橙汁中多菌灵、噻菌灵的检出限与定量限,分别为0.23 μg/L、0.22 μg/L和0.74 μg/L、0.70 μg/L。

表1 多菌灵与噻菌灵的线性方程、检出限和定量限Table 1 Linearities,limits of detection(LOD) and limits of quantification(LOQ) of the method
2.3 回收率和精密度
分别加入低、中、高3种质量浓度的多菌灵和噻菌灵混合标准溶液于橙汁(不含果粒)样品中,然后按照本实验方法进行测定,色谱图如图3所示。实验所得回收率为81.74%~87.45%和87.26%~94.22%,日内和日间相对标准偏差(RSD)分别小于7.5%和8.7%。
2.4 实际样品分析
按本方法测定不同厂家的果汁产品共5种(a~e),如图4所示。检测结果发现均含有多菌灵残留,其中果汁a含量0.56 μg/L;果汁b含量0.52 μg/L;果汁c含量3.08 μg/L;果汁d含量2.76 μg/L;果汁e含量3.34 μg/L。
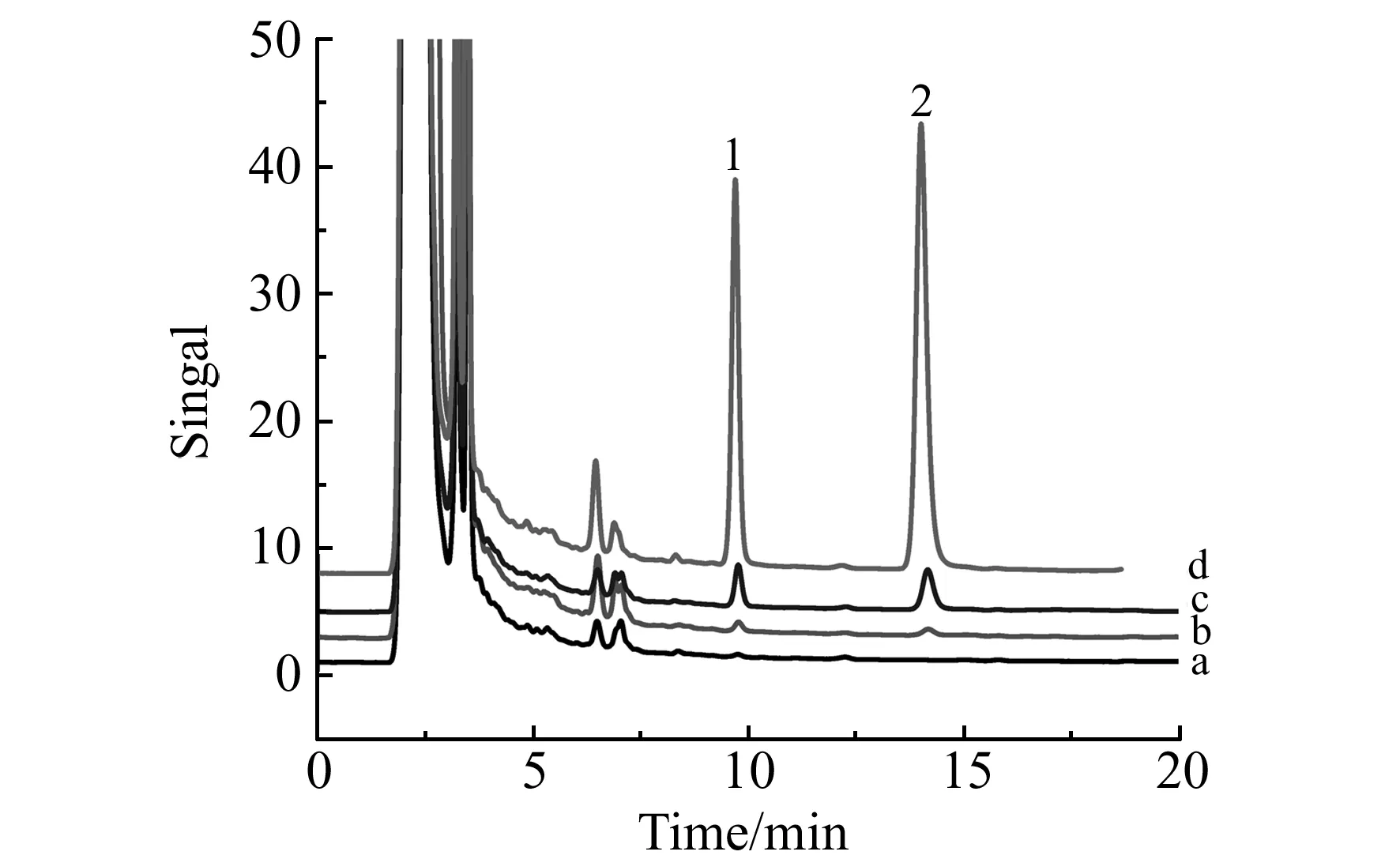
图3 果汁样品中添加多菌灵与噻菌灵经SPE富集后色谱图Fig.3 Chromatograms obtained by SPE from spiked orange juice samples 1.MBC;2.TBZ;a.blank orange juice sample;b.orange juice spiked at 1 μg/L;c.orange juice spiked at 10 μg/L;d.orange juice spiked at 100 μg/L.
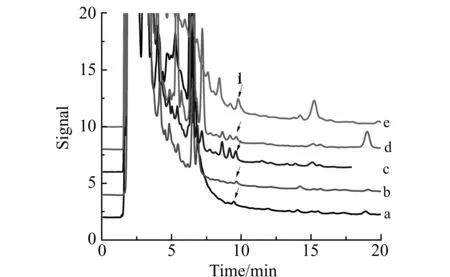
图4 5种果汁样品(a~e)经SPE富集后的色谱图Fig.4 Chromatograms obtained by SPE from five juice samples(a-e) 1.MBC.
3 结论
建立了固相萃取富集净化、高效液相色谱-紫外检测器测定果汁中的多菌灵和噻菌灵残留的分析方法。该方法可以有效除去果汁中的基质干扰,同时具备简单、快速、灵敏的优点,可用于果汁中多菌灵和噻菌灵的检测,对制定果汁中多菌灵和噻菌灵检测的国家标准有一定的参考价值。
