乙炔黑-离子液体复合膜修饰电极溶出伏安法测定水样中痕量Cd(Ⅱ)
2015-10-16谭红艳费俊杰
谭红艳, 郭 晶, 费俊杰
(湘潭大学化学学院,环境与友好化学教育部重点实验室,湖南湘潭 411105)
随着工业的发展,重金属离子对环境及人体的污染和毒害日益严重。其中毒性最大的重金属是铅、镉、汞。我国目前高发的糖尿病、高血压、骨质疏松、贫血、肿瘤等慢性病,一定程度上可能都与食物中镉超标有关[1]。目前检测重金属离子的技术主要有原子荧光光谱法、原子吸收光谱法、原子发射光谱法、高效液相色谱法、质谱法、生物传感器以及电化学方法等[2 - 5]。近几年,电化学方法由于其设备简单、选择性好、分析速度快、便于操作等特点在微量元素分析中愈加重要。
离子液体(ILs)[6,7]具有低毒、高电导率、高的化学和热稳定性、低蒸汽压、好的生物相容性及宽的电化学稳定窗口等特点,使其在电极修饰方面的应用日益广泛。Marken 等[8]首次报道了离子液体修饰电极的电化学行为与溶液中盐的种类有着密切的关系。Marcin等[9]综述了最近十年来离子液体修饰电极的种类及其应用。乙炔黑(AB)是一种由直径大约为2~3 nm的球状或链状粒子组成的纳米材料。乙炔黑具有质量轻、比重小、纯度高、比表面积大、强的吸水性和吸附性能、化学性质稳定、导电性高等特点。由于乙炔黑的优良特性,现已广泛应用于电化学分析领域[10 - 15]。本课题组[16]曾制备了乙炔黑-离子液体复合修饰电极用来检测氟乐灵。在本文中,我们制备了乙炔黑-离子液体复合膜修饰玻碳电极,并研究了用该修饰电极测定Cd(Ⅱ)的电化学方法。将该方法应用于实际水样中Cd(Ⅱ)的测定,结果比较理想。
1 实验部分
1.1 主要仪器和试剂
CHI 630电化学工作站(美国,CHI仪器公司),实验采用三电极系统:工作电极为裸玻碳电极(GCE)或乙炔黑-离子液体复合膜修饰破碳电极,参比电极为饱和甘汞电极,对电极为铂电极。pHS-25型酸度计(广州新英电器有限公司)。
Cd(Ⅱ)标准溶液(1.0×10-2mol·L-1):称取0.0771 g的Cd(NO3)2固体,用二次蒸馏水溶解并定容于25 mL容量瓶中,其它浓度的Cd(Ⅱ)标准溶液则用二次蒸馏水稀释得到。乙炔黑购买于Pakistan的Nazir & Sons International公司。离子液体(BMIMPF6,99%)购买于上海成捷化学有限公司,使用时没有进一步纯化。实验用水为二次蒸馏水。
1.2 修饰电极的制备
GCE在使用前分别用1.0、0.3、0.05 μm的抛光粉抛光,然后用二次蒸馏水将电极表面冲洗干净,再将电极依次放入HNO3(1+1)、丙酮水溶液和二次蒸馏水中各自超声15 min,最后在室温下自然晾干,备用。分别将6 mg的乙炔黑与20 μL离子液体混合放入研钵中,研磨使其形成黑色的胶状物。然后采取涂布的方法,将适量的黑色胶状物吸附在GCE表面,即制得乙炔黑-离子液体复合膜修饰电极(AB-ILs/GCE)。在对比实验中,采用上述同样的方法,用硅油(MO)代替离子液体,制备的电极为乙炔黑-硅油复合膜修饰电极(AB-MO/GCE)。
1.3 实验方法
测定前,将制备的AB-ILs/GCE在0.1 mol·L-1B-R缓冲溶液(pH=5.2)中用循环伏安法扫描(电位区间为-0.4~-1.1 V),直至伏安曲线稳定为止。在10 mL B-R缓冲溶液中加入一定体积的Cd(Ⅱ)标准溶液,在搅拌的情况下开路富集180 s,静止15 s,记录扫描区间内的线性扫描溶出伏安曲线。每次测定完毕后,将电极放入0.1 mol·L-1的NaOH溶液中,以100 mV/s扫描速度循环伏安法扫描20次,即可更新电极表面。该方法处理后的电极能连续使用20次。
2 结果与讨论
2.1 Cd(Ⅱ)的电化学行为研究
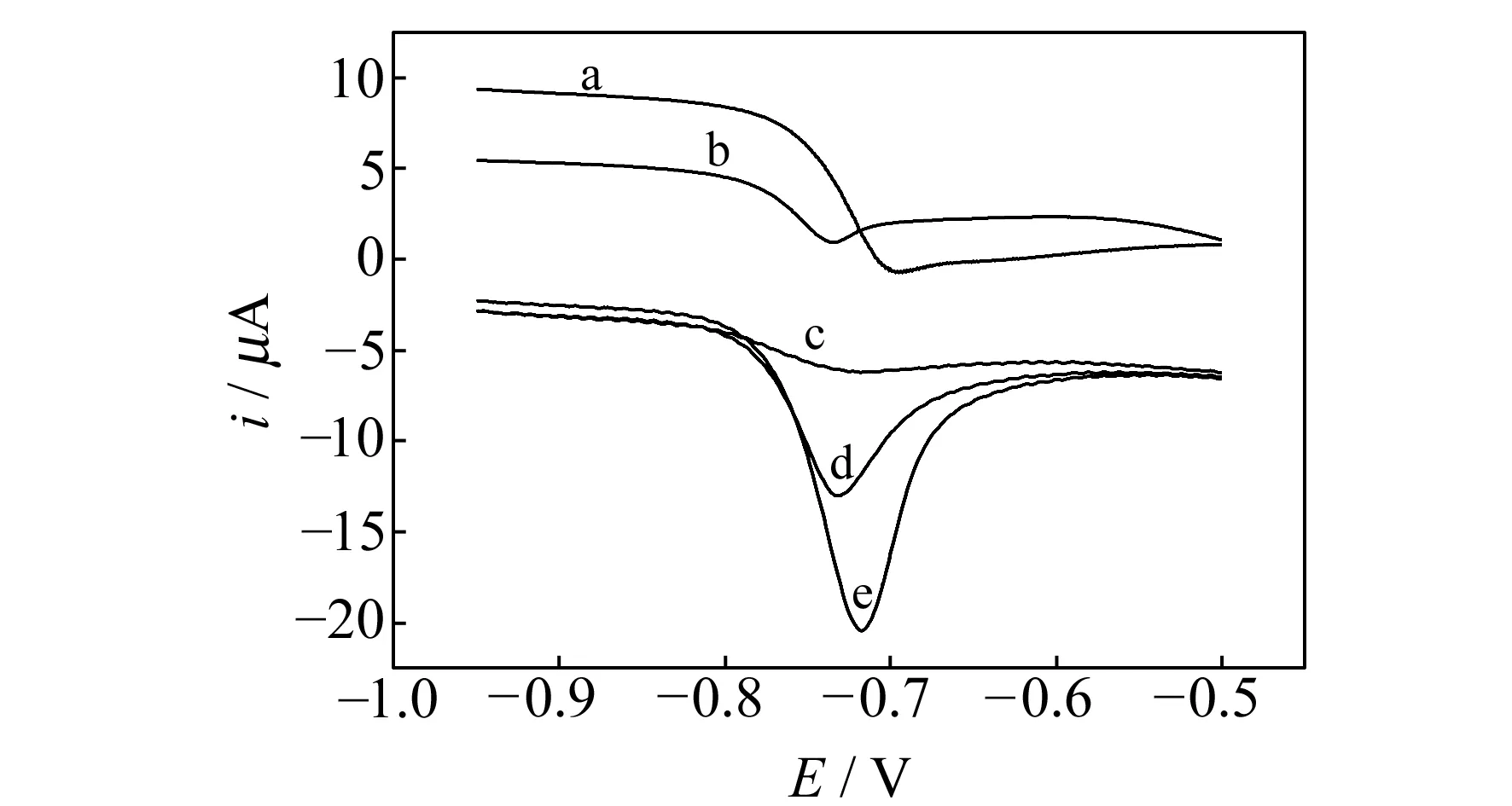
图1 不同浓度的Cd(Ⅱ)在0.1 mol·L-1 B-R缓冲溶液(pH=5.2)中的线性扫描溶出伏安曲线Fig.1 Linear sweep stripping voltammetry curves of Cd(Ⅱ) in 0.1 mol·L-1B-R buffer(pH=5.2) (a) 5.0×10-7 mol·L-1 Cd(Ⅱ) at a AB-MO/GCE;(b) 5.0×10-7 mol·L-1 Cd(Ⅱ) at a GCE;(c,d and e) 1.0×10-7 mol·L-1,3.0×10-7 mol·L-1and 5.0×10-7 mol·L-1 Cd(Ⅱ) at a AB-ILs/GCE.
为了探讨AB-ILs/GCE对Cd(Ⅱ)的电化学行为,在0.1 mol·L-1B-R缓冲溶液(pH=5.2)中,用线性扫描溶出伏安法研究了不同浓度的Cd(Ⅱ)在裸GCE、AB-MO/GCE和AB-ILs/GCE三种不同电极上的电化学行为,实验结果如图1所示。图中曲线b显示5.0×10-7mol·L-1Cd(Ⅱ)在裸GCE上没有明显的电化学响应,说明Cd(Ⅱ)在裸GCE上的电极反应极其缓慢。图中曲线a在-0.71 V左右出现了一个峰形不好的氧化峰,图中曲线e的氧化峰电流最大,峰电位为-0.71 V。这说明离子液体的存在能够有效地提高导电效率,加快电子转移速率,因此响应峰电流增大。当Cd(Ⅱ)浓度降低到3.0×10-7mol·L-1(图1曲线d)和1.0×10-7mol·L-1(图1曲线c)时阳极溶出峰电流也跟着下降。这表明不同浓度的Cd(Ⅱ) 对峰电流的影响是明显的,且浓度和峰电流之间呈一定的线性关系。通过对四条曲线的比较,发现Cd(Ⅱ)在AB-ILs/GCE上产生的电化学响应是最大的,乙炔黑与离子液体复合后提高了修饰电极的灵敏度和催化特性。
2.2 电极制备条件优化
分别以乙炔黑质量(1 mg)和离子液体体积(μL)为1∶0.2、1∶0.3、1∶0.4、1∶0.5的比例来确定最佳混合比。实验发现乙炔黑过量则混合物黏结不好,导致电极材料易脱落,而且峰电流也小;离子液体过量则混合物不易成型,不利于电极表面的电子传递。最终确定乙炔黑和离子液体最佳比例为1∶0.3(m/V)。
2.3 缓冲溶液的选择
用线性扫描溶出伏安法,分别以0.1 mol·L-1HCl、NaAc、HAc-NaAc溶液(pH=2.5~5.5)、B-R溶液(pH=4.0~5.5)、磷酸盐溶液(pH=5.0~6.5)等为底液,研究了底液对5.0×10-7mol·L-1Cd(Ⅱ)电化学行为的影响。结果表明,Cd(Ⅱ)在0.1 mol·L-1B-R溶液中具有良好的峰形和最大的峰电流,因此本实验选择0.1 mol·L-1B-R溶液作为测试底液。
缓冲溶液的pH值对Cd(Ⅱ)峰电流的影响也较大,实验考察了pH值范围为2.5~9.0的B-R缓冲溶液对5.0×10-7mol/L Cd(Ⅱ)峰电流的影响,见图2。由图2可见,pH值在2.5~5.2范围内,Cd(Ⅱ)的峰电流不断增加。pH值在5.2~6.5范围,峰电流基本保持不变。继续增大pH值,峰电流慢慢地减小。所以在以后的实验中,选择pH=5.2的0.1 mol/L B-R溶液作为测试底液。
2.4 富集电位和富集时间的影响
图3是富集电位对5.0×10-7mol·L-1Cd(Ⅱ)峰电流的影响。结果表明,负向改变富集电位,能促进Cd(Ⅱ)在修饰电极上的还原,增大峰电流。而在-1.10 V时,峰电流最大。故选择-1.10 V为富集电位。随着富集时间的不断增加,越来越多的Cd(Ⅱ)被吸附到AB-ILs/GCE表面上,所以峰电流不断地增大。富集3 min后峰电流的增加趋势很缓慢。为了缩短富集时间,在保证最大灵敏度的前提下,选择富集时间为3 min。
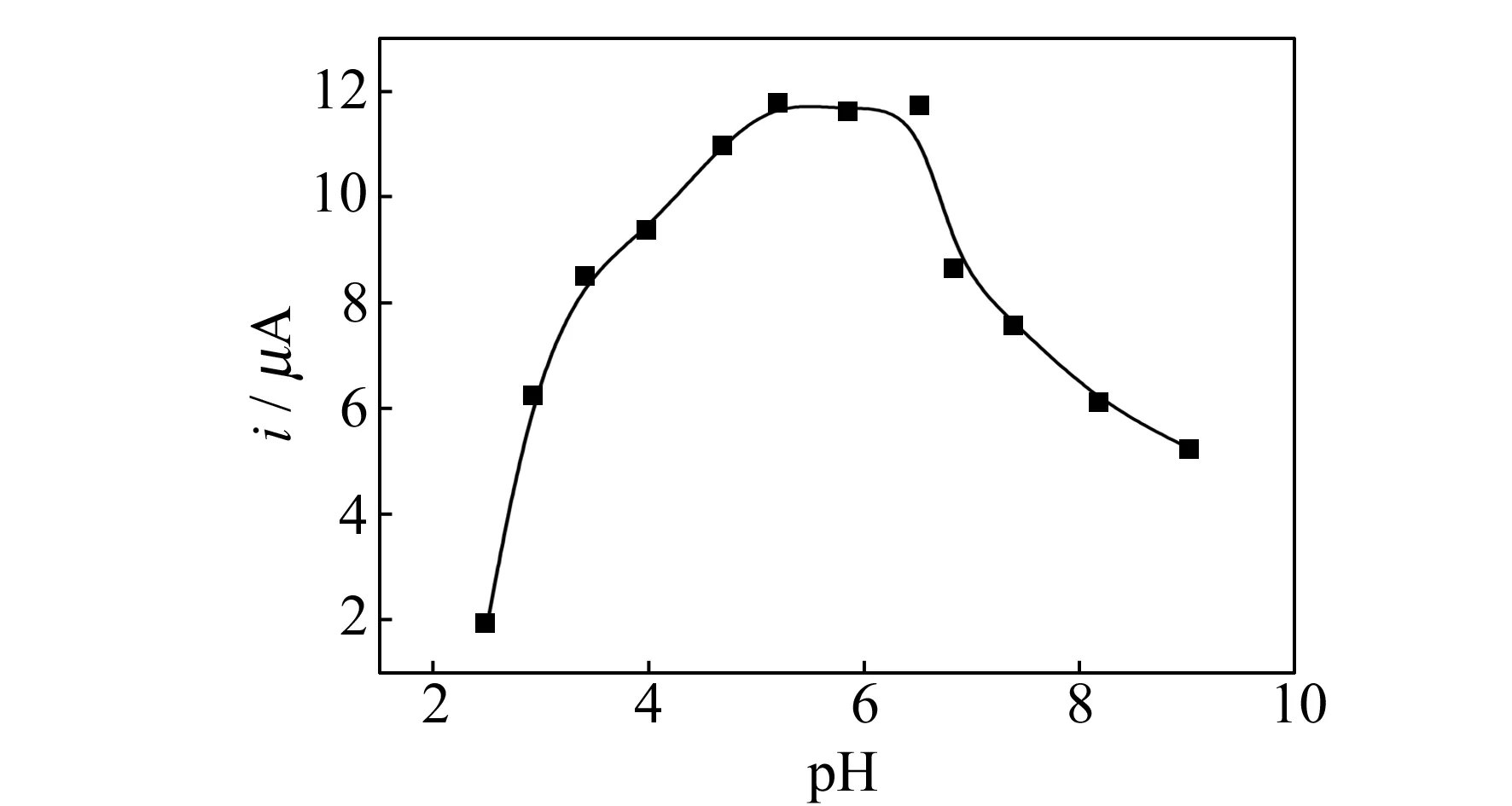
图2 pH值对5.0×10-7 mol·L-1 Cd(Ⅱ)峰电流的影响Fig.2 Effect of pH on peak current of 5.0 × 10-7 mol·L-1 Cd(Ⅱ)
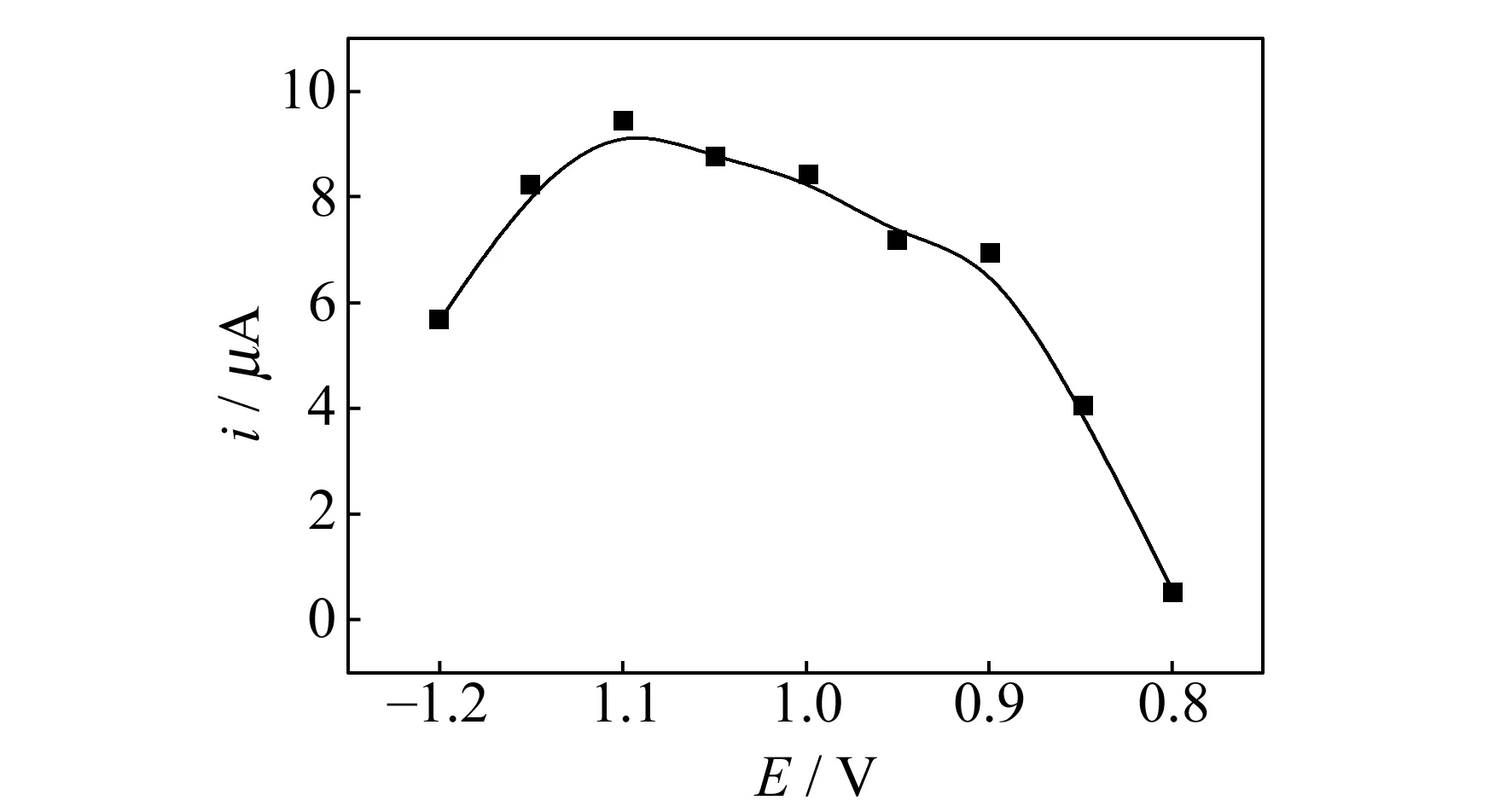
图3 富集电位对5.0×10-7 mol·L-1 Cd(Ⅱ)峰电流的影响Fig.3 Effect of accumulation potential on peak current of 5.0×10-7 mol·L-1 Cd(Ⅱ)
2.5 线性范围与检出限
在优化的实验条件下,采用线性扫描溶出伏安法探讨Cd(Ⅱ)浓度与其氧化峰电流之间的关系,结果表明Cd(Ⅱ)在1.5×10-8~7.7×10-5mol·L-1范围内,其峰电流与浓度呈良好的线性关系,相关系数R=0.9991。富集180 s后,检出限(S/N=3)为1.0×10-8mol·L-1。
用本文修饰方法分别制备了5支不同电极,在相同的优化条件下测定5.0×10-7mol·L-1Cd(Ⅱ)的峰电流,其相对标准偏差为4.10%。用同一支修饰电极对5.0×10-7mol·L-1Cd(Ⅱ)平行测定10次的相对标准偏差为4.7%,说明AB-ILs/GCE具有很好的重现性和重复性。
2.6 共存离子的影响
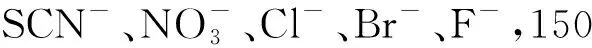
2.7 水样中Cd(Ⅱ)的测定
为了考察所制备的AB-ILs/GCE的实际分析应用,采用标准加入法,用制备的AB-ILs/GCE对三种水样中Cd(Ⅱ)的含量进行了分析,回收率范围为97.0%~105.0%。与原子吸收法(AAS)比较,结果吻合较好,见表1。

表1 水样中Cd(Ⅱ)含量的测定Table 1 The determination of Cd(Ⅱ) content in water samples
3 结论
本文基于乙炔黑和离子液体独特的电化学性质,结合两类物质各自的优势,研究乙炔黑-离子液体复合膜修饰电极对Cd(Ⅱ)的电化学响应。该修饰电极与其它电极比较,具有线性范围较宽和检测限低的优点,适用于检测环境水样中的重金属离子。
