捕捉剂对电化学氧化体系中羟基自由基检测的影响特性
2015-10-16薛娟琴于丽花唐长斌
薛娟琴*, 蒋 朦, 于丽花,罗 瑶, 唐长斌
(西安建筑科技大学冶金工程学院化学系,陕西西安 710055)
随着现代工业的迅速发展,环境污染特别是水污染问题越来越严重。目前,工业废水是水污染的主要来源,而废水的综合治理问题,尤其是对难生物降解有机物的处理,已成为国内外环境领域亟待解决的一大难题[1]。近年来,电化学氧化方法作为一种环境友好技术,具有环境兼容性好,不易产生二次污染,处理效率高,操作简便,易于实现自动化等特点[2 - 4],在治理环境污染方面已普遍受到人们的重视。该技术应用中所形成的·OH选择性低、氧化性强,能够将生物难降解有机物矿化为CO2、H2O和无机离子,不易产生有毒中间体且无需后续处理[5],所以·OH浓度的检测在电化学氧化体系中有很大的发展空间,开发出适合于电化学氧化体系中·OH的捕捉剂是十分必要的。·OH具有非常高的反应速率常数和负电荷亲电性,氧化电位高、存活寿命短[6]。由于·OH的半衰期仅为1.0×10-10s左右[7,8],使得其直接测量变得非常困难,一般使用间接测量法,即捕捉剂与·OH反应,其羟基化产物的量即为·OH的捕捉量[9]。目前,最常用的分离分析技术有高效液相色谱法(HPLC)[10]、液相色谱-质谱法[11]、电子自旋共振法(ESR)[12]及荧光光度法[13]。其中,HPLC法因具有快速、灵敏、制样量小等特点而应用最为广泛。其所用检测器常采用紫外(UV)检测器,该检测器具有简单、灵敏、经济等特点。水杨酸(SA)[14]、5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)[15]、苯甲酸[16]等捕捉剂已应用于生物领域中·OH的检测,由于SA的羟基化产物稳定,反应灵敏而被广泛采用,但也有研究者认为SA的羟基化产物较多,会降低响应信号的灵敏度,而4-HBA的羟基化产物只有一种,即3,4-二羟基苯甲酸(3,4-DHBA),更适合做·OH的捕捉剂[17]。
目前电化学氧化体系中产生·OH的检测技术尚未成熟,无法使体系中产生的·OH浓度、浓度的相对增减以及电解副产物的跟踪得到直接表征,导致电化学氧化机理仍停留在设想推测阶段,缺乏有效的实验数据。本研究采用HPLC-UV检测技术,通过对比考察SA和4-HBA在电化学氧化中反应速率、捕捉时间、初始用量及pH值等方面的特性,以寻求更适合电化学氧化体系的捕捉剂,为建立稳定可靠的·OH检测方法,使不同条件下电化学氧化体系中·OH的瞬时浓度,以及浓度的相对变化得到直接表征,从而为判断·OH的来源和推断·OH的反应机理,及深入研究有机物的电化学氧化提供依据。
1 实验部分
1.1 仪器与试剂
Ultimate 3000 DGLC 高效液相色谱仪(美国,戴安公司),附Ultimate 3000 Variable Wavelength Detector 检测器,AcclaimR120 C18柱(250×4.6 mm i.d.,5 μm)。TU-1901双光束紫外分光光度计(北京普析通用仪器有限责任公司)。CJJ78-1磁力加热搅拌器(上海君竺仪器制造有限公司)。LPS3010直流稳压电源(广州东莞龙威电子科技有限公司)。BS 224S电子分析天平(北京赛多利斯仪器系统有限公司)。
2,5-二羟基苯甲酸(2,5-DHBA)、2,3-二羟基苯甲酸(2,3-DHBA)、3,4-DHBA、SA及4-HBA均为分析纯(日本,东京化成工业株式会社);甲醇为色谱纯(天津科密欧化学试剂有限公司);其他试剂均为分析纯。所有试剂均即配即用。实验用水为超纯水(18.2 MΩ·cm)。
1.2 实验方法
1.2.1·OH的产生在电解反应器中加入捕捉剂和0.03 mol·L-1无水Na2SO4混合溶液共150 mL,使用50×30×2 mm的自制Ti/PbO2阳极和不锈钢阴极,在室温下接通直流电源,于磁力搅拌下进行反应。
1.2.2·OH的检测采用捕捉剂的羟基化产物浓度对·OH浓度进行间接定量。使用紫外分光光度计分别测定SA、4-HBA、2,5-DHBA和3,4-DHBA的紫外吸收光谱,可得其对应的最大吸收波长,分别为296 nm、249 nm、320 nm、253 nm,为确保检测到的羟基化产物浓度最大,以SA为捕捉剂时将检测波长设为320 nm,以4-HBA为捕捉剂时将检测波长设为253 nm。实验中每次取样2 mL,加水稀释至10 mL,将试样溶液过滤后注入HPLC分离,使用UV检测器,调节柱温为30 ℃,流速为1 mL·min-1,用85%H3PO4调节水相pH为3.5,流动相为甲醇∶水=40∶60(V/V),每次进样20 μL。
1.2.3捕捉剂和羟基化产物的定量以标准物质的色谱峰面积对其组分浓度进行线性回归,可得SA、4-HBA、2,5-DHBA和3,4-DHBA的回归方程分别为:YSA=0.1651X-0.0601,相关系数(R2)为0.9994;Y4-HBA=1.6652X+0.0206,R2=0.9996;Y2,5-DHBA=0.2898X-0.0021,R2=0.9994;Y3,4-DHBA=1.3099X-0.0606,R2=0.9994。
2 结果与讨论
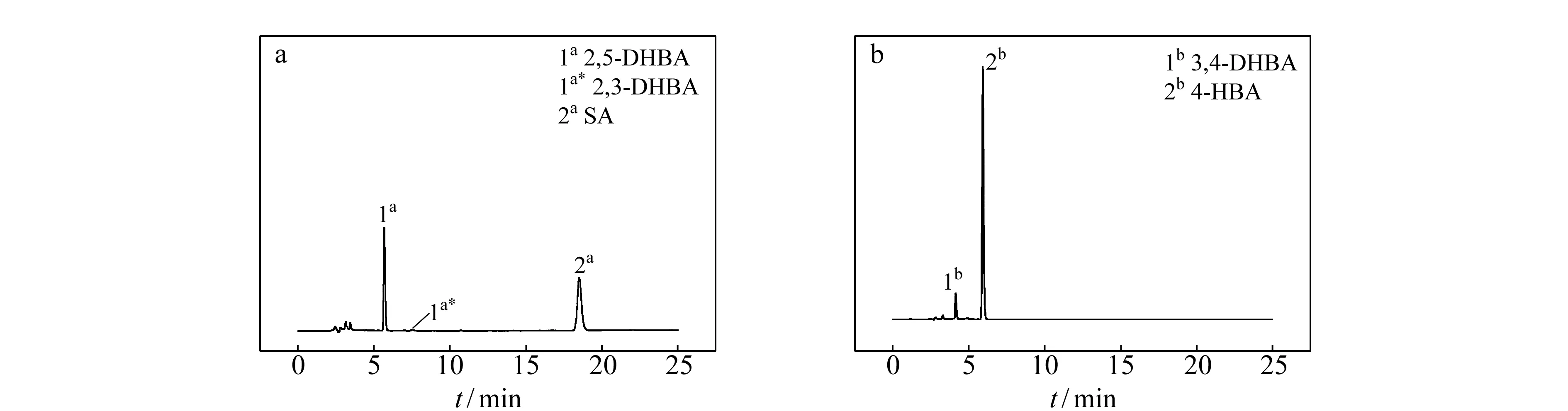
图1 SA、4-HBA及羟基化产物的色谱图 Fig.1 Chromatograms of SA,4-HBA and the hydroxylation derivativess a.Trapping by SA;b.Trapping by 4-HBA.
2.1 捕捉剂及羟基化产物的分离
研究体系中平均色谱峰面积比2,5-DHBA/2,3-DHBA为40.10,且2,3-DHBA的信噪比总小于3,可认为2,3-DHBA的含量可忽略不计,SA捕捉·OH的主要产物为2,5-DHBA,结果如图1a。研究表明电化学氧化体系中羟基化反应更易发生在对位,形成大量2,5-DHBA,这主要是由Ti/PbO2阳极的特性和SA的位阻效应共同决定的,与文献报道[18]相一致。2,5-DHBA和SA的保留时间分别为5.8 min和18.9 min,分离度RS为9.40。以4-HBA为捕捉剂能成功检测到一种羟基化产物3,4-DHBA,如图1b。3,4-DHBA和4-HBA的保留时间分别为4.1 min和5.9 min,分离度RS为2.78。分别使用50 mg/L的两种捕捉剂发生相同时间的捕捉反应,·OH的捕捉量均较低,分别是c2,5-DHBA为65.6761 μmol·L-1,c3,4-DHBA为20.7820 μmol·L-1。无论是SA还是4-HBA捕捉·OH ,应用UV检测器均能有效地将捕捉剂与羟基化产物分离,并在羟基化产物浓度较低时进行准确测量。
2.2 捕捉剂及羟基化产物的动力学研究
通过跟踪检测及数据分析可知,SA和4-HBA分别与·OH在本研究体系中的电化学氧化反应均符合一级反应动力学(-lnc/c0-t),其动力学参数如表1所示。SA和4-HBA的反应速率常数k分别为2.1833×10-4s-1和1.3500×10-4s-1。由此表明,研究体系中SA在UV检测条件下具有更高的灵敏度。为了考察羟基化产物的稳定性,对其在本电化学氧化体系中的降解情况进行了跟踪研究,图2(a、b)为不同电解时刻2,5-DHBA和3,4-DHBA的色谱图。2,5-DHBA和3,4-DHBA在·OH的直接进攻下,均只有含量的减少,并无其他反应中间体的产生。经分析可知2,5-DHBA和3,4-DHBA分别与·OH在本研究体系中的电化学氧化反应均符合零级反应动力学(-(c-c0)-t),其动力学参数见表1。两种羟基化产物与·OH的反应速率都非常低,约是相对应捕捉剂的1/1 000,进一步说明了SA和4-HBA均符合作为电化学氧化体系中·OH捕捉剂的条件,即捕捉剂的羟基化产物稳定[19]。
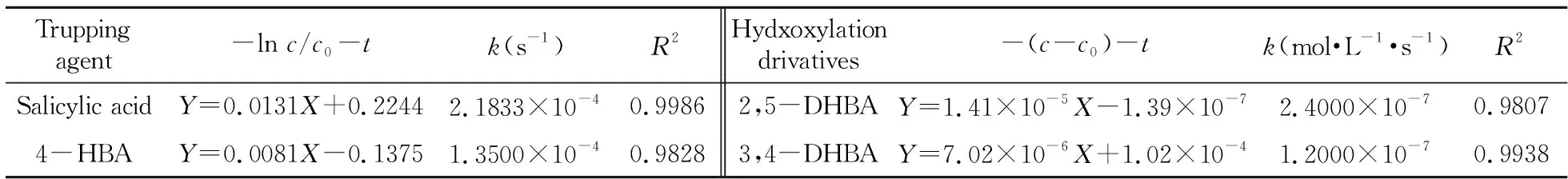
表1 不同捕捉剂和羟基化产物电化学氧化过程动力学参数Table 1 Rate constants for the different trapping agents and hydxoxylation derivatives during the processes of electrochemical oxidation(i=10 mA/cm2,ttrapping=180 min)
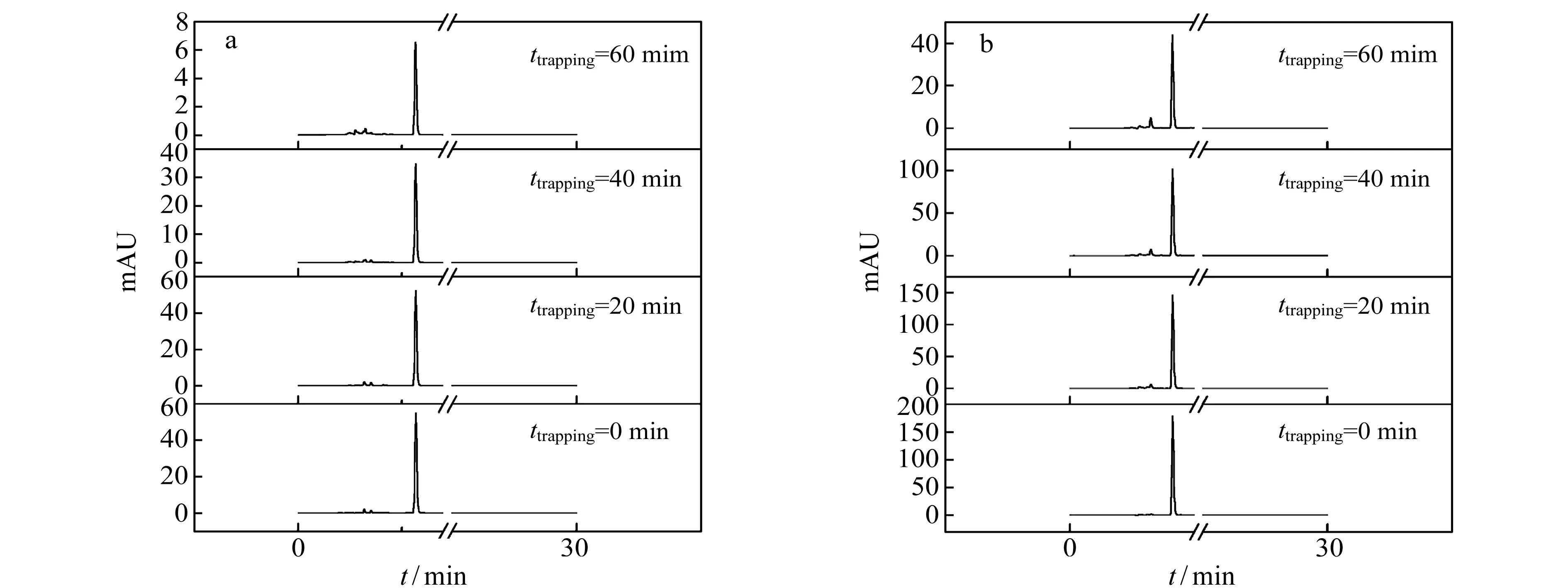
图2 不同电解时间羟基化产物色的谱图 Fig.2 Chromatograms of the hydroxylation derivatives at various reaction time a.2,5-DHBA;b.3,4-DHBA
2.3 不同捕捉剂捕捉能力的研究
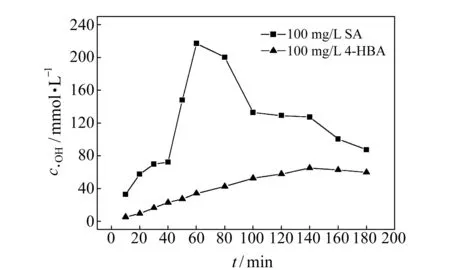
图3 不同电解时间下·OH捕捉量的变化规律Fig.3 The concentration of hydroxyl radicals at various reaction time
图3为UV检测条件下·OH捕捉量随捕捉时间的变化规律。随着捕捉时间的累积,·OH捕捉量总体呈现先增加后减少的趋势,这是因为在同一电化学氧化体系中,尽管捕捉剂的电化学氧化反应速率远远大于羟基化产物,但二者之间仍存在竞争关系。反应初期·OH优先攻击捕捉剂,产生大量的2,5-DHBA和3,4-DHBA,随着捕捉反应的持续进行,捕捉剂不断消耗,无法保持浓度优势,根据·OH 是非选择性强氧化剂这一特性,羟基化产物也被进一步矿化,该捕捉时刻的检测浓度已不能真实反映电化学氧化体系中产生的·OH。因此,当100 mg·L-1SA发生捕捉反应60 min可达到·OH捕捉量峰值,为217.2 μmol·L-1;100 mg·L-14-HBA发生捕捉反应140 min可达到·OH捕捉量峰值,为65.3 μmol·L-1。使用等浓度的捕捉剂,4-HBA的·OH捕获量峰值约为SA的30.06%。
综上所述,达到·OH捕捉量峰值,4-HBA所需的捕捉时间约为SA的2.3倍,且等浓度条件下任一捕捉时刻,SA捕捉到的·OH显著多于4-HBA,因而研究体系中SA的捕捉能力更强。研究中为确保·OH捕捉量最大,同时羟基化产物稳定存在,SA参与捕捉反应的适宜时间为60 min,4-HBA为140 min。
2.4 不同捕捉剂初始用量的确定
图4为不同浓度梯度的SA和4-HBA捕捉电化学氧化体系中的·OH。发生捕捉反应1~10 min,每隔1 min取样,SA发生捕捉反应2 min,4-HBA发生捕捉反应6 min时才可分别检测到·OH。以SA和4-HBA为捕捉剂,经过重复实验可检测到的平均最小捕捉量分别为2.0 μmol·L-1和2.3 μmol·L-1,平均最大捕捉量分别为217.2 μmol·L-1和204.9 μmol·L-1,且任一捕捉剂初始用量下,SA的·OH捕捉量始终大于4-HBA。
综上所述,两种捕捉剂的·OH最小捕捉量和最大捕捉量近似相等,且达到相同捕捉量时,SA的初始用量仅为4-HBA的1/3,捕捉时间约为4-HBA的3/7,进一步佐证了UV检测条件下SA的捕捉能力更强,灵敏度更高。实际应用中针对不同捕捉剂,应结合UV检测的特性及色谱柱的分离能力,选取适宜的捕捉剂初始用量。
2.5 pH值对·OH浓度的影响
以SA为捕捉剂对不同pH值下电化学氧化体系产生·OH浓度进行了考察。采用10%H2SO4和10%NaOH溶液调节电解液的pH值分别为3、6、7、8、11。为保证SA充分过量,选取其初始用量为500 mg·L-1。图5为不同pH值下·OH捕捉量的变化规律。随着pH值的增加,·OH捕捉量也逐步增加,这是因为直流电源条件下的Ti/PbO2阳极具有强烈的亲水性,发生电解反应时电解液中的OH-被电极活性层中的活性氧氧化,发生电子转移,产生大量的·OH,这与电化学体系中最佳电解条件下·OH变化规律相一致[24],同时验证了本研究体系检测方法的可靠性。
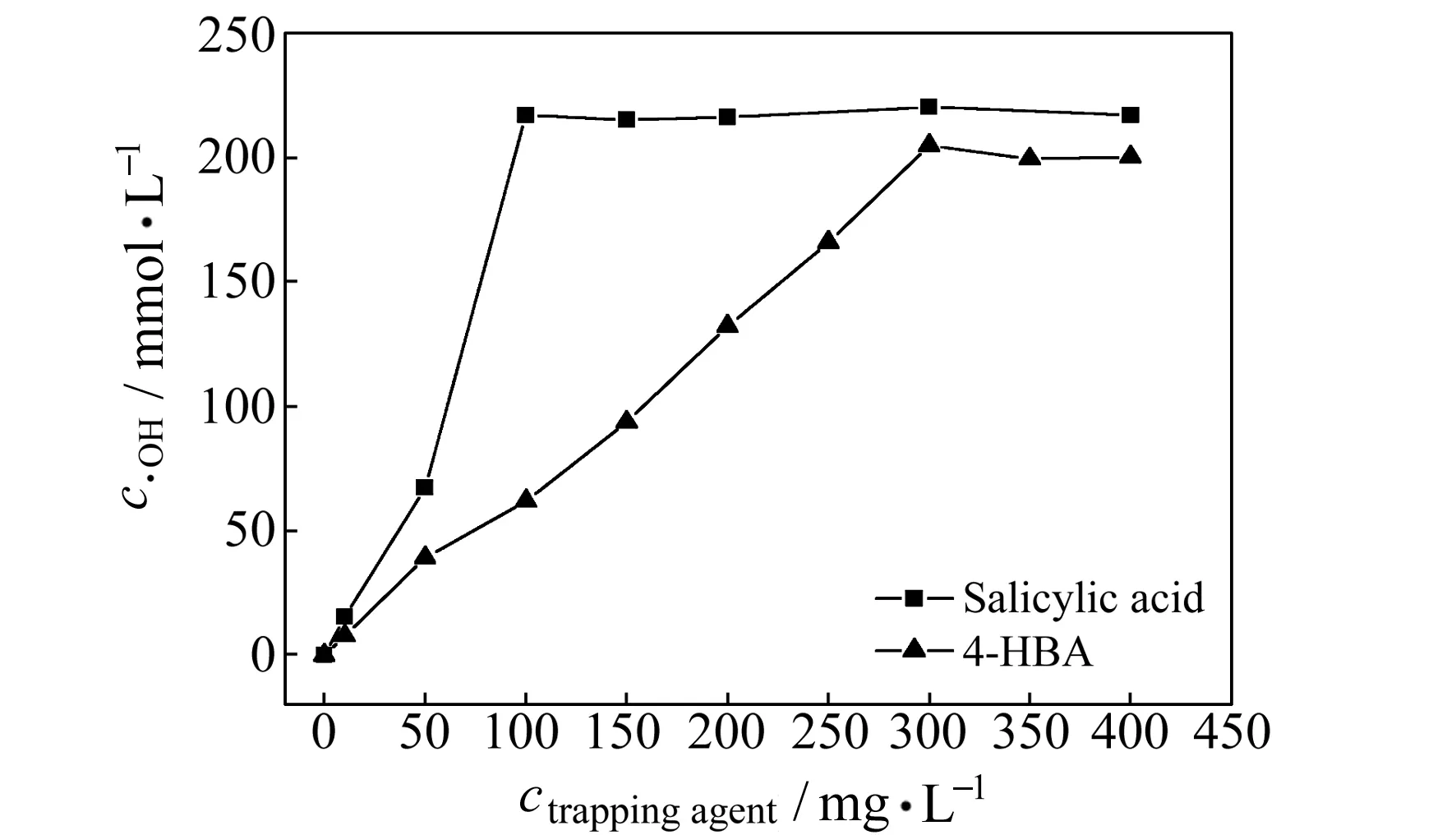
图4 不同捕捉剂初始用量的确定Fig.4 The eefficiency of trapping for various concentrations of different trapping agents
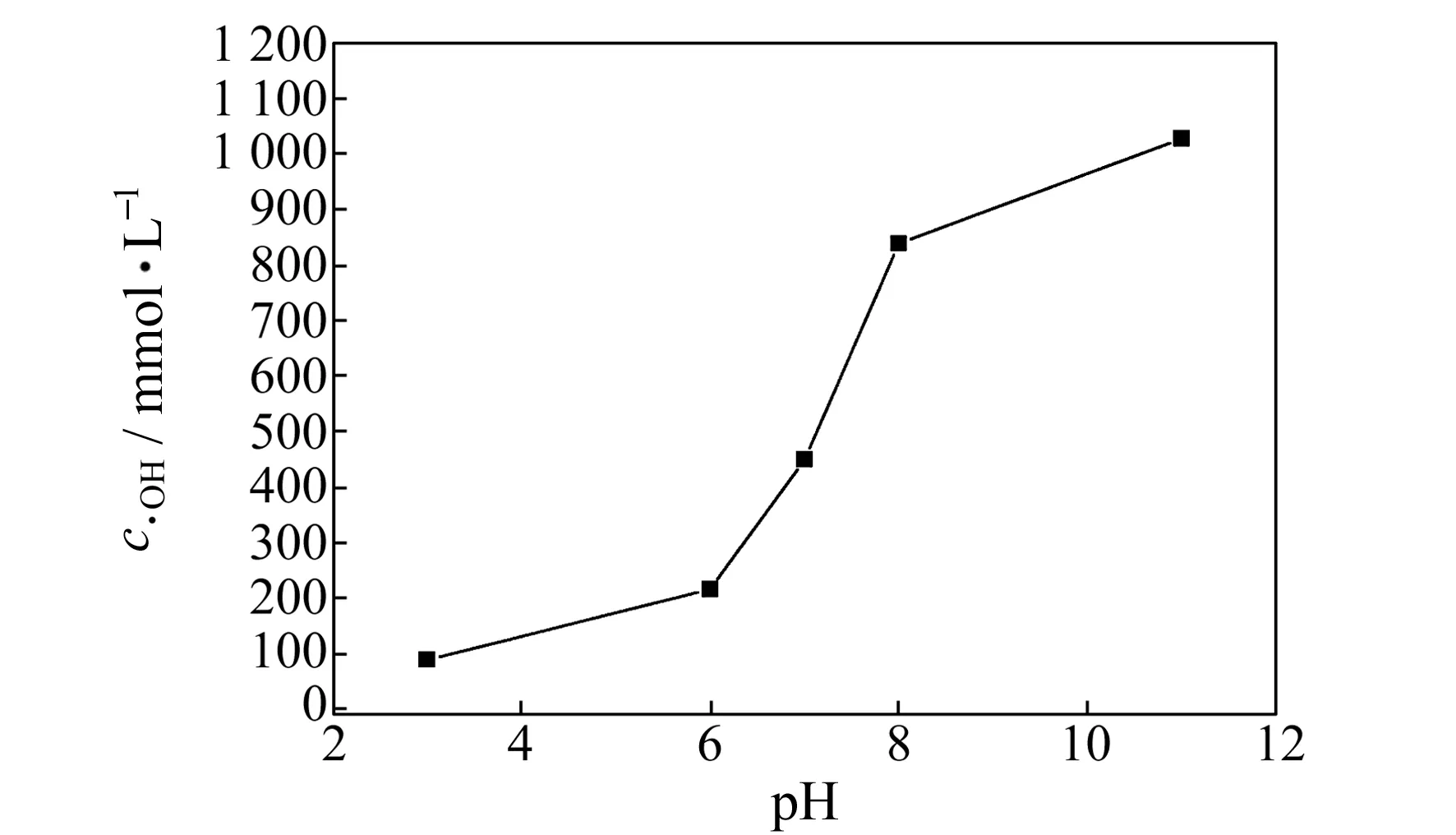
图5 pH值对·OH浓度的影响Fig.5 Yields of hydroxyl radicals generated at various pH values
3 结论
本研究选取了常见的两种·OH捕捉剂,利用HPLC-UV检测法建立了电化学氧化体系中·OH浓度的检测方法。通过对比实验发现,SA的反应速率常数远大于4-HBA,具有更强的捕捉能力和更高的灵敏度。因此,SA更适合做电化学氧化体系的·OH捕捉剂。本研究为建立电化学氧化体系中·OH的检测方法,以及不同电化学氧化条件对·OH浓度的影响提供了可靠的实验依据。
