胃泌素释放肽前体双抗体夹心酶联免疫吸附法的建立及其应用
2015-09-28楚振宇周小林薛振伟崔梅萍蔺苏琴李瑞华
楚振宇,周小林,薛振伟,崔梅萍,蔺苏琴,李瑞华
0 引 言
小细胞肺癌(small cell lung cancer,SCLC)恶性程度在所有肺癌类型中最高[1],然而其对放化疗敏感,如早期发现,采用综合治疗后5年生存率可达30%以上,因此SCLC的早期诊断和治疗尤为重要。胃泌素释放肽前体(pro-gastrin releasing peptide,PGRP)作为神经内分泌性细胞来源的肿瘤如小细胞肺癌肿瘤标志物已得到广泛认可[2-4],其敏感性和特异性均高于血清神经元特异烯醇化酶(neuron specific enolase,NSE)[5],特别是对于局限期 SCLC的诊断具明显优势[6-7]。在病情监测、疗效评估、预后等方面亦有较高准确性[8-9],在临床上有广泛的应用前景[10-11]。本研究通过人工合成 PGRP抗原决定簇对本实验室自行研制的单克隆抗体进行筛选;采用改良过碘酸钠法对抗体进行辣根过氧化物酶(horseradish peroxidase,HRP)标记,从而建立双抗体夹心酶联免疫吸附法(enzyme-linked immune sorbent assay,ELISA),并将此方法应用于癌症患者PGRP浓度的检测,现报道如下。
1 材料与方法
1.1 实验材料 PGRP抗原(本实验室自行研制);抗原决定簇PGRP(31-98)序列中N端到C端的3个抗原肽段—GSLKQQLREYIR(肽段1)、NLLGLIEAK(肽段2)和KENRNHQPPQ PKALG(肽段3),委托赛百盛公司合成;单克隆抗体19株(本实验室采用杂交瘤技术自行研制的鼠单克隆抗体);多克隆抗体(本实验室自行研制的兔多克隆抗体);辣根酶标记羊抗小鼠IgG(H+L)与辣根酶标记山羊抗兔IgG(H+L)(ZSGB-BIO公司生产);HRP为AMRESCO公司生产;癌症患者血样共67份(由太原肿瘤医院提供),血样以离心半径6 cm、3000r/min离心15min后收集上层血清;BioTek酶标仪(型号ELx800);Thermo Scientific微量分光光度计(型号NANODROP 2000);ELISA试剂盒(PGRP检测试剂盒为IBL公司生产);本实验所选用化学试剂规格皆为分析纯。
1.2 方法
1.2.1 间接ELISA法筛选单克隆抗体 以3条肽段与全肽段PGRP(31-98)作为抗原,分别溶于0.05 mol/L pH 9.6碳酸盐包被液中,包被聚苯乙烯板孔,包被浓度为 150 ng/100 μL,每孔包被 100 μL,4 ℃冰箱培育24 h;用含有0.05%吐温-20的等渗盐水的洗液洗板4次后对包被后的板条进行封闭,封闭液使用含有1%BSA的PBS溶液(0.01 mol/L pH7.4)150 μL,4℃冰箱培育24 h;移除封闭液后自然晾干板条;在封闭后的板孔中分别加19种不同细胞株的单克隆抗体,2 孔/株,50 μL/孔,37 ℃恒温箱培育 45 min;移除单克隆抗体,洗液洗板4次后,加HRP标记羊抗鼠抗体50μL/孔,37℃恒温箱培育30min;移除二抗并重复洗板4次,每孔各添加底物A、B液50 μL,37℃恒温箱培育15 min;4 mol/L浓硫酸终止反应后显色,酶标仪读取450 nm波长处吸光度值(A值),记录读数;重复4次,计算算术平均值。
1.2.2 单克隆抗体HRP标记 采用改良过碘酸钠法标记HRP(1mg)至所需单克隆抗体(2mg),低pH条件下NaIO4氧化HRP表面糖分子成醛基,与Ig的氨基相结合形成斯夫氏碱,后利用NaBH4还原结合物形成稳定的酶标抗体。使用微量分光光度计分别检测标记后单克隆抗体A403、A280,重复检测3次,记录结果并计算标记后HRP量、IgG量及标记率,单位为mg/mL。公式如下:
HRP 酶量 =A403×0.4
IgG 量 =(A280-A403×0.3)×0.62
1.2.3 双抗体夹心ELISA检测PGRP 包被抗体:选用E12株单克隆抗体包被聚苯乙烯板条,包被及封闭条件同ELISA筛选单克隆抗体实验;抗原:选用本实验室自行研制PGRP抗原,配制成不同梯度浓度,抗原稀释液使用 0.01 mol/L pH 7.4 PBS溶液。酶标抗体选用兔抗鼠多克隆抗体作为一抗,HRP酶标记的羊抗兔多克隆抗体作为二抗,HRP标记DD2、ED1鼠源单克隆抗体。利用方阵滴定法得到包被抗体与标记抗体的配比浓度A值,绘制工作浓度曲线,取斜率最大并且读数接近1.0处的抗体浓度作为各株抗体最适工作浓度。实验步骤:首先在包被E12株单克隆抗体的板条中加不同浓度的PGRP抗原,使得每列板孔中抗原浓度相同并呈梯度降低,抗原抗体稳定结合后使用酶标记抗体检测并显色、记录读数,具体实验条件控制同间接法筛选单克隆抗体实验。实验重复4次,计算算术平均值。
1.2.4 血清检测 以E12为包被单克隆抗体、ED1作为标记抗体,以本实验室自制抗原作为标准抗原,同时对67份癌症患者血清进行检测。
2 结 果
2.1 单克隆抗体筛选结果 E12单克隆抗体只与肽段3结合,明显高于全序列肽段;FB4单克隆抗体与3条肽段都可以结合,但与肽段2的结合力高于其他肽段;ED1单克隆抗体只与肽段2结合,但结合力明显低于全序列肽段。
2*B3、ED2、EC6 3株单克隆抗体分别与3条肽段均可结合,结合力相近;DD2及其他12株单克隆抗体仅与全肽段结合,而不与所选的3条肽段结合。见表1。
2.2 夹心ELISA检测结果 E12单克隆抗体包被与3种不同酶标抗体检测PGRP抗原浓度曲线中ED1斜率最高,结合效果最好,兔多克隆抗体斜率最低。见表2,图1。
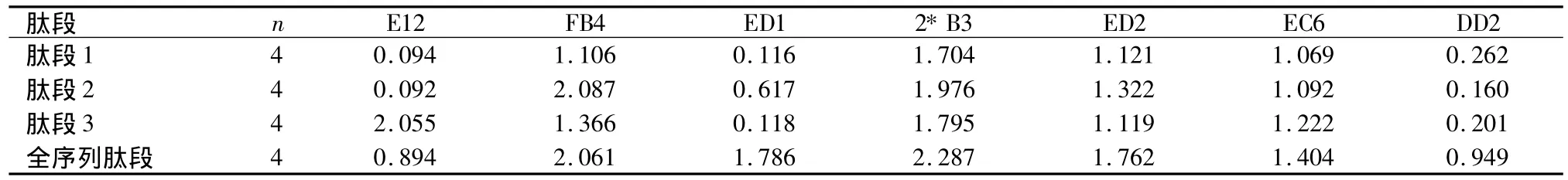
表1 人工合成3条肽段与全序列肽段筛选单克隆抗体ELISA实验结果Table 1 ELISA experiment results of screening monoclonal antibodies with three peptides and complete sequence peptide
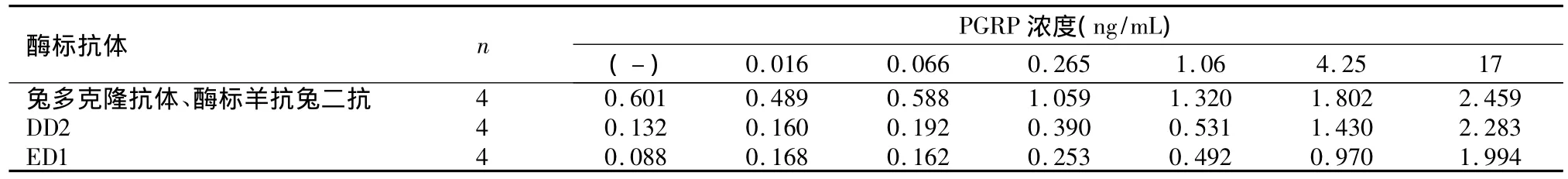
表2 E12单克隆抗体与不同酶标抗体夹心检测PGRP抗原浓度结果Table 2 Results of PGRP antibody density by sandwich detection of E12 mAb and different enzyme-labeled antibodies
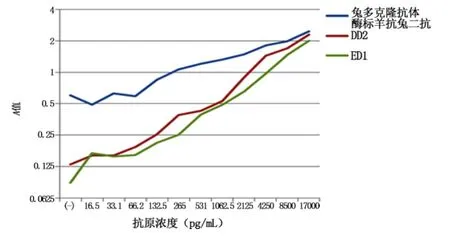
图1 E12单克隆抗体包被与不同酶标抗体夹心检测抗原浓度曲线图Figure 1 Curve chart of PGRP antibody density by sandwich detection of d E12 mAb coating and different enzyme-labeled antibodies
2.3 癌症患者血清检测结果 本方法的检测范围为33~1.7×104pg/mL;IBL公司试剂盒检测检测范围为16~800 pg/mL。在灵敏度方面,抗原浓度在33~200 pg/mL范围内时,IBL试剂盒检测标准曲线斜率最高,而本方法的检测标准曲线趋于平滑,曲线斜率近似一致,并未明显增高或降低。抗原浓度在50~800 pg/mL范围内时,IBL试剂盒检测A值均高于本方法,此范围内标准曲线斜率高于本方法。见图2。利用E12单克隆抗体包被,酶标ED1单克隆抗体建立的双单克隆抗体夹心ELISA检测癌症患者血清PGRP浓度,界定浓度值设为46pg/mL,阳性有4例,阴性值63例;使用市售PGRP试剂盒对同一批次癌症患者血清检测,其中阳性8例,阴性59例。本方法和IBL试剂盒检测灵敏度均为100%,特异度分别为98.4%和92.2%。
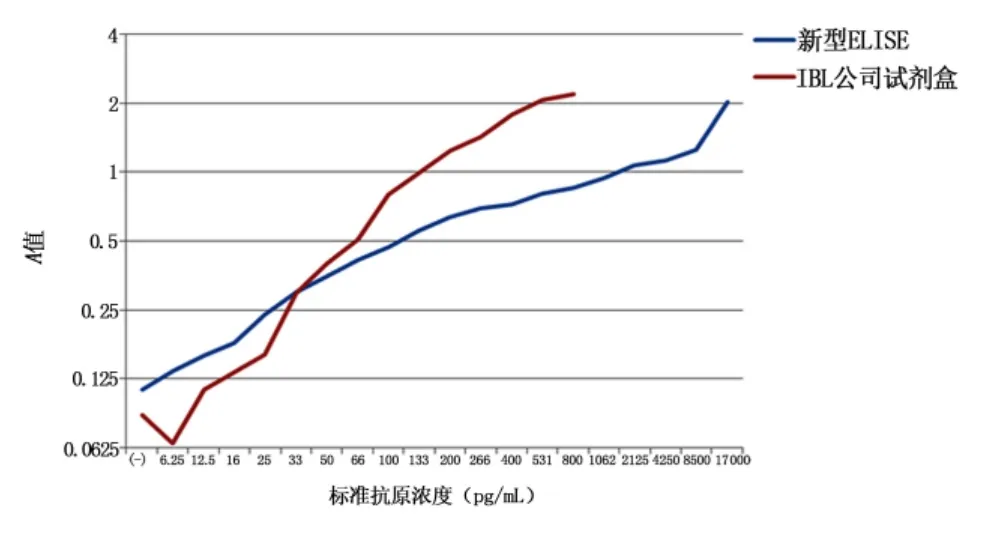
图2 不同方法检测癌症患者血清标准抗原浓度曲线Figure 2 Curve chart of standard antibody density in patients'serum by different detection methods
3 讨 论
PGRP抗原在人体内有3种同型异构体,其抗原表面有多个抗原决定簇,每个抗原决定簇由几个到十几个氨基酸或碳水基团组成,每一株单克隆抗体仅结合其中一个抗原决定簇。由于抗原决定簇的性质大部分由蛋白质一级结构决定,因此人工合成抗原共有序列肽段的部分氨基酸序列可得到PGRP抗原决定簇,借此筛选出结合不同位点的单克隆抗体,应用此方法建立单克隆抗体夹心ELISA实验。
我们实验结果表明FB4株单克隆抗体与肽段1和肽段3均可以结合,说明其不是真正意义的单克隆抗体,考虑下一步工作复苏细胞进行克隆化处理;E12株单克隆抗体仅与肽段3结合,ED1株单克隆抗体仅与肽段2结合,确立这2株单克隆抗体作为一组体系并进行ELISA方法的建立;DD2及其他12株单克隆抗体与合成的3条肽段都不存在结合位点,说明其结合的抗原位点在全肽段其他序列中,所以选取DD2株单克隆抗体搭配E12作为另一组体系进行研究;以E12株单克隆抗体作为包被抗体,分别与DD2、ED1株辣根酶标记的单克隆抗体建立双抗体夹心ELISA检测PGRP抗原。为了与双单克隆抗体体系比较,利用兔多克隆抗体作为一抗、酶标羊抗兔IgG作为二抗搭配E12株单克隆抗体,建立单克隆抗体、多克隆抗体双抗体夹心ELISA共同检测抗原。
在利用3种夹心抗体检测自制PGRP标准抗原实验中,3条标准浓度曲线线性关系良好;在半对数曲线斜率方面,E12株单克隆抗体曲线斜率最高,多克隆抗体组斜率最低;多克隆抗体组阴性对照值较高,考虑是因为多克隆抗体相对分子质量大、空间结构更为复杂、与抗原结合的基团较多等因素有关;利用方阵法确定的抗体工作浓度,ED1株单克隆抗体效价最高。
本方法的检出限要高于商品化试剂盒,虽然对阳性检出结果无明显影响,但是在低浓度水平范围的检测还不能达到理想水平;另外,从2种方法的标准抗原浓度曲线可以看出,在抗原浓度在低浓度水平范围内时(<100 pg/mL),试剂盒的曲线斜率要高于本方法的斜率,也就是说,在此范围内本方法对于单位抗原浓度变化较试剂盒来说不够灵敏。
我们的实验避免2种单克隆抗体交叉同一抗原决定簇而产生竞争性抑制,对作为一抗的单克隆抗体利用改良过碘酸钠法进行辣根过氧化物酶标记,建立双抗体夹心ELISA,并应用于患者血清样品的检测。此方法优点如下:2种单克隆抗体特异结合同一抗原的不同位点可避免假阴性结果出现;避免了2种单克隆抗体竞争性结合同一抗原决定簇,所以酶标抗体的酶联信号释放程度非常;因为未使用二抗,相较于成型的PGRP抗原检测ELISA方法更为简洁有效,并可减少非特异反应发生的概率。
[1]李 静,武新虎,朱锡旭.非小细胞肺癌EGFR-TKI耐药机制及耐药后治疗策略[J].医学研究生学报,2013,26(8):859-863.
[2]Kudo K,Ohyanagi F,Horiike A,et al.Clinicopathological findings of non-small-cell lung Cancer with high serum progastrin-releasing peptide concentrations[J].Lung Cancer,2011,74(3):401-404.
[3]Korse CM,Taal BG,Vincent A,et al.Choice of tumour markers in patients with neuroendocrine tumours is dependent on the histological grade.A marker study of Chromogranin A,Neuron specific enolase,Progastrin-releasing peptide and cytokeratin fragments[J].Eur J Cancer,2012,48(5):662-671.
[4]Miyake Y,Kodama T,Yamaguchi K.Pro-gastrin-releasing peptide(31-98)is a specific tumor marker in patients with small cell lung carcinoma[J].Cancer Res,1994,54(8):2136-2140.
[5]许德兵,宋 勇.分子生物标志物在肺癌早期诊断中的研究进展[J].医学研究生学报,2013,26(7):766-770.
[6]Nisman B,Biran H,Ramu N,et al.The diagnostic and prognostic value of ProGRP in lung Cancer[J].Anticancer Res,2009,29(11):4827-4832.
[7]Stieber P.Pro-gastrin-releasing peptide(ProGRP)-A diagnostic biomarker for small-cell lung cancer[J].Chin J Lung Cancer,2009,12(3):183-186.
[8]Niho S,Nishiwaki Y,Goto K,et al.Significance of serum progastrin-releasing peptide as a predictor of relapse of small cell lung Cancer:comparative evaluation with neuron-specific enolase and carcinoembryonic antigen[J].Lung Cancer,2000,27(3):159-167.
[9]Shibayama T,Ueoka H,Nishii K,et al.Complementary roles of pro-gastrin-releasing peptide(ProGRP)and neuron specific enolase(NSE)in diagnosis and prognosis of small-cell lung Cancer(SCLC)[J].Lung Cancer,2001,32(1):61-69.
[10]周明非,张贺秋,凌世淦.小细胞肺癌肿瘤标志物——胃泌素释放肽前体酶联免疫检测方法的研究进展[J].军事医学科学院院刊,2000,24(2):143-146.
[11]王敏杰,李学祥,高 佳,等.血清PGRP、TPS及NSE在小细胞肺癌患者治疗监测中的应用[J].中华检验医学杂志,2011,34(2):152-157.
[12]Torsetnes SB,Nordlund MS,Paus E,et al.Digging deeper into the field of the small cell lung Cancer tumor marker ProGRP:a method for differentiation of its isoforms[J].Proteome Res,2013,12(1):412-420.
