MicroRNA-129-2 靶向调控SOX4 抑制食管癌细胞增殖与侵袭转移的研究
2015-09-21肖晶鑑岳海英韦婷婷周平婷王仁生
肖晶鑑 岳海英 韦婷婷 周平婷 康 敏 王仁生
食管癌是常见的恶性肿瘤之一,其发病率位于全球恶性肿瘤第八位,致死率为第六位,其发病率近年来逐步上升[1,2]。食管癌治疗的主要手段有手术治疗、放疗和化疗等。由于食管癌起病隐匿,早期症状不典型、临床缺乏有效的早期诊断方法,且食管黏膜下有丰富的毛细淋巴管网,以致70%~80%的食管癌患者确诊时已出现淋巴结及远处转移,因而目前晚期食管癌仍以药物治疗为主,但总体疗效并不理想[3]。因此,探索食管癌发生、发展、转移的分子机制,确立防治靶点,寻求新的干预策略对提高食管癌的疗效具有特殊的重要性和迫切性。本研究拟通过体外实验探讨MicroRNA-129-2 靶向调控SOX4 抑制食管癌细胞增殖与浸润转移的作用及作用机制,同时通过体内实验观察MicroRNA-129-2 对食管癌细胞增殖的影响。具体报道如下。
1 资料与方法
1.1 一般资料食管癌细胞株NMC109 购自中科院上海细胞生物学研究所细胞库。雄性裸鼠60 只(SPF级),体质量18 ~22 g(4 ~5 周),购自广西医科大学实验动物中心。DMEM 低糖细胞培养基为美国Gibco公司生产;质粒提取试剂盒为天根生化科技(北京)有限公司生产;LipofectamineTM2000 转染试剂盒由Invitrogen 公司提供;嘌呤霉素为sigma 公司生产;SOX4多克隆抗体由cell signaling 公司提供;载体miRNASelectTMpEGP-miR 为美国Cell Biolabs 公司生产;MTT 由美国SIGMA 公司提供。
1.2 方法
1.2.1 细胞的培养和转染 食管癌细胞NMC109 培养于含10%胎牛血清、100 U/mL 青霉素和100 U/mL链霉素的DMEM 低糖培养基中,置于37℃、5% CO2饱和湿度培养箱中培养。miR-129-2 mimics 及miR-129-2 mimics NC 由广州锐博公司合成。细胞转染采用LipofectamineTM2000 试剂盒进行,方法参照试剂盒提供的使用说明。同时设立空白对照组,转染48 h 后加嘌呤霉素筛选阳性克隆。
1.2.2 MTT 实验检测细胞增殖 收集对数生长期的miR-129-2 mimics(高表达组)、miR-129-2 mimics NC(mimics NC 组)和未处理的NMC109(空白对照组)细胞,以0.25%胰酶消化,计数,接种于96 孔培养板内,使每孔细胞密度为5 000 个,每组设4 个平行孔并设不含细胞的校正孔,置于37℃,5%CO2细胞培养箱中培养24 h 使细胞贴壁,将96 孔板置于37℃,含5%CO2及100%湿度的细胞培养箱中孵育,于终止前4 h,每孔加入5 g/L MTT 溶液20 μL,继续孵育4 h 后弃去上清液,加入150 μL 二甲基亚砜,轻轻振荡10 min,使结晶物完全溶解,于490 nm 波长处在荧光酶联分析仪上测光吸收值(A 值),实验重复3 次。
1.2.3 细胞侵袭实验检测 同样设立上述3 组。在Boyden 小室下室加入含10%FBS 的完全培养基,上、下室之间铺有聚碳酸酯微孔滤膜(直径13 mm、孔径8 μm),膜上均匀铺50 μg/孔的人工基底膜胶(Matrigel,BD 公司),37 ℃温箱聚合30 min。取对数生长期细胞悬液400 μL(2×104个细胞)加入上室,37 ℃,5%CO2条件下培养48 h。吸去上室液体,擦去膜表面未侵袭的细胞及Matrigel 胶,生理盐水漂洗,甲醇固定30 min,0.1%结晶紫染色。每组设3 个平行样本,随机计数5 个400 倍显微视野下的穿膜细胞数,取其平均值,实验重复3 次。
1.2.4 Western Blot 检测蛋白的表达 分别收集上述细胞用蛋白裂解液处理之后离心取上清,分别取各组蛋白30 μL 于8%SDS-PAGE 电泳电转移到PVDF 膜上。用脱脂奶粉封闭1 h,覆上SOX4 兔单抗(1 ∶100)过夜,TBST 洗涤3 次,每次10 min。加入辣根过氧化物酶标记的山羊抗兔二抗(1 ∶200),37℃孵育1 h,洗膜后含化学发光剂A、B 的水溶液中激发荧光,在暗室中压X 片,然后显影、定影,应用Quantity One 软件进行图像分析。
1.2.5 裸鼠异种移植瘤动物模型的建立 将对数生长期的高表达组、mimics NC 组的细胞及空白对照组细胞分别经胰酶消化、离心、收集、计数后,制备成5×107 个/mL 的细胞悬液,将细胞悬液注入裸鼠腋窝中部背侧皮下,每只裸鼠腋下接种0.2 mL,约1 周后接种原位出现肿瘤,每3 d 测量1 次各组裸鼠的体重和瘤体大小。每组接种裸鼠20 只。测量瘤体最长径(a)与最短径(b),计算肿瘤体积(V),V=πab2/6。观察30 d 后,处死裸鼠,取瘤组织,称瘤重,计算抑瘤率。抑瘤率(%)=(1-处理组平均瘤重/对照组平均瘤重)×100%;肿瘤相对体积:RTV=Vt/V0,Vt 为实验结束时肿瘤体积,V0 为肿瘤初始体积;相对肿瘤增殖率:T/C(%)=RTV 处理组/RTV 对照组×100%。
1.2.6 统计学方法 使用SPSS19.0 统计软件进行统计分析,计量资料采用±s 表示,采用单因素方差分析进行统计学处理,以P <0.05 为差异有统计学意义。
2 结果
2.1 MTT 实验检测细胞增殖作用如图1 及表1 所示,miR-129-2 高表达组、空白对照组、miR-129-2 mimics NC 组24 小时时已开始出现差异(F=10.419,P <0.05);自48 小时起差异逐渐增大(F=317.336,P <0.001);第72 小时(F=84.097,P <0.001);96 小时(F=215.675,P <0.001);120 小时(F=362.735,P <0.001)。提示miR-129-2 能显著降低食管癌NMC109 细胞的增殖能力,随着培养时间的延长,抑制作用越明显。
2.2 Transwell 穿膜实验检测细胞侵袭力高表达组及mimics NC 组平均通过细胞数分别为(350.00±24.02)个、(699.67±17.79)个。空白对照组的NMC109 细胞组平均通过细胞数为(703.00±18.36),差异有统计学意义(F=350.00,P <0.001)。详见图2。
2.3 Western Blot 检测结果结果显示,转染了miR-129-2 mimics 的食管癌NMC109 细胞中SOX4 蛋白表达量(0.10±0.004)比转染miR-129-2 mimics NC 的细胞中SOX4 蛋白表达量(0.34±0.028)和空白对照组(0.43±0.011)明显减少,各组间两两比较差异均有统计学意义(F=279.602,P <0.001)。详见图3。
表1 miR-129-2 质粒对NMC109 细胞不同时间增殖活性的影响±s)
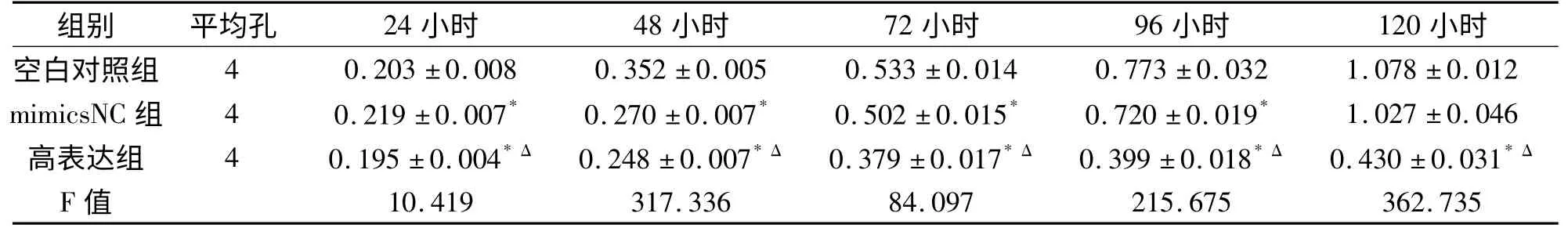
表1 miR-129-2 质粒对NMC109 细胞不同时间增殖活性的影响±s)
注:高表达组vs 空白对照比较,*P <0.05;高表达组vs mimicsNC 组比较,ΔP <0.05
?
2.4 miR-129-2 对裸鼠体质量及移植瘤重的影响实验中各组无一例死亡,miR-129-2 mimics 荷瘤组、miR-129-2 mimics NC 荷瘤组及空白对照组体质量差异均未超过20%。miR-129-2 mimics NC 组与空白对照组裸鼠于左侧腋下注射细胞后的第7 天出瘤,miR-129-2 mimics 组在注射后的第10 天可测得瘤体体积。转染miR-129-2 mimics 的食管癌NMC109 细胞移植瘤具有明显的抑瘤作用(图4),根据定期测得的瘤体长、短径计算瘤体体积并绘制生长曲线(图5),各组瘤体湿重分别为:miR-129-2 mimics 组(0.90±0.03)g、空白对照组(1.17±0.05)g、miR-129-2 mimics NC 组(1.16±0.07)g,差异有统计学意义(F=53.08,P <0.01),详见图6、7。各组瘤体终体积和相对肿瘤体积:miR-129-2mimic 组为(278.52±31.10)mm3、(8.70±3.10),空白对照组为(1041.44±69.69)mm3、(17.78±2.37);miR-129-2mimics NC 组为(1022.26±61.92)mm3、(18.80±4.48)。3 组比较差异有统计学意义(F=352.714,P <0.001;F=15.755,P <0.001)。详见表2。miR-129-2 mimics NC 组及空白对照组间无明显差异(P >0.05)。miR-129-2 高表达组抑瘤率为22.1%,相对肿瘤增殖率为46.3%,miR-129-2mimics NC 组抑瘤率为1.1%,相对肿瘤增殖率为94.59%。
3 讨论
基因干预性治疗是目前探索肿瘤防治的研究热点,在众多的癌基因表达调控的研究中,microRNA 的作用已经越来越受到重视。microRNA 是一种真核生物内源性小分子单链RNA,是近年来新发现的一类非编码小RNA。miRNAs 在细胞的增殖、分化及凋亡等方面有重要的作用,并对真核生物基因的表达有调控作用。miRNA 分子通过形成RNA 诱导沉默复合体与靶基因3‘端非翻译区不完全互补结合,通过诱导mRNA 的切割降解、翻译抑制或者其他形式的调节机制抑制靶基因的表达。目前,miRNA分子及其靶基因的研究已成为基因调控研究领域的重要分子和热点,研究发现半数以上的miRNA 位于肿瘤相关的基因组区域,部分miRNA 在多种肿瘤中异常表达[4]。有文献证实miRNA 的失调在乳腺癌的发生发展及侵袭转移中起着重要的作用[5]。
某些癌基因不仅是肿瘤组织的标志,而且在生物学功能上影响肿瘤的发生发展。SOX 基因家族有32个成员,其中SOX4 在肿瘤中的作用尤其引人关注,该家族为控制发育的基因家族,在个体发育过程中对性别分化及组织器官形成起重要作用。近年来大量报道发现SOX4 在多种肿瘤中高表达,如前列腺癌[6],乳腺癌[7]和肺癌[8]等,这些研究结果表明SOX4 是肿瘤发生发展中重要的癌基因。此外,SOX4 基因与肿瘤的演进、转移密切相关的作用也得到大量研究结果证实。近年研究均指出SOX4 基因在胃癌、肺癌和子宫内膜癌中的表达与肿瘤的分化、转移密切相关[9-11]。由此显示SOX4 基因的高表达可能是肿瘤发生发展的重要因素之一。
表2 3 组间裸鼠移植瘤瘤体湿重、终体积、肿瘤相对体积的比较(±s)

表2 3 组间裸鼠移植瘤瘤体湿重、终体积、肿瘤相对体积的比较(±s)
注:高表达组vs 空白对照,*P <0.05;高表达组vs mimics NC 组比较,ΔP <0.05
?
本课题组前期研究[12]发现,食管癌组织中SOX4蛋白高表达与食管癌的转移密切相关,而miR-129-2分子在食管癌组织中表达显著下调;荧光素酶活性分析报告也证实SOX4 基因是miR-129-2 的直接作用靶标。本研究通过向NMC109 细胞中转入外源性miR-129-2mimics,观察其在体内外上调miR-129-2 表达后食管癌细胞生物学特性的变化,结果发现,转染miR-129-2mimics 的NMC109 细胞的体外增殖和侵袭的能力受到明显的抑制,同时蛋白表达的检测结果表明上调miR-129-2 后,NMC109 细胞中的SOX4 蛋白表达水平与对照组相比有明显的下调。这一结果与前期实验研究相互印证,证实了miR-129-2 对SOX4 蛋白的调控作用。综合上述结果表明,上调miR-129-2 表达后所呈现的抑瘤作用和抑制转移作用与下调SOX4 蛋白表达有关。裸鼠移植瘤模型中肿瘤的生长同样受到明显抑制,这一现象的发生是否同体外实验具有相同的机制有待进一步研究。
[1] Scarpa M,Pinto E,Saadeh LM,et al. Sleep disturbances and quality of life in postoperative management after esophagectomy for esophageal cancer[J]. World J Surg Oncol,2014,12:156.
[2] Pearce N,Blair A,Vineis P,et al. IARC Monographs:40 Years of Evaluating Carcinogenic Hazards to Humans[J].Environ Health Perspect,2015,123(6):507-514.
[3] 程欣,陈思禹,刘福国,等. 食管癌化疗进展[J]. 癌症进展,2013,(5):425-430.
[4] Dmitriev P,Barat A,Polesskaya A,et al. Simultaneous miRNA and mRNA transcriptome profiling of human myoblasts reveals a novel set of myogenic differentiation-associated miRNAs and their target genes[J]. BMC Genomics,2013,14:265.
[5] 骆广涛,王本忠.乳腺癌中EZH2 与miRNA 调控关系的研究进展[J].安徽医学,2015,36(8):1034-1036.
[6] Yang M,Wang J,Wang L,et al. Estrogen induces androgen-repressed SOX4 expression to promote progression of prostate cancer cells[J]. Prostate,2015,75(13):1363-1375.
[7] Song GD,Sun Y,Shen H,et al. SOX4 overexpression is a novel biomarker of malignant status and poor prognosis in breast cancer patien-ts[J]. Tumour Biol,2015,36(6):4167-4173.
[8] Wang D,Hao T,Pan Y,et al. Increased expression of SOX4 is a biomarker for malignant status and poor prognosis in patients with non-small cell lung cancer[J].Mol Cell Biochem,2015,402(1-2):75-82.
[9] Shen R,Pan S,Qi S,et al. Epigenetic repression of MicroRNA-129-2 leads to overexpression of SOX4 in gastric cancer[J]. Biochem Biophys Res Commun,2010,394(4):1047-1052.
[10]周永春,陈艳,王熙才,等. Sox4 表达抑制对宣威地区女性肺癌细胞凋亡影响及其机制的探讨[J]. 中华肿瘤防治杂志,2013,20(8):572-579.
[11]Huang YW,Liu JC,Deatherage DE,et al. Epigenetic repression of MicroRNA-129-2 leads to overexpression of SOX4 oncogene in endometrial cancer[J]. Cancer Res,2009,69(23):9038-9046.
[12]Kang M,Li Y,Liu W,et al.miR-129-2 suppresses proliferation and migration of esophageal carcinoma cells through downregulation of SOX4 expression[J]. Int J Mol Med,2013,32(1):51-58.
