雌激素抑制大鼠肝癌肺转移机制研究
2015-09-21王永仓许戈良赵旭辉刘巧玉
王永仓 许戈良 赵旭辉 魏 忠 樊 平 戴 寅 谢 钊 刘巧玉
肝细胞肝癌(hepatocellular carcinoma,HCC)是常见的原发性肝癌,是我国高发、危害极大的恶性肿瘤,目前确切的病因还不明确,多认为其发病是多因素、多步骤的复杂过程[1]。雌激素对肝癌有抑制作用[2,3],雌激素对肝癌生成有保护作用,其机制可能与雌激素减少肿瘤微环境中炎症因子的释放有关[4,5]。我院进一步研究雌激素对大鼠肝癌模型中肝癌肺转移形成的影响及其可能的机制,现报道如下。
1 材料与方法
1.1 实验材料SPF 级雌性SD 大鼠160 只,周龄5 ~6周,体质量120 ~160 g,由安徽省立医院动物实验中心饲养。将大鼠随机分为4 组:对照组、切除卵巢组、假手术组和去卵巢后加雌激素组[给予30 μg/(kg·d)17α-炔雌醇(17α-ethynylestradiol,17α-EE2)]。二乙基亚硝胺、N-亚硝基吗啉、17α-EE2 购自美国Sigma 公司。大鼠雌二醇(estradiol,E2)、17α-EE2、肝细胞生长因子(hepatocyte growth factor,HGF)、白介素6(interleukin-6,IL-6)酶联免疫吸附法试剂盒购自美国R&D 公司,雌激素受体α(extrogen receptor α,ERα)、磷酸化雌激素受体α(phospho-estrogen receptor alpha,P-ERα)、肝细胞生长因子(hepatocyte growth factor,HGF)和IL-6单克隆抗体购自美国Santa Cruz 公司,逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)引物由上海生工生物工程公司合成。
1.2 方法
1.2.1 造模 对切除卵巢组、假手术组和去卵巢后加雌激素组进行手术处理,去卵巢后加雌激素组在术后第2 天即给予17α-EE2 直到实验结束,剂量为30 μg/(kg·d)。诱癌方法参照本课题组研究方法[6]。
1.2.2 实验终点 诱癌20 周后集中处死所有大鼠,观察各组大鼠肝癌及肺转移发生情况。标本经甲醛固定、石蜡包埋后染色并镜下观察。
1.2.3 免疫组织化学 染色采用免疫组织化学SP 法检测各组成瘤大鼠肝癌组织中ERα、P-ERα、HGF 和IL-6 的表达[7]。
1.2.4 RT-PCR 取各组新鲜肝癌组织,用Trizol 试剂(购自美国Promage 公司)提取组织及细胞中总RNA,操作步骤按说明书进行。引物序列及方法见先前研究[8]。1.3 统计学方法 采用SPSS 13.0 进行统计分析,计数资料数据以百分比表示,统计分析采用χ2检验,以P <0.05 为差异有统计学意义。
2 结果
2.1 大鼠肝癌及肺转移发生率大鼠在诱癌20 周后均生成肿瘤,实验终点各组大鼠肝癌发生率分别为64.00%、92.59%、58.62%和44.44%,切除卵巢组大鼠肝癌发生率明显高于其他3 组,差异有统计学意义(χ2=7.52,P <0.05)。解剖结合镜检,提示大鼠生成肝肿瘤为HCC。对照组、切除卵巢组、假手术组和去卵巢后加雌激素组肺转移发生率分别为25.00%、60.00%、17.65%和16.67%。切除卵巢组大鼠,即去除了雌激素的保护作用后,肝癌肺转移发生率明显高于其他3 组,差异有统计学意义(χ2=8.22,P <0.05)。见表1。
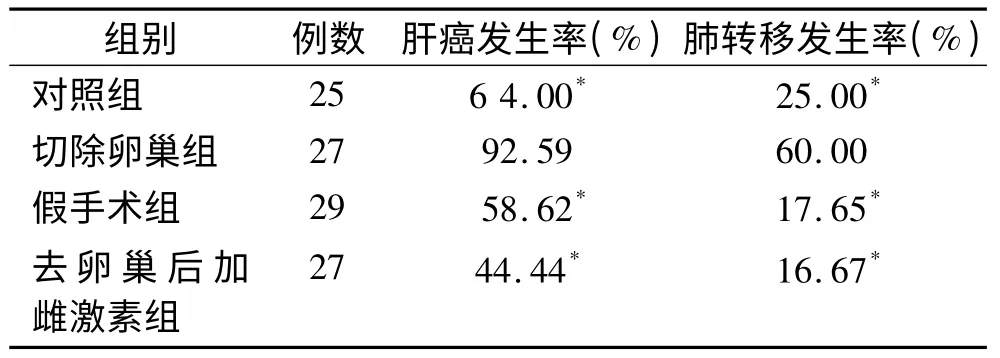
表1 4 组大鼠肝癌及肺转移发生率比较
2.2 肝癌组织中ERα、P-ERα、HGF 和IL-6 蛋白表达水平通过免疫组织化学染色,肝癌肺转移发生率最高的切除卵巢组大鼠肝癌组织中ERα、P-ERα 表达阳性率最低,而HGF 和IL-6 表达阳性率最高,与其他3组相比,差异有统计学意义(χ2=11.22 P <0.05)。见表2。
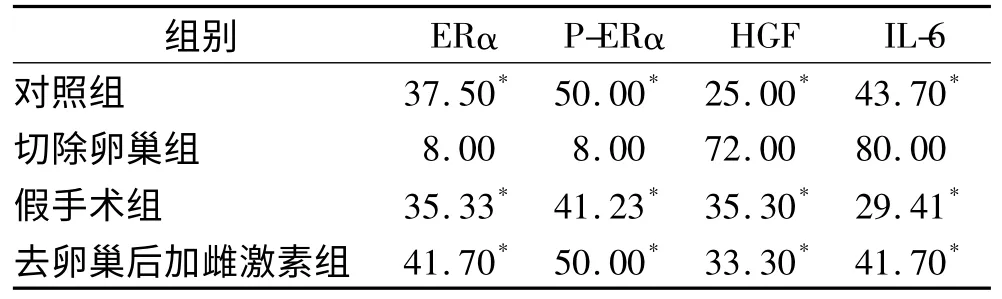
表2 肝癌组织ERα、P-ERα、HGF 和IL-6免疫组化染色阳性率(%)
2.3 肝癌组织中ERα、HGF 和IL-6 分子表达水平
进一步用半定量RT-PCR 方法分析4 组大鼠肝癌组织中ERα、HGF 和IL-6 的mRNA 表达水平,各指标的结果与免疫组织化学染色结果得到了互相验证。肝癌肺转移发生率最高的切除卵巢组,大鼠肝癌组织中ERα mRNA 的表达水平最低,而HGF 和IL-6 的mRNA 表达水平最高,与其他3 组相比,差异有统计学意义(χ2=12.64,P <0.05)。见图1、图2。
3 讨论
流行病学研究及临床病例报道发现女性的肝癌发病率显著低于男性,这引起了临床对雌激素抗肝癌作用的关注,雌激素对肝癌的发生发展有保护作用[9,10],但对肝癌肺转移的影响研究较少。在本次实验终点,4组大鼠解剖学结果发现在去除了雌激素的保护作用后,大鼠肝癌肺转移发生率明显增高。
国内对于雌激素抑制肝癌远处肺转移的作用机制研究报道甚少,近年来对肿瘤的转移研究热点之一是肿瘤微环境,已有研究[11]表明肿瘤微环境中产生的促炎因子促进肿瘤的侵袭和转移。在肿瘤的发生阶段这种作用可能并不明显,一旦肿瘤根深蒂固后这种微环境的变化,尤其是一些炎症因子的释放,会改变组织的渗透压,影响肿瘤组织的营养代谢环境,并发挥出免疫炎性作用,促进肿瘤新生血管生成等,从而有利于肿瘤的侵袭和转移[12,13]。检测4 组大鼠肝癌组织中HGF、IL-6、ERα 表达水平,结果显示大鼠肝癌肺转移发生率与肝癌组织中ERα 水平表达呈反比,而与HGF、IL-6表达水平成正比。表明大鼠肝癌肺转移发生率越高,肝癌组织中ERα 表达水平越低,HGF、IL-6 表达水平越高,可以设想雌激素通过作用于ERα 减少了肝癌的肺转移发生率。
那么雌激素作用于ERα 后,又通过怎样的机制去降低大鼠肝癌肺转移的呢?已知HGF 是生物活性较广泛的生长因子之一,能刺激多种上皮和内皮细胞进行有丝分裂、运动,在组织器官修复、形态发生和肿瘤转移过程中发挥重要作用,而IL-6 主要由巨噬细胞、T细胞以及大部分肿瘤细胞产生,它在合成以及释放之后通过IL-6 受体向细胞内转到信号,在多种肿瘤中发挥着调节肿瘤生长的作用[11]。肝癌在从无到有的发展过程中逐步形成了独特的炎症性肿瘤组织代谢环境的生物学特征,其对肿瘤的增殖和转移具有重要影响[14]。依据本实验研究结果,可以推测雌激素是强抗氧化剂,其与肝癌细胞内的ERα 结合使其变成P-ERα而活化,介导雌激素发挥一系列生理作用。其中一种作用就是作用于炎症信号通路,减弱促炎因子(HGF、IL-6)的表达,从而改善肝肿瘤内的炎症微环境。由于肿瘤炎症微环境的改善,降低了肝癌肺转移的发生。本研究结果提示雌激素可能通过拮抗肝癌组织炎性微环境中HGF、IL-6 的生成释放抑制肝癌向远处组织如肺发生转移,这为临床上肝癌的靶向药物治疗提供了一定理论研究基础,详细机制有待进一步的研究。
[1] El-Serag HB,Rudolph KL.Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J].Gastroenterology,2007,132(7):2557-2576.
[2] Naugler WE,Sakurai T,Kim S,et al.Gender disparity in liver cancer due to sex differences in MyD88-dependent IL-6 production[J].Science,2007,317(5834):121-124.
[3] Shimizu I,Yasuda M,Mizobuchi Y,et al.Suppressive effect of oestradiol on chemical hepatocarcinogenesis in rats[J].Gut,1998,42(1):112-119.
[4] 王永仓,许戈良,荚卫东,等.生理性雌激素对大鼠肝癌生成的保护作用[J].中华实验外科杂志,2011,28(7):1105-1106.
[5] 韩圣瑾,许戈良,荚卫东,等.肝癌患者血清、癌组织中IL-6 表达及其性别差异[J].山东医药,2011,51(14):8-10.
[6] 王永仓,许戈良,荚卫东,等.去势对化学性诱导大鼠肝癌生成的影响[J].中华消化杂志,2011,31(4):249-252.
[7] Soresi M,Giannitrapani L,D'Antona F,et al.Interleukin-6 and its soluble receptor in patients with liver cirrhosis and hepatocellular carcinoma[J].World J Gastroenterol,2006,12(16):2563-2568.
[8] Wang YC,Xu GL,Jia WD,et al.Estrogen suppresses metastasis in rat hepatoce-llular carcinoma through decreasing interleukin-6 and hepatocyte growth factor expression[J].Inflammation,2012,35(1):143-149.
[9] Naugler WE,Sakurai T,Kim S,et al.Gender disparity in liver cancer due to sex differences in MyD88-dependent IL-6 production[J].Science,2007,317(5834):121-124.
[10]Shimizu I,Yasuda M,Mizobuchi Y,et al.Suppressive effect of oestradiol on chemical hepatocarcinogenesis in rats[J].Gut,1998,42(1):112-119.
[11]Kim S,Takahashi H,Lin WW,et al.Carcinoma-produced factors activate myeloid cells through TLR2 to stimulate metastasis[J].Nature,2009,457(7225):102-106.
[12]李军华,周薇.p38 丝裂原活化蛋白激酶特异性抑制剂SB203580 对溃疡型结肠炎大鼠血清IL-6 和IL-1β 的影响[J].安徽医学,2014,35(7):977-980.
[13]洪慧,王鹤,贾超颖,等.HR-HPV 感染后宫颈微环境中免疫炎症因子变化[J].安徽医学,2014,35(1):9-11.
[14]Kim S,Takahashi H,Lin WW,et al.Carcinoma-produced factors activate myeloid cells through TLR2 to stimulate metastasis[J].Nature,2009,457(7225):102-106.
