农杆菌介导的马尔尼菲青霉基因转化技术的建立及优化
2015-09-16李鑫垒李昕曹存巍广西医科大学第一附属医院皮肤性病科南宁5300常德市第一人民医院皮肤性病科常德45000
李鑫垒 李昕 曹存巍(.广西医科大学第一附属医院皮肤性病科,南宁5300;.常德市第一人民医院皮肤性病科,常德45000)
农杆菌介导的马尔尼菲青霉基因转化技术的建立及优化
李鑫垒1李昕2曹存巍1
(1.广西医科大学第一附属医院皮肤性病科,南宁530021;2.常德市第一人民医院皮肤性病科,常德415000)
目的建立农杆菌介导的马尔尼菲青霉(PM)基因转化技术,并对该技术条件进行优化。方法以二元质粒pDHt/SK为载体,通过农杆菌介导将pyrG基因插入马尔尼菲青霉尿嘧啶缺陷株SPM4(pyrG⁃,niaD⁃)中,在不含尿嘧啶的培养基中筛选阳性转化子。运用PCR验证重组子。进一步对影响转化效率的农杆菌类型、共培养浓度、转化媒介、共培养温度、共培养时间、乙酰丁香酮(AS)等六个条件进行优化。结果PCR验证pyrG基因成功的插入SPM4中,所得到转化子可稳定传代,通过条件优化,得到转化子约300个/106个细胞。选用AGL⁃1,以农杆菌共培养浓度为OD600=0.8,AS浓度为200 μmol/L,无膜IM固体共培养基为介质,25℃共培养48 h为最适转化条件。结论成功建立了农杆菌介导PM基因转化技术,简化并优化了转化条件,该方法可用于PM基因功能研究。
马尔尼菲青霉;农杆菌;转化
[Chin J Mycol,2015,10(2):88⁃91]
随着马尔尼菲青霉病(Penicilliosis marneffei,PSM)的发病率不断升高,PSM发病机制成为当前国内外研究热点[1]。对马尔尼菲青霉(Penicillium marneffei,PM)基因功能的研究是阐明其具体致病机制的有效途径。基因功能研究的方法之一是建立基因转化技术技术。目前PM基因转化最常用的方法是原生体转化法,但操作复杂、稳定性差,而由农杆菌介导的转化(Agrobacte⁃rium tumefaciens mediated transformation,ATMT)技术[2]具有操作简单、转化效率高、转化子稳定等特点[3],已成功应用于其他丝状真菌的基因转化。本实验拟构建农杆菌介导PM高效基因转化系统,对转化体系进行简化并优化,实现PM基因高效优质转化。
1 材料与方法
1.1材料
实验菌株PM尿嘧啶缺陷株SPM4(pyrG⁃,niaD⁃)及其母本菌株FRR2161,均由澳大利亚墨尔本大学Alex Andrianopoulous教授惠赠。根癌农杆菌EHA105(携利福霉素、链霉素抗性)及AGL⁃1(利福霉素、羧苄青霉素抗性)由本实验室保存。
质粒pDHt/SK::pyrG质粒,含卡那霉素抗性筛选标记及pyrG基因,本实验室前期工作中获得。质粒pLAX223为筛选标记pyrG来源。
主要试剂硝酸纤维膜购自上海金标公司,DNA提取试剂盒购自上海生工公司,乙酰丁香酮(AS)购自ALDRICH公司。
1.2方法
菌株的活化将含有质粒Pdht/SK::pyrG的农杆菌菌株EHA105、AGL⁃1分别接种在LB平板上(含卡那霉素50 μg/L,利福平200 μg/L),28℃暗培养,多次划线分离单克隆菌株。
真菌孢子悬液的制备将SPM4接在SDU斜面培养基上,每7~10 d传代1次,使其有足够的孢子产生。用基本培养基(MM)冲洗孢子,红细胞计数板调整孢子浓度为5×106个/mL。
予诱导培养基(IM)液基调整农杆菌浓度将农杆菌OD600分别调整为0.6、0.7、0.8、0.9、1.0;取预先备好PM孢子,与农杆菌等体积混合;将混合物涂于共培养介质上分别以28℃、25℃暗培养24/48/72 h(三种不同的共培养介质:硝化纤维素膜+IM固体培养基;IM固体培养基;IM液态静置。共培养基中不加AS或加入AS浓度分别调整为50、100、200、300、400 μmol/L);于SD筛选培养基(含200 μg/L头孢塞肟,不含尿嘧啶)筛选阳性转化子,多次转代,以纯化转化子。
转化子PCR验证从SD培养基上刮取少量菌丝,按照上海生工DNA提取试剂盒说明提取DNA;PCR反应条件:95℃变性5min;95℃30 s,58℃30 s,72℃30 s,30个循环;72℃延伸10min 4℃保存。将PCR产物经1.5%琼脂糖凝胶电泳。
2 结 果
2.1农杆菌介导的PM转化
将pDHt/SK::pyrG通过冻融法导入农杆菌后,其可在含有卡那霉素的培养基上生长(见图1)。将含有pDHt/SK::pyrG的农杆菌浓度调整至OD600=0.8和PM孢子悬液共培养,并于SD筛选培养基(含200 μg/L头孢塞肟,不含尿嘧啶)筛选阳性转化子。得到SPM4阳性转化菌株在无尿嘧啶的SD培养基上生长良好(见图2)。以阳性转化株DNA模板,用pyrG上下游引物行PCR扩增后,在1 200 bp处出现阳性条带,证实pyrG基因成功的整合SPM4(见图3)。将转化子接种在尿嘧啶缺陷的SD培养基上连接传代6次后,转化子仍然生长良好,且生物学性状无明显改变,PCR仍能检测到pyrG插入片段的存在,表明ATMT方法获得PM突变株具有良好的遗传稳定性。
2.2转化条件的优化
农杆菌类型、浓度对转化率的影响农杆菌AGL⁃1较EHA105转化效率更高,当农杆菌OD600=0.6、0.7时较化效率较低,OD600=0.8时转化效率达到最高,而当OD600=0.9、1.0时转化效率则有降低趋势(见图4)。
不同的共培养介质对转化效率的影响以IM液体为共培养介质未得到转化子;而硝化纤维膜或无膜的IM固体共培养基为介质能成功的实验转化,且二者的转化效率无明显差异。而直接将混合物涂于IM固体培养基省去了硝酸纤维素膜这一介质,更节省耗材,因此最合适PM转化。
AS对转化效率的影响在无AS存在情况下,得不到转化子。AS在50~200 μmol/L范围内,所得转化子随AS随浓度增高而增高,200 μmol/L时达到最高,当AS的浓度浓度升高至300、400 μmol/L反而引起转化效率降低,同时200 μmol/L所得到的转化子背景较少,易筛选(见图5)。
共培养时间及温度对转化效率的影响共培养24 h可见少数几个转化子,随着共培养时间的增加至48 h,能得到较多的转化子,但当72 h,阳生转化子过多,不利于筛选。农杆菌在28℃较25℃共培养易出现过生长,影响转化子的生长,不利于转化子进一步纯化。因此25℃更适合PM转化(见图6)。
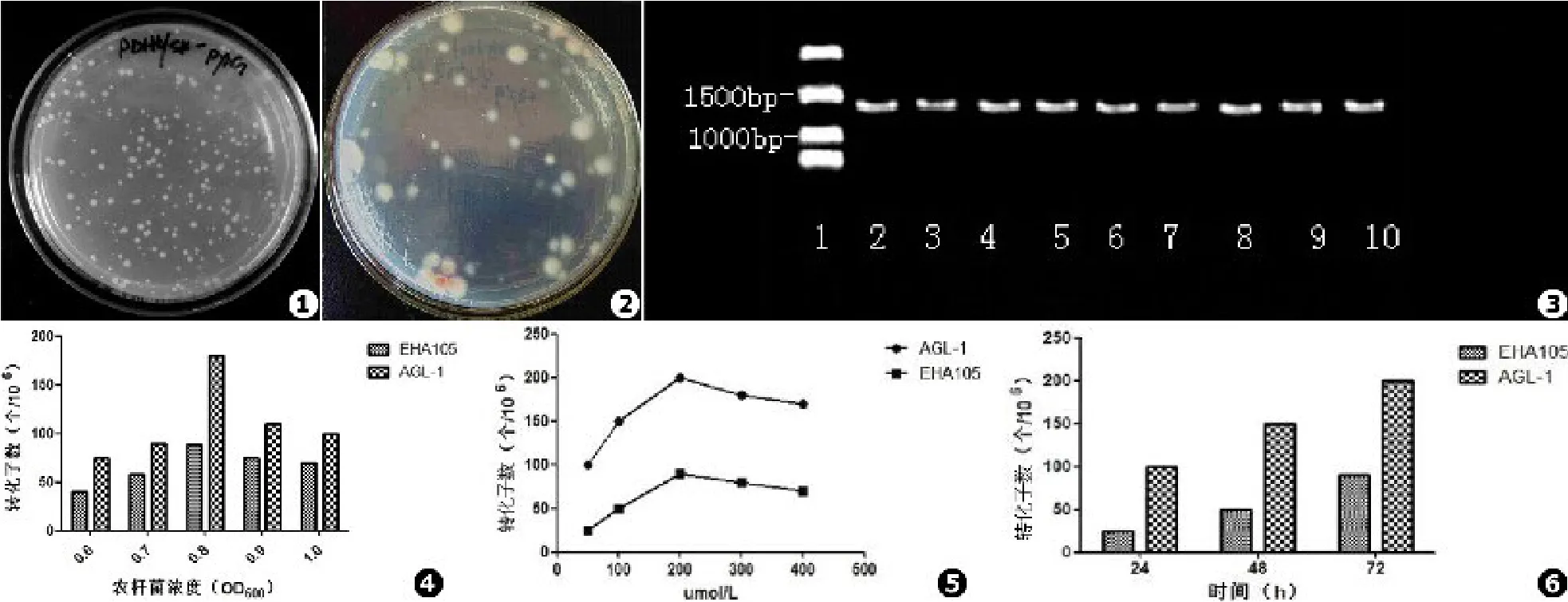
图1 农杆菌在含卡那霉素的培养基上生长 图2 阳性转化株 图3 阳性转化株PCR电泳图:泳道1.MARK,泳道2~10.转化子PCR产物 图4 共培养浓度对转化效率的影响 图5 AS的浓度对转化效率的影响 图6 共培养时间对转化效率的影响Fig.1 A.tumefaciens grow in the medium containing kanamycin Fig.2 Positive transformants Fig.3 Positive Transformats PCR electrophoresis:Lane 1.The MARK,Lane 2⁃10.Positive transformats of PCR Fig.4 The influence of cocultivation concentration on the fransform efficiency Fig.5 The influence of AS concentration on the fransform efficiency Fig.6 The influence of cocultivation time on the fransform efficiency
3 讨 论
大多数微生物功能基因组学研究的前提是获得稳定的转化子,目前马尔尼菲青霉DNA转化最常用的方法是CaCL2⁃PEG介导的原生质体转化法,该方法可获得约140/106转化子,但操作较复杂[4]。ATMT方法简单、效率高、成本低,已被大量应用于丝状真菌的DNA转化研究中[3],但国内外应用该法进行PM基因研究的报道较少,如何优化ATMT条件,提高PM的DNA转化效率,更好的应用于PM基因功能研究是亟待解决的问题。本研究在成功建立ATMT转化PM的技术基础上,对影响转化效率的因素进行了深入研究。
农杆菌菌株毒力是影响ATMT转化效率的重要因素[5]。Zhang P等[6]发现高毒力的EHA105比LBA4404更适合PM转化,而本实验发现毒力更高的AGL⁃1比EHA105转化效率更高。
诱导剂是影响ATMT成功转化的另一重要因素。我们对常用诱导剂AS不同浓度的诱导效率进行研究,结果显示,农杆菌与PM共培养未加AS没有得到转化子。加入AS后所得转化子随AS随浓度增高而增高,AS浓度为200 μmol/L时达到最高,继续升高反而引起转化效率降低,与Zhang P[6]等选择的AS浓度一致。我们还观察到,预培养时是否加入AS对于ATMT介导的PM转化效率无明显影响,这与龙朝钦在烟曲霉的研究中所到的结果相似[7]。
同时本研究对比了不同的共培养介质对AT⁃ MT转化效率的影响。Sugui等[8]认为液体培养基较硝酸纤维膜是一种更有效转化烟曲霉的共培养介质,而本实验中,IM液态静置培养法未得到转化子。这说明针对不同的受体真菌选择合适的共培养介质,对于成功的实验ATMT转化很重要[9]。
农杆菌与受体细胞数的浓度影响ATMT转化效率[10]。本实验参考国外文献[6,11],以PM孢子数为5×106个/mL为前提,在一定范围内,转化效率随农杆菌浓度升高而增高,当OD600=0.8时转化效率达到最高,而当浓度继续升高时转化效率则有降低趋势,分析可能的原因是因为农杆菌浓度低时,转化的受体孢子有限;浓度过高时,生长过快,不利于转化子生长[7]。共培养温度和时间也是影响转化效率的重要因素,共培养时间太短,农杆菌未完成转化而得不到转化子;时间太长不仅会引起农杆菌过多的生长,且不利于插入的外源基因的表达[12]。过高的温度造成农杆菌侵染力下降[5]。最终确定25℃共培养48 h,对于PM转化最佳。
综上所述,ATMT是一种有效的介导马尔尼菲青霉遗传转化的方法,由AGL⁃1的转化主体(OD600=0.8),PM孢子为转化受体(孢子数=5× 106个/mL),pDHt/SK为载体,尿嘧啶缺陷作筛选标记所构成的ATMT转化系统,在AS浓度为200 μmol/L,25℃共培养48 h后得到稳定遗传的转化子。与国外报道的PM遗传转化相比,本实验以营养为筛选标记,相比抗生素筛选能够避免假阳性子的出现;同时直接将混合物涂于IM固体培养基上,省去了硝酸纤维素膜,减少实验耗材,简化并优化了ATMT转化系统。
[1]李凌华,唐小平,胡凤玉.马尔尼菲青霉菌的分子学研究进展[J].国际流行病学传染病学杂志,2009,36(4):251⁃254.
[2]Michielse CB,Hooykaas PJ,van den Hondel CA,et al.Agrobac⁃terium mediated transformation of the filamentous fugus Aspergil⁃lus awamor[J].Nat Protoc,2008,3(10):1671⁃1678.
[3]Zheng Z,Huang C,Cao L,Xie C,et al.Agrobacterium tumefa⁃ciens⁃mediated transformation as a tool for insertional mutagene⁃sis in medicinal fungus Cordyceps militaris[J].Fungal Biol,2011,115(3):265⁃274.
[4]Borneman AR,Hynes MJ,Andrianopoulos A.An STE12 homolog from the asexual,dimorphic fungus Penicillium marneffei com⁃plements the defect in sexual development of an Aspergillus nidulans steA mutant[J].Genetics,2001,157(3):1003⁃1014.
[5]钱科,胡昌华.根癌农杆菌介导丝状真菌遗传转化的影响因子研究进展[J].中国医药指南,2012,3(10):371⁃373.
[6]Zhang P,Xu B,Wang Y,et al.Agrobacterium tumefaciens⁃medi⁃ated transformation as a tool for insertional mutagenesis in the fungus Penicillium marneffei[J].Mycological research,2008,112(8):943⁃949.
[7]龙朝钦,邓军,郝飞,等.根癌农杆菌介导的烟曲霉转化条件的优化[J].西部医学,2008,20(20):261⁃264.
[8]Sugui JA,Chang YC,Kwon⁃Chung KJ,et al.Agrobacterium tume⁃faciens⁃mediated transformation of Aspergillus fumigatus:an effi⁃cient tool for insertional mutageneisis and targeted gene disrupion[J].Appl Environ Mircrobiol,2005,71(4):1781⁃1802.
[9]Figueiredo J,Goulin E,Tanaka F,et a1.Agrobacterium tumefa⁃ciens⁃Mediated transformation of Guignardia citricarpa[J].J Mi⁃crobiol Methods,2010,80(2):143⁃147.
[10]Marchand G,Forticr E,Neven B,et al.Alternative methods or genetic transformation of Pseudozana antarctica,a Basidio myce⁃tous yeast⁃like fungus[J].J Microbiol Method,2007,70(3):519⁃527.
[11]Leclerque A,Wan H,Abschutz A,et al.Agrobacterium⁃mediated insertional mutagenesis(AIM)of the entomopathogenic fungus Beauveria bassiana[J].Curr Genet,2004,45(2):111⁃119.
[12]沈卫锋,翁宏飚,牛宝龙,等.根癌农杆菌介导的灰葡萄孢菌遗传转化研究[J].遗传,2008,30(4):515⁃520.
[本文编辑]施慧
To establish and optimize the genetic transformation technology of Penicillium marneffei by Agrobacterium tumefaciens⁃mediated transformation
LI Xin⁃lei1,LI Xin2,CAO Cun⁃wei1
(1.Department of Dermatology and Venereology,The First Affiliated hospital ofGuangxi Medical University,Naning 530021,China;2.Department of Dermatology and Venereology,The First People’s Hospital of Changde,Changde 415000)
ObjectiveTo construct and optimize the condition of Agrobacteriumtumefaciens⁃mediated transformattechology in Penicillium marneffei.MethodA.tumefaciens transformed by Calcium chloride with pDHt/SK::pyrG plasmids insert pyrG gene into SPM4(pyrG⁃,niaD⁃),medium without uracil screening positive transformat,Using PCR verification restructuring.It aimed at finding out the optimal protocol by changing some important effecting factors including A.tumefaciens strains,concentration,transformat medi⁃um,co⁃cultivation temperature,period,AS.The positive transformant growed well in the media without uracil,and PCR analysis showed that T⁃DNA was inserted into the transformants.ResultThe transformation efficiency was about 300 transformants/106spores by optimizing.The optimal condition for AGL⁃1,concentration of A.tumefaciens OD600=0.8,the AS concentration of 200 μmol/L,without nitrocellulose filters,co⁃culture 48 h in 25℃.ConclusionA.tumefaciens⁃mediated transformattechology in P.marneffei.was successfully established,simplified and optimized.The method can be used for PM gene function research.
Penicillium marneffei;Agrobacterium tumefaciens;transformation
R 379.9
A
1673⁃3827(2015)10⁃0088⁃04
国家自然科学基金(81060128,81271804);广西自然科学基金(0991144,2012jjAA40175);广西卫生厅自筹课题(Z2007082)
李鑫垒,男(汉族),硕士研究生在读.E⁃mail:3024270@163.com
曹存巍,E⁃mail:caocunwei@yeah.net
2014⁃12⁃13
