肺超声在危重症患者中的临床应用
2015-09-06查长松
查长松,董 磊
正常肺泡含有大量气体,气体阻止了超声的传播,超声在肺表面仅观察到一些混响伪像,致使肺超声临床应用受限,仅局限在胸腔积液、胸膜肿瘤和邻近胸膜的肺病变,以及引导介入性操作[1]。然而,近10多年来,随着床旁超声在急诊和危重症患者的广泛应用,将超声拓展至肺的检查后改变了以往的观点。1997年Lichtenstein等[2]首次报道了超声肺彗星尾征(ultrasound lung comets,ULCs)体现了肺泡-间质综合征诊断指标的潜在意义。2004年Jambrik 等[3]又用 ULCs 评价血管外肺水(extravascular lung water)。之后,一些学者开始对肺超声伪像进行分析和解释,重新评价肺超声的临床应用和局限性。本文仅对肺超声在危重症患者中应用进展进行综述。
1 肺声像图
1.1 A线 胸膜线是一种粗糙的水平强回声线,在成人位于肋骨线以下0.5 cm,两肋间可见长度约2.5 cm。胸膜线代表胸膜层。随呼吸运动,正常肺脏层胸膜相对于壁层胸膜滑动,称为肺滑动征(lung sliding)。胸膜线下方区域为起自胸膜线的重复水平线,其间距与皮肤至胸膜线距离相等,约等于胸膜线长度,此称为A-线[2],见于正常通气肺。这是由于软组织和气体充盈的肺泡之间存在巨大声阻抗差而产生多重混响伪像,伪像区域为胸膜线以下胸壁反射[4]。所以,胸膜起到了像镜子一样的作用,阻止肺结构的真实显像。见图1。

胸膜线(细←)是一种粗糙的水平强回声线,在成人位于肋骨线以下0.5 cm,两肋间可见长度约2.5 cm。胸膜线下方区域为起自胸膜线的重复水平线,其间距与皮肤至胸膜线距离相等,约等于胸膜线长度,此称为A-线(粗←)图 1 A-线
1.2 肺实变声像图 肺实变时,液体和细胞成分大量增加导致肺泡气体显著减少或完全消失,当软组织与肺泡内容物声阻抗接近时,超声易于传播并产生实时显像,表现为低回声区或类组织样回声[4]。这种现象出现在大部分肺病,并可被超声显示。相反,超声不能用于评价肺气肿和机械通气引起的肺泡过度通气,因为肺泡气体含量增加,产生的镜面伪像不能和正常通气肺进行区别。见图2。

图 2 肺实变伴胸水
1.3 超声肺彗星尾征 亦称B线(图3),它像激光束一样起自胸膜线直达银屏底部的垂直强回声线,随肺滑动而移动,而A线消失[2]。当肺泡气体稍减少、液体稍增加但又不足以产生肺实变时,肺内仍有足够气体妨碍实时显像,而又没有那么多气体产生镜面伪像。此状态介于正常通气肺和实变肺之间,见于肺间质综合征。液体成分增加引起小叶间隔和肺间质增厚,这种胸膜下富水的结构太小难以被超声实时显示[2]。然而,间隔的增厚和气体与液体平衡的随后改变产生 ULCs[2,5]。 一个重量恒定而气体减少的肺和因为液体、细胞、结缔组织或血液成分增多导致重量增加的肺均可发生这种改变。换言之,不管是简单的气体减少,还是肺液体和细胞成分的增加,超声对器官密度变化是高度敏感的,这些已在体模、动物实验和人体中研究证实[4]。同时,超声是实时的,这允许分析肺的运动,增加了肺超声的诊断潜能。
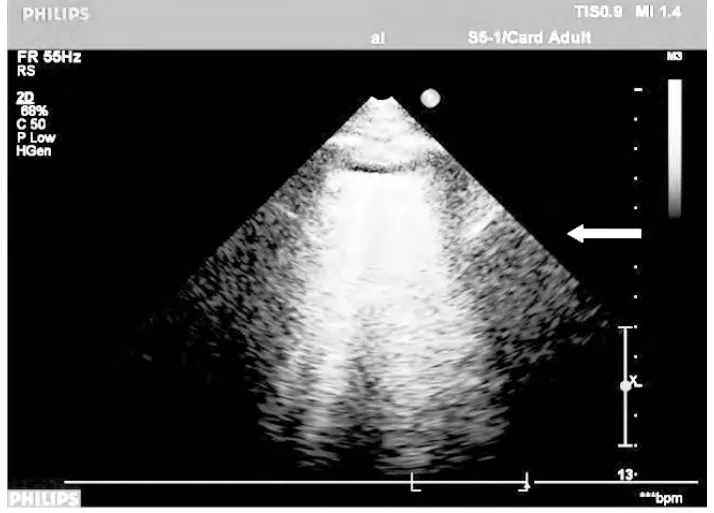
多条超声肺彗星尾征(B线,小↑),为像激光束一样起自胸膜线(大←)直达银屏底部的垂直强回声线,随肺滑动而移动,而A线消失。动态显像更清晰。图3 肺水肿
上述三种声像图表现是理解和解释现代肺超声的基础,对肺密度和通气程度不同有很高的诊断准确性。
2 临床应用
2.1 肺间质综合征 肺间质综合征(interstitial syndrome)是指由于间质内液体增加导致肺泡内气体受损,但一些肺仍保持通气的状态。ULCs是肺泡-间质综合征的超声征象,在危重和急诊患者中得到证实[2,6]。Lichtenstein 等[2]对 250 例 ICU 的连续呼吸困难患者观察ULCs,其中121例为X线证实的肺泡-间质综合征(弥漫性92例,局限性29例),129例为胸部X线正常;92例弥漫性肺泡-间质综合征中86例在整个肺表面出现ULCs,129例正常胸部X线患者中120例未见或仅在最后的外侧肋间见到,ULCs诊断肺泡-间质综合征的敏感性为93.4%,特异性为 93%。 Volpicelli等[6]研究结果相类似,ULCs检测放射线证实的肺泡-间质综合征的敏感性为85.7%,特异性为97.7%。虽然ULCs不能鉴别心源性肺水肿、急性呼吸窘迫综合征和肺纤维化,但对危重和呼吸困难的患者来说,这一简单床旁技术对诊断过程会产生即刻作用。在急性呼衰患者最初2 h,简化肺超声方案的应用比常用检查方法更为准确,表现出更好的即刻作用,对90.5%患者可做出及时准确的诊断[7]。对急性呼吸衰竭患者,ULCs有助于鉴别心源性和呼吸源性病变,因为COPD恶化、肺栓塞、肺炎和气胸表现为非间质性声像图[7,8]。Lichtenstein 等[8]对 66 例连续的呼吸困难患者(40例肺水肿,26例COPD)和80例无呼吸道疾病患者进行了肺超声检查,观察双侧前胸多发、弥漫性的 ULCs,100%肺水肿患者可见 ULCs,而92%COPD和98.7%无呼吸道疾病患者未见ULCs,ULCs有助于肺水肿和COPD的鉴别。
ULCs 是血管外肺水的敏感指标[3,9]。 Jambrik等[3]对121例连续住院患者[男 78例,女 43例,年龄(67±12)岁]ULCs计分和胸部X线血管外肺水计分,二者呈线性相关(r=0.78,P<0.01)。 在一组急性失代偿心衰和终末期肾衰的患者,ULCs代表血管外肺水,通过复查肺超声简单观察其数量变化来监测肺充血[10,11]。 Lichenstein 等[12]采用肺超声预测危重患者肺动脉栓塞压(PAOP),A优势型(双侧前胸以A线为主)预测PAOP≤13 mmHg(1 mmHg=0.133 kPa)的特异性为90%,敏感性67%,阳性预测值91%,阴性预测值65%;A优势型预测PAOP≤18mmHg的特异性93%,敏感性50%,阳性预测值97%,阴性预测值24%;A优势型提示干的小叶间隔,无须考虑静水压肺水肿发生,可继续补液治疗;而B优势型(双侧前胸以B线为主)提示间质性肺水肿,排除需继续补液的结论。
2.2 肺泡综合征 肺泡综合征(alveolar syndrome)是指肺泡内气体大量丢失和液体增加引起肺实变。只有当肺实变抵达胸膜时,才能被超声显示,表现为低回声区或组织样结构,这与周围通气的肺不同[13,14]。 虽然超早期肺炎很局限,而不靠近胸膜;但有临床症状的大部分患者病灶在某一点与胸膜接触,可被超声检测;98%危重患者的肺炎与胸膜接触[13]。超声检查气体完全脱失肺实变的信心与CT或MRI接近,同时超声还具有实时显像分析肺呼吸运动的优点[15]。超声通过观察病变形态、边缘、分布、血供、支气管气相和液相来鉴别不同类型的肺实变(如:肺炎、肺栓塞、挫伤和肺不张)[13-16]。 在肺炎危重患者,超声复查可用于监测抗生素和通气治疗的效果[17]。通过观察肺声像图变化来评价肺再通气过程,从实变的肺泡型到间质型,用B线密度和数目减少来判断肺通气功能的改善,最后出现正常通气肺镜面伪像。在7例肺泡蛋白沉积症患者肺泡灌洗期间,肺超声实时观察到这一演变过程[18]。液体灌注致肺气体丢失,超声从镜面伪像转变为间质型和肺泡型声像图,而当液体去除后肺泡恢复通气过程中观察到相反的变化。有趣的是间质型和肺泡型常同时存在,代表受累肺通气程度的不同。
2.3 胸膜综合征(pleural syndrome)超声是检测胸腔积液和引导介入性操作的首选方法,对气胸的诊断也表现出令人鼓舞的前景。多年来,因为气体不能被显示,超声被认为对气胸的诊断不可靠。当气体位于壁层和脏层胸膜之间时,不管是随呼吸的水平滑动还是心脏跳动所引起的垂直运动,肺的呼吸运动和B线消失。Lichtenstein等[19]观察到41例X线或CT证实的气胸患者肺滑动均消失,68例无气胸患者中6例(8.8%)肺滑动消失,超声检测气胸的敏感性为95.3%,特异性 91.1%,阴性预测值100%。一些超声征象(如:肺滑动、肺脉动、甚至单条B线)可确切除外气胸[19]。事实上,当肺镜面伪像运动消失而在胸壁上某点又观察到肺规则的滑动时,诊断气胸是可靠的。此点称为肺点(lung point),代表肺又与胸壁接触(胸腔内气体边缘)的那一点在胸壁上的投影[20]。 Lichtenstein 等[20]在 66 例气胸患者中44例观察到肺点 (包括8例隐匿性气胸中6例),而对照组未观察到,肺点诊断气胸的敏感性为66%,特异性 100%。 Soldati等[21]报道 109 例胸部创伤和多发伤患者,25个单侧胸部(23例,其中2例为双侧)螺旋CT确诊为气胸,胸部X线检查仅发现13个单侧胸部(敏感性52%,特异性100%),而肺超声检出23个单侧胸部,假阳性1例 (敏感性92%,特异性99.4%)。肺超声诊断气胸的潜在作用是重要的,特别是在心脏停搏和生命体征不稳定的患者。在这种极端的情况下,肺超声是一项安全、准确的床旁方法。而且,肺超声优于床旁放射性检查,成为创伤和侵入性操作后患者首选方法[20,21]。
3 肺超声的局限性
肺超声具有无创伤、无放射性、简便、快速、价格低廉和可重复检查的优点,尤其是危重患者,可在床旁检查,对设备要求低,临床医师可通过短时间培训快速掌握这一技术。结合临床资料,急诊和重症监护医师可迅速做出诊断和鉴别诊断,并指导治疗。肺超声的可行性、实用性和准确性均优于床旁胸部X线检查,是危重症患者床旁检查的首选方法。同时,亦应认识到肺超声的局限性。超声检测肺间质综合征是根据ULCs,而不是真实声像图;超声可显示肺表面实变病灶,但肺深层的病变未抵达胸膜时,超声会漏诊;受胸廓骨骼的影响,估计不足30%肺表面超声难以显示[4]。
综上所述,可见肺泡气体和胸廓骨骼不能阻止超声在肺疾病应用。虽然这些方法被忽略多年,但床旁肺超声是许多肺病研究的可靠方法,特别在急诊和危重患者[22]。
[1] Beckh S,Bolcskei PL,Lessnau KD.Real-time ultrasonography:a comprehensive review for the pulmonologist[J].Chest,2002,122(5):1759-1773.
[2] Lichtenstein D,Meziere G,Biderman P,et al.The comet-tail artifact: a ultrasound sign of alveolar-interstitial syndrome[J].Am J Respir Crit Care Med,1997,156(5):1640-1646.
[3] Jambrik Z,Monti S,Coppola V,et al.Usefulness of ultrasound lung comets as a nonradiologic sign of extravascular lung water[J].Am J cardiol,2004,93(10):1265-1270.
[4] Volpicelli G.Lung sonography[J].J Ultrasound Med,2013,32(1):165-171.
[5] Soldati G,Copetti R,Sher S.Sonographic interstitial syndrom:the sound of lung water[J].J Ultrasound Med,2009,28(2):163-174.
[6] Volpicelli G,Mussa A,Garofalo G,et al.Bedside lung ultrasound in the assessment of alveolar-interstitial syndrome[J].Am J Emerg Med,2006,24(6):689-696.
[7] Lichtenstein D,Meziere G.Relevance of lung in the diagnosis of acute respiratory failure:the BLUE protocol[J].Chest,2008,134(1):117-125.
[8] Lichtenstein D,Meziere G.A lung ultrasound sign allowing be
dside distinction between pulmonary edema and COPD:the comet-tail artifact[J].Intensive Care Med,1998,24(12):1331-1334.
[9] Picano E,Frassi F,Agricola E,et al.Ultrasound lung comets:a clinically useful sign of extravascular lung water[J].J Am Soc Echocardiogr,2006,19(3):356-363.
[10] Noble VE,Murray AF,Capp R,et al.Ultrasiund assessment for extravascular lung water in patients undergoing hemodialysis:time course for resolution[J].Chest,2009,135(5):1433-1439.
[11] Volpicelli G,Caramello V,Cardinale L,et al.Beside ultrasound of the lung for the monitoring of acute decompensated heart failure[J].Am J Emerg Med,2008,26(2):585-591.
[12] Lichtenstein D,Meziere G,Lagoueyte JF,et al.A-lines and B-lines:lung ultrasound as a bedside tool for predicting pulmonary artery occlusion pressure in the critically ill[J].Chest,2009,136(4):1014-1020.
[13] Lichtenstein D,Lascols N,Meziere G,et al.Ultrasound diagnosis of alveolar consolidation in the critically ill[J].Intensive Care Med,2004,30(2):276-281.
[14] Blaivas M.Lung ultrasound in evaluation of pneumonia[J].J Ultrasound Med,2012,31(6):823-826.
[15] Lichtenstein D,Meziere G,Seitz J,et al.The dynamic air bronchogram:a lung ultrasound sign of alveolar consolidation ruling out atelectasis[J].Chest,2009,135(6):1421-1425.[16] Mathis G,Blank W,Ressig A,et al.Thoracic ultrasound for diagnosing pulmonary embolism :a prospective multicenter study of 352 patients[J].Chest,2005,128(3):1531-1538.[17] Bouhemad B,Liu ZH,Arbelot C,et al.Ultrasound assessment of antibiotic-induced pulmonary reaeration in ventilator-associated pneumonia[J].Crit Care Med,2010,38(1):84-92.
[18] Via G,Lichtenstein D,Mojoli F,et al.Whole lung lavage: a unique model for ultrasound assessment aeration changes[J].Intensive Care Med,2010,36(6):999-1007.
[19] Lichtenstein D,Menu Y.A bedside ultrasound sign ruling out pneumothorax in the critically ill:lung sliding[J].Chest,1995,108(4):1345-1348.
[20] Lichtenstein D,Meziere G,Biderman P,et al.The “lung point”:an ultrasound sign specific to pneumothorax[J].Intensive Care Med,2000,26(10):1434-1440.
[21] Soldati G,Testa A,Sher S,et al.Occult traumatic pneumothorax:diagnostic accuracy of lung ultrasonography in the emergency department[J].Chest,2008,133(1):204-211.
[22] Volpicelli G,Elbarbary M,Blaivas M,et al.International evidence-based recommendations for point-of-care lung ultrasound[J].Intensive Care Med,2012,38(4):577-591.
