原花青素对人骨肉瘤Saos-2细胞增殖的影响及机制研究
2015-08-28李瑞生张文静
李 灿,江 波,李瑞生,张文静
0 引言
骨肉瘤是常见的原发恶性骨肿瘤,好发于儿童和青少年,预后较差。骨肉瘤的发生和发展过程非常复杂,受多种因素的影响[1]。放疗及新辅助化疗的应用,可有效杀伤肿瘤细胞,提高患者的生存率,然而,很多患者在使用高剂量、高强度的化疗药物后,可导致严重不良反应,并产生耐药[2]。因此,寻找不良反应低、骨肉瘤细胞耐药性较低的药物十分必要。
天然药物以其疗效确切、毒性低和不良反应少,受到国内外广泛关注。原花青素(Procyanidins,PC)是由儿茶素、表儿茶素以C4-C8位或C4-C6位C-C键聚合而成,或C2-C7或C2-C5之间以醚键C-O-C结合的多酚类化合物,广泛存在于自然界[3],因其在酸性介质中加热后均可得到花青素(Cyanidins)而得名。研究证明,原花青素对皮肤癌、结肠癌、乳腺癌、宫颈癌、白血病等都有抗肿瘤作用[4-6]。而且原花青素只对肿瘤细胞有细胞毒作用,对正常细胞有促进生长及存活的作用。笔者研究原花青素对人骨肉瘤细胞的细胞毒作用,并从诱导凋亡、凋亡通路及氧化还原系统方面研究其抗肿瘤作用机制。
1 材料与方法
1.1 主要试剂、药物及仪器 人骨肉瘤Saos-2细胞购于中国科学院上海细胞研究所,用含20%小牛血清的RPMI 1640培养液常规培养。原花青素购于天津尖峰天然产物公司,以1640培养液溶解配制成储备原液。MTT和胰蛋白酶(Sigma公司);胎牛血清(杭州四季青生物工程材料公司);RPMI 1640培养粉(Gibco公司);顺铂(江苏豪森药业股份有限公司);Caspase-9、Caspase-12、Survivin酶联免疫检测试剂盒(GDB公司);ELx800型酶联免疫检测仪(BIO-TEK公司);CO2孵箱(JOUAN公司);流式细胞仪FACS Calibur(Becton Dickinson公司);其他试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养 人骨肉瘤Saos-2细胞复苏后,用含体积分数为10%的胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液,制成单细胞悬液,于37℃、5%CO2培养箱内培养。取对数生长期细胞用于本研究。
1.2.2 MTT法检测原花青素对Saos-2增殖的抑制作用 采用常规MTT法检测肿瘤细胞株对药物的敏感性。取对数生长期的Saos-2细胞经胰蛋白酶消化,1640培养基调整细胞浓度为1×105/mL,以 100 μL/孔接种于 96 孔板中,37 ℃、5%CO2条件下培养24 h后随机分组:给药组加入不同浓度的 PC(终浓度分别为 10、20、40、80、160、320 μg/mL),阳性对照组加入顺铂(25 μg/mL),阴性对照组加入1640培养液,每孔100 μL,每组均设6个复孔,培养48 h及72 h,分别于终止培养前4 h加入 MTT 10 μL,继续培养4 h后,加入DMSO 100 μL终止反应,避光振荡使充分溶解,用酶标仪于波长570 nm处测定各孔吸光度值(A)。计算细胞抑制率,公式:(1-药物孔A值/对照孔A值)×100%。
1.2.3 倒置显微镜观察细胞形态 取对数生长期的Saos-2细胞常规消化洗涤后,在5%CO2、饱和湿度37℃培养箱中培养24 h后,用倒置显微镜观察细胞形态。
1.2.4 PI染色法检测原花青素对Saos-2细胞的凋亡率 取对数生长期Saos-2细胞常规消化洗涤后,在5%CO2、饱和湿度37℃培养箱中培养24 h后,分别加入不同浓度的PC(终浓度分别为40、80、160 μg/mL)和阳性对照药顺铂(40 μg/mL)。对照组加入等量培养液,继续培养48 h后收集细胞培养上清液,置-20℃环境待测相关基因蛋白。收集细胞,于1 500 r/min、8 min离心洗涤2遍,用75%预冷乙醇固定细胞,置4℃环境中过夜。检测前预冷PBS溶液洗涤2遍,加PI缓冲液400 μL/管,避光染色30 min,采用流式细胞仪检测细胞凋亡水平,以上实验重复3次。
1.2.5 ELISA 法检测 Caspase-9、Caspase-12、Survivin含量 采用双抗体夹心酶联免疫吸附法(ELISA法)检测凋亡相关基因蛋白。取“1.2.4”项下冻存的细胞培养上清,按照试剂盒说明书建立标准曲线:设标准孔8孔,每孔加入样品稀释液100 μL,第 1 孔加标准品 100 μL,混匀后吸出100 μL移至第2孔。如此反复对倍稀释至第7孔,从第7孔吸出100 μL弃去,第8孔为空白对照。待测样品孔加入培养上清100 μL,将板置37℃反应120 min。用洗涤液将反应板洗涤4~6次,吸水纸拍干。每孔加入第一抗体工作液100 μL,充分混匀后反应60 min。用洗涤液将反应板充分洗涤,加入酶标抗体工作液100 μL,反应60 min,洗板同前。加入底物工作液100 μL后反应5~10 min,最后加入50 μL终止液混匀,于酶联免疫检测仪490 nm处测吸光度,分别绘制标准曲线,计算Caspase-9、Caspase-12和Survivin的含量。
1.2.6 Bradford法检测PC对 Saos-2细胞内SOD、MDA含量的影响 取对数生长期的Saos-2细胞,常规消化洗涤后,向各组细胞沉淀中加入等量裂解液,冰上孵育10 min,离心收集细胞培养上清,采用Bradford法进行蛋白定量,并分别按照SOD和MDA试剂盒说明书进行含量测定。
1.2.7 统计学处理计量资料的描述以±s表示,两独立样本均数的比较采用t检验;多组资料间均数的比较采用单因素方差分析。所有数据应用SPSS 14.0统计软件处理,P<0.05为差异有统计学意义。
2 结果
2.1 PC对Saos-2细胞增殖的抑制作用 PC在培养48、72 h后,均对Saos-2细胞的体外增殖有抑制作用,并具有浓度和时间依赖性,各浓度组与对照组比较差异均有统计学意义(P<0.001),见表1。
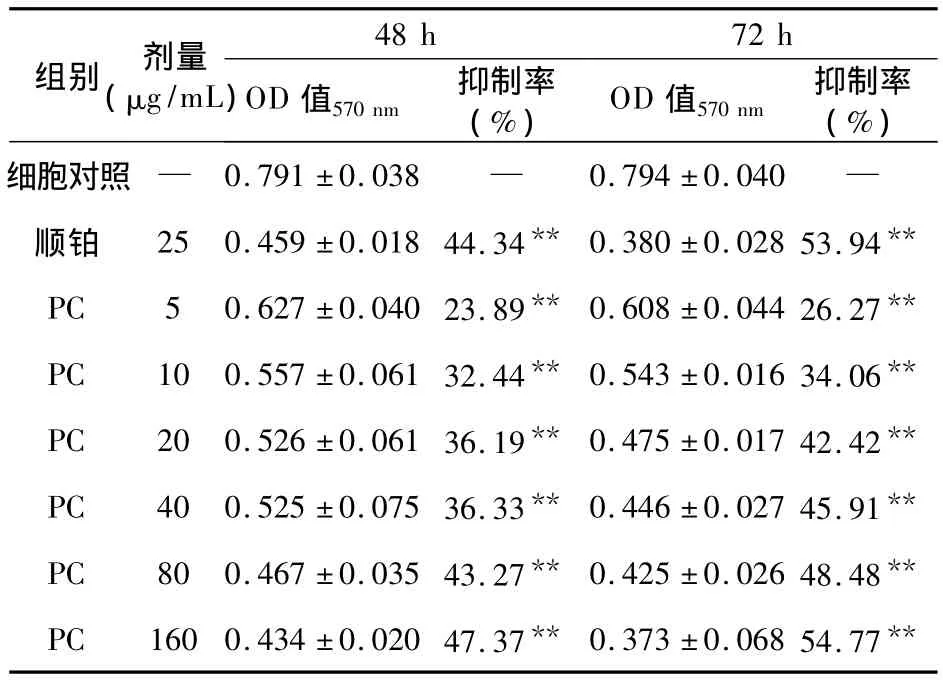
表1 PC对Saos-2细胞生长的抑制作用(n=6)
2.2 对Saos-2细胞生长状况的影响 由图1可见,对照组细胞增殖旺盛,细胞密度高,经PC作用后的Saos-2细胞,其增殖明显受到抑制,细胞排列稀疏,随着药物浓度的增加,细胞密度逐渐减少。

图1 PC对Saos-2细胞生长状况的影响
2.3 PC对Saos-2细胞凋亡的影响 不同浓度的PC均能明显诱导 Saos-2细胞凋亡,40、80、160 μg/mL浓度的PC作用于Saos-2细胞后,细胞凋亡率分别为18.19%、25.15%、30.02%,明显高于对照组,随着剂量的增加,细胞凋亡率增加,见表2。

表2 PC对Saos-2细胞凋亡的影响(n=3)
2.4 PC对 Saos-2细胞 Caspase-9、Caspase-12和Survivin蛋白表达的影响 PC各剂量组Caspase-9和Caspase-12蛋白表达均高于细胞对照组(P<0.05或P<0.01),均以中剂量组的效果最好;各剂量组Survivin蛋白表达明显低于细胞对照组(P<0.01),具有剂量依赖性,见表3。
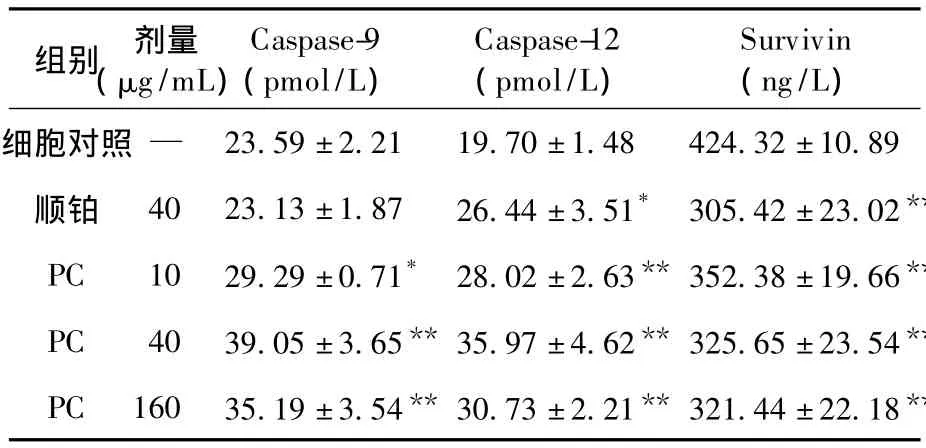
表3 PC对Saos-2细胞Caspase-9、Caspase-12和Survivin蛋白表达的影响
2.5 PC对Saos-2细胞内SOD活性和MDA含量的影响 3个剂量的PC分别作用于Saos-2细胞24 h后,细胞内SOD的活性与细胞对照组相比明显升高(P<0.05),MDA的含量明显降低(P<0.01或 P<0.05);顺铂组降低 SOD含量 P<0.05,见表4。

表4 PC对Saos-2细胞SOD活性和MDA含量的影响
3 讨论
细胞凋亡是调节生物生长发育和自身稳定的重要机制,目前临床上大多数药物都能通过诱导肿瘤细胞凋亡而达到抗肿瘤的目的,因此,肿瘤防治的关键是抑制肿瘤细胞增殖和促进肿瘤细胞凋亡[7-9]。本研究结果显示,通过MTT抗肿瘤实验发现,PC具有较强的体外抗人骨肉瘤Saos-2细胞增殖的作用。对人骨肉瘤Saos-2细胞生长的抑制具有剂量和时间依赖性。
诱导细胞凋亡主要有Caspase依赖途径和非Caspase依赖途径[10]。根据通路中的起始Caspase蛋白不同,细胞凋亡途径又可分为:①死亡受体通路;②内质网介导细胞凋亡;③线粒体介导细胞凋亡。线粒体通路由Bcl-2家族成员在接受到胞内的死亡信号后激活。这些Bcl-2家族成员与另外的Bcl-2家族成员作用,引起线粒体膜通透性改变,释放细胞色素 C(Cytc)和其他蛋白[11-12]。在ATP/dATP存在的情况下,Cytc与凋亡蛋白酶活化因子(Apaf-1)形成多聚复合体,通过Apaf-1氨基端的Caspase募集结构域(CARD)募集胞质中的Caspase-9前体,并使其自我剪切活化并启动Caspase级联反应,引起细胞凋亡[13]。内质网是细胞内合成蛋白质的主要场所,同时也是Ca2+的主要储存库。Caspase-12位于内质网膜,内质网钙离子平衡的破坏或内质网蛋白的过量积累都会诱导其表达,同时也导致胞质的Caspase-7转移到内质网表面。Caspase-7激活 Caspase-12,激活的Caspase-12可进一步剪切Caspase-3而引发细胞凋亡[14]。死亡受体通路中胞外的死亡信号可通过死亡受体转入胞内。死亡配体与死亡受体激活Caspase-8,降低线粒体内膜电位,导致Cytc的释放[15],后者可与 Apaf-1结合,在 dATP的存在下活化Caspase-9,后者能激活下游效应Caspase,引起细胞凋亡。Survivin是凋亡抑制蛋白,可抑制细胞凋亡,促进肿瘤的增殖和生长,可通过与Caspase-9结合而抑制Caspase系统诱导的细胞凋亡,Survivin下调Survivin基因表达水平可以降低肿瘤细胞凋亡的阈值,并且其表达与肿瘤细胞的耐药性有关,其表达下调可增加肿瘤细胞对化疗药物的敏感性[16-18]。3条凋亡通路最后都有Caspase的激活,从而引起细胞结构和保护成分的蛋白水解,发生细胞凋亡,说明Caspase是诸多调控通路的关键。
本研究显示,PC在诱导Saos-2细胞凋亡的同时,基因蛋白Caspase-9和Caspase-12表达显著增加,Survivin蛋白表达显著减少,提示该细胞凋亡诱导途径与Caspase有关,可能与死亡受体通路、内质网介导细胞凋亡、线粒体介导细胞凋亡这3条通路皆有关系。
MDA是脂质过氧化反应链式终止阶段产生的小分子产物,脂质过氧化物(LOOH)形成的环状过氧化物可断裂形成烯醛、丙二醛,其含量间接反映自由基的产生情况和机体组织细胞的脂质过氧化程度。脂质过氧化越活跃,生成的MDA越多。SOD是一种重要的抗氧化酶,能清除超氧阴离子自由基而保护细胞和基质免受氧自由基的损伤,是机体抗氧化损伤防御体系中的第一道防线。本研究检测了细胞培养上清中SOD和MDA的含量,结果表明,3个剂量的PC均能降低Saos-2细胞内MDA的含量,升高SOD的含量。提示PC的抗肿瘤作用机制可能与清除自由基有一定关系。
综上所述,PC可抑制Saos-2细胞的增殖,这可能与其增加细胞内SOD含量,降低MDA含量,从而增加机体的抗氧化功能有关;另外,PC可影响Caspase-9、Caspase-12和 Survivin的表达,还提示其可能通过启动死亡受体通路、内质网通路、线粒体通路这三条途径诱导细胞凋亡,具体机制尚需进一步研究。
:
[1]Zhang Y,Yang Z,Li X,et al.Custom prosthetic reconstruction for Proximal tibial osteosarcoma with proximal tibiofibular joint involved[J].Surg Oncol,2008,17(2):87-95.
[2]Hattinger CM,Pasello M,Ferrari S,et al.Emerging drugs for high-grade osteosarcoma[J].Expert Opin Emerg Drugs,2010,15(4):615-634.
[3]高羽,董志,徐露.原花青素对实验性脑出血大鼠脑组织细胞凋亡及凋亡相关蛋白表达的影响[J].中国药理学通报,2010,26(7):969-973.
[4]谢朝阳,吴斌华,杨志刚,等.原花青素诱导HL-60细胞分化及其机制的研究[J].中国实验血液学杂志,2013,21(4):920-925.
[5]潘晓婧,王敏,刘斌,等.葡萄籽原花青素对人宫颈癌细胞的辐射增敏作用[J].中国药理与临床,2012,28(4):40-43.
[6]薛瑞,王明仲,洪学军,等.原花青素通过Caspase途径诱导乳腺癌MCF-7细胞凋亡[J].实用药物与临床,2012,16(1):15-17.
[7]张倩雯,张媛媛,晁振华,等.羟氯喹对人乳腺癌MDA-MB-435细胞增殖及凋亡的影响[J].中国药理学通报,2013,29(11):1549-1552.
[8]刘冰,阳洁.辛伐他汀对人非小细胞肺癌A549细胞凋亡及caspase-9、caspase-3活性的影响[J].广西医科大学学报,2013,30(4):503-506.
[9]方大钊,王伟杰,董楠,等.STAT3反义核苷酸对脑胶质瘤U87细脑增殖、凋亡的影响及其作用机制[J].实用医学杂志,2013,29(23):3840-3843.
[10]Vaidya S,Velázquez-Delgado EM,Abbruzzese G,et al.Substrate-induced conformational changes occur in all cleaved forms of caspase-6 [J].J Mol Biol,2011,406(1):75-91.
[11]Liu D,Peng YA,Liu ZQ,et al.Bcl-2/Bad/m PTP pathway mediates 14-3-3r protecting against LPS-induced myocardial injury[J].Chin Pharmacol Bull,2013,29(1):48-52.
[12]吴畏,于彩平,李卓恒,等.金丝桃苷对高糖、氧化下内皮细胞凋亡及细胞色素C、Caspase-9和Caspase-3表达的影响[J].中国医院药学杂志,2013,33(18):1483-1486.
[13]高梓越,刘小腊,李沐,等.小刺猴头液体深层发酵浸膏多糖诱导SMMC-7721细胞凋亡的机制[J].吉林农业大学学报,2013,35(5):530-534.
[14]Denauh JB,Eckelman BP,Shin H,et al.Caspase-3 at tenuatesXIAP(X-linked inhibitor of apoptosis protein)-mediated inhibition of caspase-9[J].Biochem J,2007,405(1):11-19.
[15]Ranaldi R,Palma S,Tanzarella C,et al.Effect of p53 haploinsufficiency on melphalan-induced genotoxic effects in mouse bone marrow and peripheral blood [J].Mutation Research,2007,615:57-65.
[16]管小倩,颜丽萍,田小林,等.术中植入氟尿嘧啶植入剂对结直肠癌患者外周血Survivin、CD44V6的影响[J].安徽医科大学学报,2014,49(1):85-87.
[17]彭冬先,何援利,丘立文.靶向shRNA抑制survivin基因对子宫内膜异位症裸鼠模型异位内膜caspase-3表达的影响[J].实用医学杂志,2014,30(2):210-212.
[18]何小婷,李娟,柴晓静,等.Survivin基因在急性白血病患者中的表达及其临床意义[J].现代肿瘤医学,2014,22(2):408-412.
