蕨麻正丁醇部位下调缺氧内皮细胞HIF-1α及ET-1表达*
2015-08-26龚海英张永亮李灵芝高宏生天津医科大学天津00070武警后勤学院药物化学教研室天津0009天津市职业与环境危害防制重点实验室天津0009
杨 硕,张 岭,龚海英,张永亮,李灵芝,,高宏生(1.天津医科大学,天津00070;.武警后勤学院药物化学教研室,天津0009;.天津市职业与环境危害防制重点实验室,天津0009)
·中药研究·
蕨麻正丁醇部位下调缺氧内皮细胞HIF-1α及ET-1表达*
杨硕1,2,张岭2,龚海英2,张永亮3,李灵芝2,3,高宏生3
(1.天津医科大学,天津300070;2.武警后勤学院药物化学教研室,天津300309;3.天津市职业与环境危害防制重点实验室,天津300309)
[目的]探讨蕨麻正丁醇部位对内皮细胞缺氧损伤的保护机制。[方法]采用人脐静脉内皮细胞(EA.hy926)建立缺氧损伤实验模型,实验设常氧对照组、缺氧模型组、高(3.00 g/L)、中(1.50 g/L)、低浓度(0.75 g/L)蕨麻正丁醇部位组,复方丹参(3.0 g/L)组。胎盘兰染色法测定各组细胞存活率;逆转录-聚合酶链反应(RT-PCR)技术检测各组缺氧诱导因子-1α(HIF-1α)mRNA和内皮素-1(ET-1)mRNA表达,免疫细胞化学染色及Western Blot方法检测HIF-1α蛋白表达。放免法测定培养基中ET-1的活性。[结果]与对照组比较,缺氧模型组细胞存活率显著降低,HIF-1α和ET-1 mRNA及蛋白表达增加(P<0.01);蕨麻正丁醇部位各剂量组与缺氧模型组比较,细胞存活率显著升高,高、中、低剂量蕨麻正丁醇部位组、复方丹参组细胞HIF-1α和ET-1 mRNA及蛋白水平显著降低(P<0.01)。[结论]在缺氧状态下,蕨麻正丁醇部位可能通过HIF-1α途径调控靶基因的表达,从而发挥保护作用。
蕨麻;内皮细胞;缺氧;缺氧诱导因子-1α;内皮素-1
DOI:10.11656/j.issn.1672-1519.2015.03.10
血管内皮细胞既是感应细胞,又是效应细胞,它能感知血液中的炎性信号、激素水平、压力变化等信息,并能通过分泌血管活性物质作出应对。内皮细胞的损伤及功能紊乱与高血压、冠心病、慢性肾功能衰竭等多种疾病密切相关。因此,如何保护和修复内皮细胞功能对改善血管疾病具有积极意义。
藏药蕨麻具有显著的抗缺氧[1]、抗氧化[1-2]及抗疲劳作用[3]。课题组前期研究证实蕨麻正丁醇部位是其抗缺氧主要活性部位,可通过抗氧化、抑制钙超载、抗凋亡等途径,对心肌细胞缺氧损伤[4-5]、神经细胞缺氧损伤[6-7]、小鼠急性心肌缺血损伤[8-9]等发挥保护作用,研究还显示蕨麻正丁醇部位内皮细胞缺氧损伤也具有显著的保护作用[10-11],但对其抗内皮细胞缺氧的机制尚未进行深入研究。本实验进一步采用EA.hy926内皮细胞缺氧模型,研究了蕨麻正丁醇部位对缺氧内皮细胞缺氧诱导因子-1(HIF-1)α亚型及其靶基因内皮素-1(ET-1)mRNA及蛋白表达的影响,探讨其对内皮细胞缺氧损伤的保护机制。
1 材料与方法
1.1实验材料
1.1.1药品与试剂蕨麻用75%乙醇提取浓缩得浸膏,依次以石油醚、氯仿、乙酸乙酯、正丁醇萃取,正丁醇萃取液减压浓缩并冷冻干燥后得正丁醇部位(每克相当于蕨麻生药59 g)。阳性对照药取复方丹参滴丸按照《中国药典》(2005版)方法制备。高糖DMEM培养基(Gibco),无糖DMEM培养基(Sigma),青霉素、链霉素(Amresco),胰蛋白酶(Difco),噻唑兰(北京鼎国生物技术开发中心)。ET-1试剂盒(北京普尔伟业生物科技有限公司),ET-1引物由上海生工生物技术有限公司合成,浓缩型HIF-1α多克隆抗体(Santa Cruz);HIF-1α及β-actin引物由Invitrogen公司合成。
1.1.2实验设备二氧化碳(CO2)培养箱(forma3111,美国),酶标仪(680 BIORAD,美国),倒置相差显微镜(Olympus CK-40,日本),显微镜(Olympus CH-2)、PCR仪(PT-0200,美国)、核酸定量仪(德国)、凝胶成像分析系统(GelPro 4.5,美国)、电泳仪(Bio-Rad,美国)、电转膜仪(Bio-Rad,美国)。
1.2方法
1.2.1分组及内皮细胞缺氧损伤模型建立将EA. hy926内皮细胞随机分为常氧对照组(C组);缺氧损伤模型组(M组);蕨麻正丁醇部位高剂量组(H组,3 g/L)、中剂量组(I组,1.5 g/L)、低剂量组(L组,0.75 g/L);复方丹参组(P组,3 g/L)。正丁醇部位及复方丹参滴丸均以少量二甲基亚砜(DMSO)(控制培养基中DMSO终浓度低于0.25%)溶解后加无糖DMEM培养基稀释至所需浓度,C组和M组均加含有等浓度DMSO的无糖DMEM培养基。除C组外,其他各组均于37℃下在无糖DMEM培养基中95%氮气(N2)+5%CO2[氧气(O2)浓度<1%]环境下培养2 h,C组于5%CO2条件下37℃同步培养于无糖DMEM培养基中。每组8个复孔,重复2次。
1.2.2台盼蓝染色观察细胞存活率各实验组细胞加入1 mL 0.04%的台盼蓝溶液,光镜下计数拒染细胞,按下式计算细胞存活率并进行统计学分析。
细胞存活率=据染细胞数/细胞总数×100%
1.2.3RT-PCR法检测细胞HIF-1α mRNA和ET-1 mRNA水平引物设计:根据Genbank中大鼠HIF-1α、ET-1基因序列设计引物。
HIF-1α上游:5′-TCAAAGTCGGACAGCCTCA-3′,下游:5′-CCCTGCAGTAG GTTTCTGCT-3′,扩增产物长度为458 bp。
ET-1上游:5′-TTCTCTCTGCTGTTTGTGG-3′,下游:5′-CAATGTGCTCGGTT GTG-3′,扩增产物长度为614 bp。
β-actin上游:5′-GTGGGGCGCCCCAGGCACCA -3′,下游:5′-CTTCCTTAATGT CACGCACGATTTC -3′,扩增产物长度为547 bp。
RT-PCR反应:用Trizol试剂提取总RNA,取1μL 总RNA,按逆转录试剂盒说明合成cDNA第1条链,取5 μL逆转录产物进行PCR。
HIF-1α反应条件:94℃预变性2min,94℃30s、62℃30 s、72℃30 s,循环30次,72℃延伸5 min。
ET-1反应条件:94℃预变性2 min,94℃45 s、62℃45 s、72℃30 s,循环28次,72℃延伸5 min。
PCR反应产物检测:用凝胶成像分析系统测出各扩增条带的光密度值(A),以同一样品HIF-1α或ET-1扩增带的光密度(Af)与β-actin扩增带的光密度(Ab)比值进行统计分析,得到其RT-PCR产物的相对含量。
1.2.4免疫细胞化学法检测内皮细胞HIF-1α蛋白内皮细胞以丙酮固定,3%双氧水(H2O2)阻断内源性过氧化物酶,血清封闭,加1∶200稀释的HIF-1α一抗4℃过夜,加生物素化二抗37℃15 min,加SP复合物,37℃30 min,二氨基联苯胺(DAB)显色。阳性反应为胞核或胞浆染成棕黄色。阴性对照以磷酸盐缓冲溶液(PBS)代替一抗,其余步骤相同。
1.2.5Western blot方法检测内皮细胞HIF-1α蛋白提取总蛋白,考马斯亮蓝法定量蛋白质,进行SDS-PAGE凝胶电泳后转印至PVDF膜,5%BSA室温封阻1h;加入一抗(1∶1000)4℃过夜,二抗37℃1 h,SP复合物室温1 h,DAB显色。以同一样品HIF-1α条带的光密度与β-actin的光密度比值为相对蛋白含量。
1.2.6放免法检测ET-1活性实验操作按试剂盒进行。
1.2.7统计学处理所有数据用SPSS 18.0软件处理。计量资料以均数±标准差表示,组间比较采用单因素方差分析,组间两两比较时,若方差采用LSD法,若方差不齐则采用Dunnett’s T3法,P<0.05表示差异有统计学意义。
2 结果
2.1台盼蓝染色结果常氧对照组细胞未被台盼蓝染色;缺氧模型组可见大片蓝染细胞,细胞连接断开并成片状脱壁;H组坏死细胞明显减少,仅见散在蓝染细胞,未见细胞脱壁现象;I组蓝染细胞散在,与模型组相比,数量明显减少,但蓝染细胞数量比H组稍有增高;L组蓝染细胞数量比模型组减少;复方丹参组可见散在蓝染细胞,数量与I组差异无统计学意义。见表1。
表1 蕨麻正丁醇部位对缺氧损伤内皮细胞存活率的影响Tab.1 The effect of N-butanol extract of Potentilla anserina L.onsurvivalof endothelialcellsexposedtohypoxia
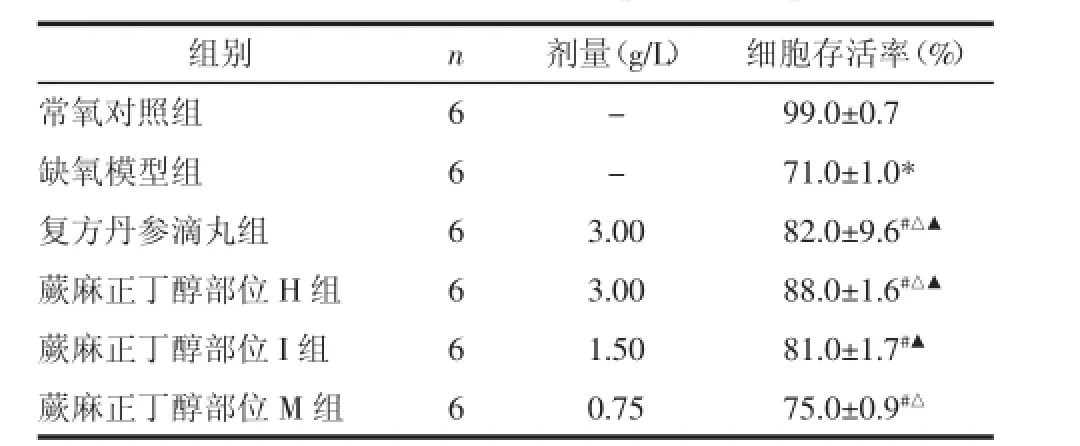
表1 蕨麻正丁醇部位对缺氧损伤内皮细胞存活率的影响Tab.1 The effect of N-butanol extract of Potentilla anserina L.onsurvivalof endothelialcellsexposedtohypoxia
注:与常氧对照组比较,*P<0.01;与缺氧模型组比较,#P<0.01;与蕨麻正丁醇部位I组比较,△P<0.01;与蕨麻正丁醇部位M组比较,▲P<0.01。
组别细胞存活率(%)常氧对照组99.0±0.7缺氧模型组71.0±1.0*复方丹参滴丸组82.0±9.6#△▲蕨麻正丁醇部位H组88.0±1.6#△▲蕨麻正丁醇部位I组81.0±1.7#▲蕨麻正丁醇部位M组75.0±0.9#△n666666剂量(g/L)--3.00 3.00 1.50 0.75
2.2RT-PCR检测结果常氧对照组细胞未见HIF-1α表达,与常氧对照组相比,缺氧模型组细胞HIF-1α mRNA表达水平显著升高(P<0.01)。H、I、L组及复方丹参组细胞HIF-1α mRNA水平与缺氧模型组比较均显著降低(P<0.01)。见图1。
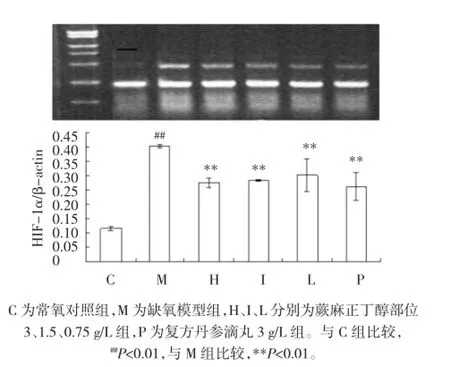
图1 各组内皮细胞HIF-1α mRNA表达水平Fig.1 The expression of HIF-1α mRNA in endothelial cells of each group
缺氧模型组ET-1mRNA表达水平较常氧对照组显著升高(P<0.01)。H、I组及复方丹参组细胞ET-1 mRNA表达水平均较缺氧模型组降低(P<0.01),L组无统计学意义(P>0.05)。见图2。
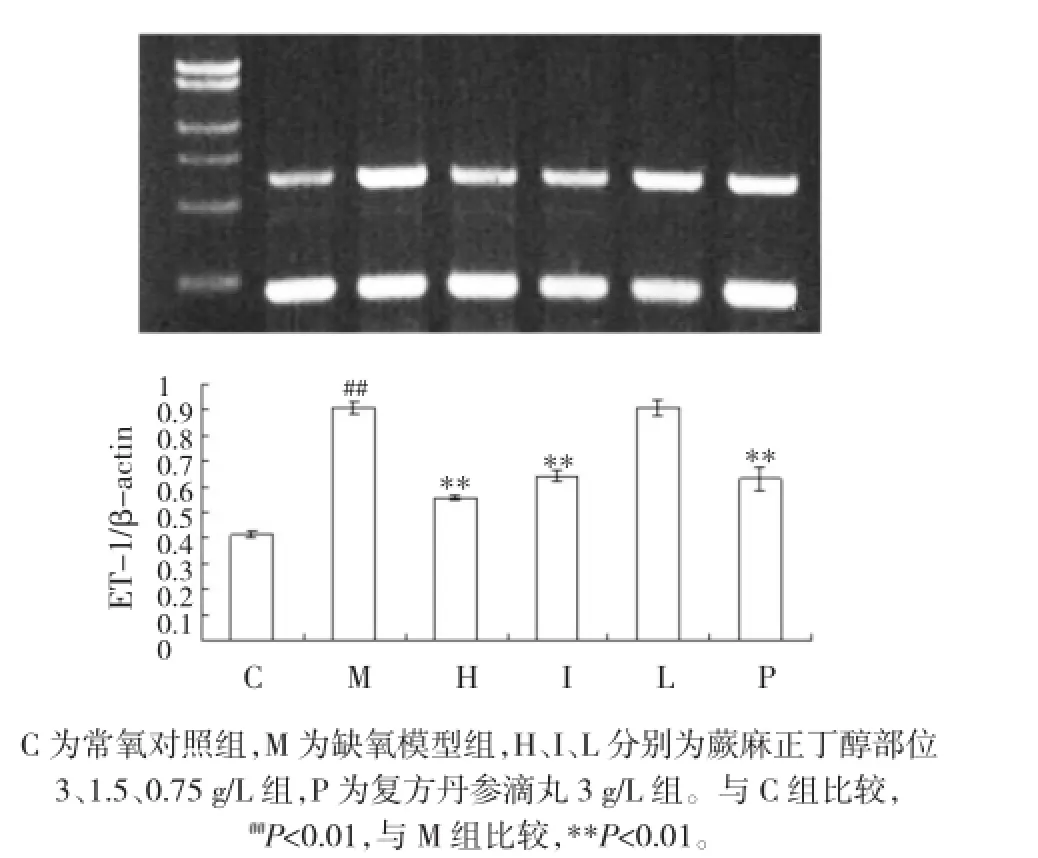
图2 各组内皮细胞ET-1 mRNA表达水平Fig.2 The expression of ET-1 mRNA in endothelial cells of each group
2.3免疫细胞化学检测结果对照组胞浆偶见HIF-1α蛋白免疫反应阳性物质,为棕黄色颗粒。缺氧模型组较对照组细胞HIF-1α蛋白水平升高,胞浆免疫反应阳性物质增多,胞核也出现表达。与缺氧模型组比较,H、I及复方丹参组细胞HIF-1α蛋白免疫反应阳性物质减少,且大部分在胞浆表达。见图3。
2.4Western blot检测结果常氧对照组细胞未检测到HIF-1α蛋白,缺氧模型组HIF-1α水平较常
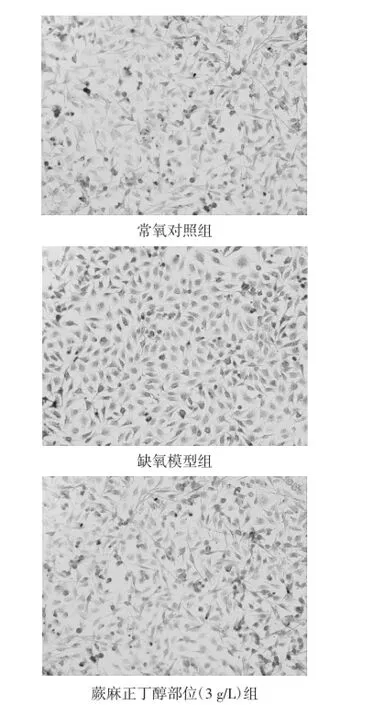
图3 各组内皮细胞HIF-1α蛋白水平(×200)Fig.3 The level of HIF-1α protein in endothelial cells of each group
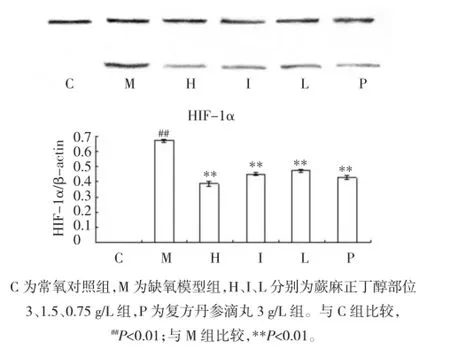
图4 各组内皮细胞HIF-1α蛋白表达水平Fig.4The level of HIF-1α protein in endothelial cells of each group
氧对照组升高(P<0.01)。与缺氧模型组比较,H、I、L 组HIF-1α水平降低(P<0.01)。见图4。2.5放免法测定结果与常氧对照组比较,缺氧损伤模型组细胞ET-1水平升高(P<0.01);而蕨麻正丁醇部位各剂量组、复方丹参组与缺氧模型组相比ET-1水平均降低(P<0.01)。见图5。
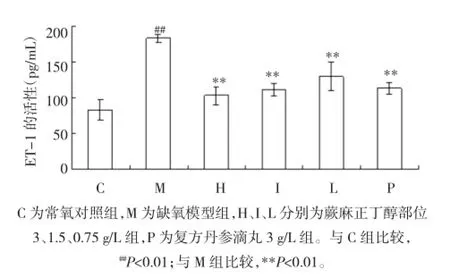
图5 各组内皮细胞ET-1活性Fig.5The activity of ET-1 in endothelial cells of each group
3 讨论
细胞缺氧合并培养介质缺糖是目前公认的造成体外缺血缺氧的模型。本实验室以无糖DMEM培养基结合95%N2+5%CO2的缺氧缺糖环境模拟体内内皮细胞缺血缺氧,台盼蓝染色结果显示,缺氧2 h细胞大量被蓝染,细胞存活率降低28%,表明已经有效地造成了细胞的缺氧损伤。蕨麻正丁醇部位干预后,可显著减少蓝染细胞数,提高缺氧状态下细胞存活率,表明蕨麻正丁醇部位对内皮细胞缺氧损伤具有保护作用。复方丹参滴丸是临床广泛用于治疗心血管疾病的药物[12],在本模型中也能够显著提高缺氧内皮细胞的存活率。
缺氧可激活多种转录因子,从而介导缺氧相关基因表达变化,是诸多疾病的病理生理过程。HIF-1广泛表达于哺乳动物的各种组织细胞,是介导哺乳动物细胞低氧反应的核转录因子,能够促进组织细胞对低氧的适应性。HIF-1是由α和β亚基组成的异二聚体,其中HIF-1α受缺氧调控并调节HIF-1的活性,β亚基则属结构型表达[13]。常氧条件下,HIF-1α可被脯氨酰-4-羟化酶羟基化,随即被泛素-蛋白酶体通路迅速降解,故常氧时,人、小鼠、大鼠体内许多组织中均可检测到HIF-1αmRNA、HIF-1βmRNA和HIF-1β蛋白,但一般检测不到HIF-1α蛋白[14]。在缺氧等条件下HIF-1α和HIF-1β均能通过核转位由胞质进入胞核,形成稳定的异二聚体,活化的HIF-1在其靶基因的转录起始部位形成一个转录起始复合物,从而启动对靶基因的转录[15]。本研究在常氧对照组检测到了HIF-1α mRNA,但仅在胞浆检测到极微量HIF-1α蛋白,与文献报道相吻合。但缺氧模型组HIF-1αmRNA水平升高,且在胞浆和胞核均检测到了HIF-1α蛋白,表明缺氧促进了HIF-1α基因的表达和核转位,同时抑制了HIF-1α蛋白的降解,导致蛋白积聚并发挥调控作用。不同浓度的蕨麻正丁醇部位干预后,HIF-1 αmRNA表达水平较模型组明显降低,HIF-1α蛋白表达水平也降低,提示蕨麻正丁醇部位对内皮细胞缺氧损伤的保护作用与其对HIF-1α表达的调控有关。
ET-1主要由血管内皮细胞分泌,在血管内皮细胞损伤时可大量分泌,因此ET-1是目前测定血管内皮细胞损伤的重要手段之一。ET-1是HIF-1下游基因,其表达可由HIF-1直接激活[16-17]。文献报道丹参酮ⅡA可在肿瘤坏死因子诱导的人脐静脉内皮细胞EVC304损伤模型中降低ET-1水平[18],本研究结果显示:缺氧损伤模型组ET-1水平显著升高,而复方丹参组和蕨麻正丁醇部位干预组ET-1水平则显著下调,与HIF-1α的变化一致,提示蕨麻正丁醇部位可能通过HIF-1α途径调节靶基因的表达,从而在缺氧时对内皮细胞发挥保护作用。
[1]张盈,李灵芝,杨虎,等.蕨麻对低压缺氧大鼠脑组织脑红蛋白的影响[J].天津中医药,2013,30(4):224-227.
[2]李灵芝,张丽,龚海英,等.蕨麻醇提物抗缺氧及抗氧化机制研究[J].中国食品卫生杂志,2005,17(4):306-309.
[3]回晶,尚德静,李庆伟.西藏人参果对小鼠抗疲劳及抗缺氧能力的影响[J].营养学报,2003,25(2):250-252.
[4]王舒,韦薇,李灵芝,等.蕨麻正丁醇部位对缺氧损伤心肌细胞的保护作用[J].天津中医药,2009,26(3):1573-1575.
[5]Li LZ,Wang LJ,Wang Y,et al.Effect of n-butanol Extraction of Potentilla anserina L.intervention on hypoxia-induced calcium overload and SERCA2 expression of rat[J].Chinese Herbal Medicines,2012,4(2):142-149.
[6]Qin XJ,Li LZ,Lv Q,et al.Neuroprotection of n-butanol extract from roots of Potentilla anserina L.on hypoxic injury in primary hippocampal neurons[J].Chinese Herbal Medicines,2012,4(3):195-200.
[7]Qin XJ,Li LZ,Lv Q,et al.Underlying mechanism of protection from hypoxic injury seen with n-butanol extract of Potentilla anserine L. in hippocampal neurons[J].Neural Regeneration Research,2012,7 (33):2576-2582.
[8]龚海英,张岭,李灵芝,等.蕨麻正丁醇部位对EAHY926内皮细胞缺氧损伤的保护作用[J].武警后勤学院学报(医学版),2012,21(6):401-404.
[9]Liu DL,Wang S,Zhang L,et al.Chemical composition of n-butanolextract of Potentilla anserine L.and its protective effect of EAhy926 endothelial cells under hypoxia[J].African Journal of Pharmacy and Pharmacology,2012,6(10):677-684.
[10]李建宇,李怡,龚海英,等.蕨麻正丁醇提取部位对小鼠急性缺血损伤的保护作用[J].中西医结合学报,2009,7(1):48-52.
[11]李建宇,李怡,龚海英,等.蕨麻正丁醇提取部位对小鼠急性缺血心肌caspase-93 mRNA表达的影响[J].中国中西医结合急救杂志,2009,6(3):18-21.
[12]王怡,高秀梅,张伯礼.复方丹参滴丸治疗心血管疾病药理与临床研究[J].天津中医药大学学报,2002,21(3):53-54.
[13]张崇高,曹茄柽.细胞对缺氧的感知及其生物学意义[J].江苏大学学报,2006,16(1):82-87.
[14]Christophe R,Lachuer J,Crouzoulon G,et al.Effects of gestational hypoxia on mRANA levels of Glut3,and Glut4 transporters,hypoxia inducible factor l and thyoroi hormone receptors in developing ret brain[J].Brain Res,2000,856(52):119-128.
[15]Kaufman B,Scharf O,Arbeit J,et al.Proceedings of the oxygen homeostasis/hypoxia meeting[J].Cancer Res,2004,64(5):3350-3356.
[16]邢英琦,徐静,李琳,等.缺氧诱导因子(HIF-1)的结构、调节与靶基因研究进展[J].中国实验诊断学,2011,15(1):177-179.
[17]Hu J,Discher DJ,Bishopric NH,et al.Hypoxia regulates expression of endothelin-1 gene through a proximal hypoxia inducible factor-1 binding site on the antisense strand[J].Biochem Res Commun,1998,245(3):894-899.
[18]范英昌,金树梅,赵桂峰.丹参酮Ⅱ对EVC304细胞血管舒缩因子的影响[J].天津中医药大学学报,2006,25(4):215-218.
(本文编辑:高杉,马晓辉)
Study of N-butanol extract of Potentilla anserina L.in down-regulating expression levels of HIF-1α and ET-1 in hypoxia endothelial cells
YANG Shuo1,2,ZHANG Ling2,GONG Hai-ying2,ZHANG Yong-liang3,LI Ling-zhi2,3,GAO Hong-sheng3
(1.Tianjin Medical University,Tianjin 300070,China;2.Logistics University of Chinese People’s Armed Police Forces,Tianjin 300309,China;3.Tianjin Key Laboratory for Prevention and Control of Occupational and Environmental Hazards,Tianjin 300309,China)
[Objective]To study the protective effect of n-butanol extract of Potentilla anserine L.on EA.hy926 endothelial cells exposed to hypoxia.[Methods]The model of hypoxia injury was established with human umbilical vein endothelial cell line(EA.hy926).The cell death was determined by Trypan blue staining assay.The expression levels of HIF-1α and ET-1 mRNA were detected by reverse transcription-PCR assay.The Western blot and imuunocytochemistry were used for determining HIF-1α protein.The ET-1 protein was detected with radioimmunoassay.[Results]Compared with control group,the survival rate of cell was significantly increased after pretreated with 3,1.5 and 0.75 g/L of n-butanol extract of Potentilla anserine L.Meanwhile,the mRNAs of HIF-1 and ET-1 and their protein products were significantly decreased.[Conclusion]Potentilla anserina L.could exert its protective effect on endothelial cells during hypoxia injury by modulating expression of target genes through HIF-1α pathway.
Potentilla anserina L.;endothelial cell;hypoxia;hypoxia inducible factor-1;endothelin-1
R285.5
A
1672-1519(2015)03-0168-05
国家自然科学基金项目(81073152);天津市重点基金项目(12JCZDJC34700);中国博士后基金项目(20100470106)。
杨硕(1986-),男,2011级硕士研究生,主要从事抗缺氧药物研究。
李灵芝,E-mail:13682196000@163.com;张永亮,E-mail:zhang78127@tom.com。
(2014-09-24)
