纳米氧化亚铜的形貌控制合成及光催化降解有机染料的 研究进展
2015-07-25宫慧勇蒋晶晶刘韶泽郭永李作鹏
宫慧勇,蒋晶晶,刘韶泽,郭永,李作鹏
(1 山西大同大学应用化学研究所,山西 大同 037009;2 中国黄金集团阳山金矿有限公司, 甘肃 陇南 746400)
最近几年,如何控制环境污染和高效地利用太阳能引起了人们广泛的兴趣。Cu2O 是一种p 型半导体,其禁带宽度介于2~2.2eV[1],可吸收大部分可见光[2](小于600nm),理论光电转化效率达18%[3],而且材料来源丰富、无毒、有特殊的光电性能,这使其成为一种极具潜力的光催化材料。到目前为止,纳米Cu2O 因具有传感、催化、活性表面等特性得到了广泛应用。已经证明氧化亚铜纳米材料可用于传感器[4]、CO 氧化[5]、光催化作用[6]、 光化学法分解水制H2[7]、光电流的产生[8]、有机合成[9]以及制造太阳能电池[10]。纳米Cu2O 材料相对容易生产、使用安全、制备成本低,使得纳米Cu2O 材料在催化和光电应用方面成为一种重要的金属化合物。
目前国内外主要致力于纳米材料的尺寸、结构、形貌、组成等方向的研究。不同形貌的Cu2O 具有不同的物理化学性质,而这些特性决定了它的应用前景。因此,各种形貌结构的Cu2O 纳米材料受到了广泛的研究。
虽然Kuo 等[11]详细总结了2010 年以前Cu2O形貌控制合成及其应用,而近年来人们在该领域又取得了许多重要研究进展,本文从形貌控制合成的角度论述了具有良好形貌的氧化亚铜纳米材料及其最新研究进展,并着重概述了一维纳米材料的合成研究。比较了不同晶型Cu2O 光催化降解有机污染物性能的差异,指出开发合成具有更多高活性{110}晶面或具有高指数晶面的Cu2O 是催化剂应用的关键。最后,总结了形貌控制合成Cu2O 及其在光催化应用方面存在的问题,并对未来的趋势进行了展望。
1 不同形态Cu2O 纳米晶体的合成
1.1 立方Cu2O 纳米晶体的合成
目前对纳米Cu2O 立方晶型的合成已经有了很多的研究。Murphy 等[12]在表面活性剂十六烷基三甲基溴化铵(CTAB)的存在下,利用抗坏血酸钠将生成的Cu(OH)2沉淀在水浴55℃温和条件下还原,通过控制表面活性剂的浓度在0.01~0.1mol/L之间,得到粒径不同、大小均一的纳米Cu2O 立方晶体。Kim 等[13]设计了另一种方案,他们将乙二醇加热到140℃后向其中加入NaCl、Cu(NO3)2和聚乙烯基吡咯烷酮(PVP),合成了平均棱长为410nm的纳米立方晶体。在该合成过程中,氯离子促进了纳米立方晶体的形成,若不添加氯离子,则会组装成多晶纳米球。此外,尺度可控纳米材料的合成是当前研究的一大热点。Huang 等[14]使用种晶促进合成法,通过向前体中添加粒径较小的Cu2O 纳米晶依次合成了平均尺度分别为40nm、65nm、100nm、230nm 和420nm 的立方晶体(合成过程及形貌如图1),且合成的粒径很均一,每种粒子尺寸的标准偏差均低于10%,但产率并不高,其中前体十二烷基磺酸钠(SDS)和SO42-对形成纳米立方晶起关键作用,而SDS 的浓度对Cu2O 的形态基本无影响。形成对比的是,Lee 研究团队[15]通过简单的原位成核调控合成了不同尺度均一的立方Cu2O,合成产率较高。首先在Cu2+溶液里加入不同浓度的柠檬酸盐以形成部分配合物,然后加入NaOH 获得Cu(OH)2沉淀,最后加入等量的还原剂。因为不同的溶液初始Cu(OH)2沉淀的量不同,还原形成Cu2O 晶种的数量就不相等,随着还原过程的进行,配合物不断分解释放出Cu2+并被还原,晶种获得了不同程度的生长,最终形成可控粒径大小的立方Cu2O。最新的一项研究中,Xu 等[6]在无添加剂的情况下,通过简单调控NaOH 溶液的浓度合成20~500nm 不同粒径的立方Cu2O,通过加入不同浓度的NaOH 溶液改变了溶液的pH 值,从而导致成核以及晶体的生长速率不同[16]。此外,Prasad 研究小组[17]在相同前体、微波衍射、简单调节溶液酸碱度的情况下,在pH=4 的条件下合成了立方Cu2O,于pH>12 的条件下合成了CuO。在一定范围调节pH 值可合成不同粒径的Cu2O,但制备晶体的表面并不光滑。

图1 种晶促进合成法合成大小不同的Cu2O 纳米立方晶体的过程及SEM 图[14]
1.2 八面体Cu2O 纳米晶的合成
研究表明,在微观尺度上调控晶面的生长速率可以合成不同的晶型。Wang 等[18]将CuCl2溶液、NH3水溶液、NaOH 溶液混合后得到蓝色的Cu(OH)2沉淀,然后向其中加入NH2OH·HCl,得到了八面体Cu2O 纳米晶。在反应过程中,NH3和Cu2+的摩尔比对形成的纳米粒子的形态起关键作用,在NH3浓度较高时,晶面生长速率不同,可形成纳米晶;在NH3浓度较低时,晶面生长为各向同性,则形成纳米球。将NH3和Cu2+比例控制在7∶1,并将NaOH和CuCl2摩尔比分别控制在2∶1、4∶1、8∶1 时,合成的八面体晶体大小分别为140nm、400nm、600nm。图2 为八面体Cu2O 纳米晶体SEM 图,晶体的大小在360~420nm 范围内。此外,电沉积是另一种重要的形貌控制合成Cu2O 的方法。Choi 等[19]采用电沉积法两步合成了八面体,第一步电沉积得到有缺陷的立方晶体,然后在含有(NH4)2SO4的Cu(NO3)2溶液中进行第二次电沉积就可以转化为八面体晶体。第二次电沉积所起的作用是填充立方晶体部分缺陷以及调控{111}晶面的生长。进一步研究表明,即使使用相同的方法和试剂,加入试剂的顺序不同对所形成的纳米粒子形貌也有影响。Huang 小组[20]对在相似溶液条件下合成的纳米晶进行了比较性研究,两次研究反应的总体积均为10mL。第一次在水中依次加入CuCl2溶液、表面活性剂SDS、还原剂NH2OH·HCl 和NaOH 溶液,充分混合后反应2h 即得产物。然而这些晶体的表面并不十分规则,它们的棱大都比较平滑,表面也不完美。第二次合成[21]是通过改变以上所列试剂的加入顺序,可将Cu2O 立方体转化为表面规则的八面体。在这一合成过程中,NaOH 溶液为第二种加入的试剂,充分反应形成Cu(OH)2和Cu(OH)42-的混合物 后再向其中加入NH2OH·HCl 试剂,通过简单改变加入NH2OH·HCl的量(变化范围为0.15~0.95mL),就可以合成具有规则表面的Cu2O 立方体、截断立方体、正八面体等。Susman 等[22]在附着Au 颗粒的玻璃基底上电沉积获得了从八面体到立方晶体一系列的Cu2O 纳米晶体。该项研究表明,电解液中的OH-以及作为配合体的柠檬酸根离子作为竞争离子吸附于{100}及{111}晶面并选择性稳定这些晶面,从而能够形成不同形态的Cu2O 晶体。

图2 Cu2O 八面体晶体SEM 图[18]
1.3 正十二面体Cu2O 纳米晶的合成
相比于其他晶体的制备,正十二面体的合成研究相对较少。Yao 等[23]在液相中合成了均一的单晶Cu2O 正十二面体,且晶体粒径较小,分布在100nm左右。首先将Cu(Ac)2·H2O、正十六胺和十一烷混合,在90℃下搅拌10min,然后升温至200℃,反应15~90min 后得到产物。在该过程中,正十六胺起到多重作用。正十六胺与 Cu2+配位形成[Cu(NH2C16H33)4]2+螯合物,作为相转移溶剂将Cu2+转移到有机相及作为还原剂还原Cu2+为Cu2O,充当钝化吸附剂控制晶体的形态,还是Cu2O 晶体自组装的表面活性剂。与上述合成方法相比,Huang等[21]合成的正十二面体颗粒较大,但容易合成。他们以CuCl2、SDS、NaOH 和NH2OH·HCl 的混合液为前体制备出290nm 的Cu2O 正十二面体,如图3。

图3 正十二面体Cu2O 晶体SEM 图[21]
1.4 高晶面Cu2O 纳米晶体的合成
具有高晶面指数的纳米晶粒具有较高的化学活性,这种化学活性对实际应用是十分重要的。Zhang研究小组[24]以硬脂酸作为结构导向剂,通过水热法制备了18 面和26 面Cu2O 纳米晶,如图4。在反应系统中,硬脂酸既作为结构导向剂又作为还原剂。由于{110}面表面能较高,反应过程中硬脂酸吸附于{110}面以降低反应的总能量,并阻止{110}面的垂直生长,从而导致较多的{110}晶面的保留。Wang等[25]在碱性溶液中基于形貌控制法合成的50 面体Cu2O 纳米晶的产量高于70%,这种晶粒可以用于替代价格昂贵的贵金属氧化剂,在温和条件下实现CO 的催化氧化。在所有的参数中,OH-的浓度和溶液中乙醇与水的体积比对Cu2O 纳米晶体的形貌和粒子大小起着至关重要的作用。图5 为50 面体Cu2O纳米晶体的SEM 图。该研究小组对乙醇-水体系进行的综合研究表明,乙醇与水的最适体积比为1∶24。在合成中添加少量的极性有机溶剂是十分必要的。对于50 面体Cu2O 纳米晶体的合成,无论其粒子大小还是形貌均与所用铜盐的种类和溶液中碱的种类无关。当然,反应会受反应温度和时间的影响,最适反应温度为60℃,当反应温度升高或降低时,所形成的产物与传统方法合成的产物相比匀称度有所降低,这是由原来建立的动力学平衡被打破造成的。Wang 等[26]通过简单的低温还原方法并调节所加NaOH 的浓度分别制备了6 面、18 面、26 面、50面、74 面等一系列形态可控的高晶面Cu2O 晶体,而 一系列不同形态Cu2O 晶体的形成是由动力学控制的,最后所暴露的晶面取决于{100}面和{111}面不同的生长速率,图6 为一系列高晶面Cu2O 的SEM 图。

图4 18 面和26 面多面体Cu2O 晶型SEM 图[24]

图5 50 面体Cu2O 纳米晶体的SEM 图片[25]

图6 不同浓度NaOH 制备的形态可变的Cu2O 晶体的SEM图及其相应的结构模型[26]
1.5 其他一些特殊结构Cu2O 纳米晶体的合成
晶体的形状是由两个生长过程决定的,即习惯生长及枝晶的生长。习惯生长是由不同晶面表面能的大小顺序决定的。晶体沿着高表面能垂直方向生长的最快,使得高表面能面减少,低表面能面增多。通过某些手段来改变表面能的相对顺序或者阻碍晶体的习惯生长方向会导致枝晶的生长。Huang 等[21]通过调节电解过程中的电流、电压、温度、时间、离子浓度并结合一次沉积和二次沉积的方法,改变了晶体的习惯生长方式并制备了20 多种枝晶结构。这种独特的合成手段不仅可以更深入地了解晶体的生长机理,还为其他晶体枝晶的合成提供了极大的价值。长春应用化学研究所薛冬峰课题组[27]在不同的水热系统中合成了一系列不同形态的Cu2O 纳米晶体。他们改变了以往合成中通过热力学控制合成的方式,转向改变一些动力学控制因素,不但合成了一些传统结构的晶体,而且合成了包括多角蚕豆和漏斗立方状的Cu2O。Liu 等[28]则通过γ 衍射方法制备了多角星的Cu2O 结构,由于辐射过程水会产生·OH,故在溶液中需要加入异丁醇作为消除剂。其中加入CTAB 的剂量不同会导致形成不同的晶型。最新的研究报告里,Shang 等[29]利用再结晶诱导自组装的方法合成了立方及四方体Cu2O 超级结构。精确地调节实验参数以保证CuCl 的水解达到一定的平衡条件是合成的关键,图7 为特殊结构Cu2O 纳米晶体SEM 组图。

图7 特殊结构Cu2O 纳米晶体SEM 组图
2 空心Cu2O 纳米笼的合成
Cu2O 纳米笼及纳米骨架的合成方法主要有两种:传统的方法采用模板为反应中心,在其表面结晶,待结晶完成后,利用溶解、蚀刻或热处理的方法将反应中心除去,但该方法较为繁琐;近年来,部分学者在无模板的条件下开发了新的方法,首先在无模板的溶剂中自组装成一定的结构,然后加入无机酸等对晶体的某些棱或面进行选择性蚀刻,合成了形貌较好、几何对称、粒径均匀的Cu2O 纳米笼,该方法简捷、易控制。Huang 等[30]在水溶液中依次加入CuCl2、SDS、还原剂NH2OH·HCl、HCl、NaOH,通过调控反应条件合成了截断的十二面体Cu2O 纳米笼及纳米骨架。首先快速组装成具有{110}晶面而缺失{100}晶面的骨架,骨架继续生长则会把{100}晶面填补,形成粒径在350~400nm的纳米笼。通过加入乙醇的盐酸溶液选择性蚀刻纳米笼的{110}晶面后,则会形成另一种纳米骨架。在另一项研究中,该课题组[31]分别向已制备出的{100}晶面缩小的正十二面体和所有把角去掉的正十二面体Cu2O中精确加入HCl 溶液,合成了{110}面蚀刻和中空结构的正十二面体纳米骨架。研究发现,中空的纳米骨架是从{110}面开始蚀刻的,形貌如图8 所示。此外,Sui 等[32]利用原位氧化蚀刻法,先后加入柠檬酸钠和葡萄糖两种还原剂,制备了截断八面体{110}晶面被蚀刻的Cu2O 纳米笼,该纳米笼的壁厚为60nm,外径为700nm,具有高度的几何对称性。Jiao 等[33]在室温液相条件下,通过前体水解法合成了空心立方Cu2O。在该过程中,他们以聚乙二醇(200)为溶剂水热条件反应6h,分离获得前体,然后将前体水解得到空心立方Cu2O,调控反应物的浓度可控制空心Cu2O 大小在50~200nm。Qi 等[34]将碱性酒石酸铜和葡萄糖的混合溶液先经催化还原,然后再在氧气氛围中催化制得了空心Cu2O 八面体纳米笼结构。

图8 {110}面截断的正十二面体Cu2O 不同方向的SEM 图及相应的晶面缺陷[31]
3 一维纳米Cu2O 的合成
模板法是目前合成一维纳米材料的一种最普遍的方法,可以制备各种体系的一维纳米结构。模板法又分为硬模板法和软模板法。软模板法主要是利用表面活性剂形成的介孔相。表面活性剂在溶液中可以自组装成很多构型,如球型胶束、棒型胶束、六方构型、正胶束、反胶束等,所以表面活性剂能够导向一维纳米材料的生长。一维纳米材料的长径比是由胶束和微乳模板的形状、尺寸以及前体盐和表面活性剂的浓度控制的,因此在一定程度上可以通过调控表面活性剂的浓度、种类对氧化亚铜纳米线的形貌进行调控。
3.1 氧化亚铜纳米线
氧化亚铜纳米线的生长可以有不同的途径,并且通过改变制备方法、前体、生长时间等可以调控纳米线的长度、直径、形貌甚至化学组成。而且氧化亚铜纳米线的晶体组成可以是单晶、多晶和非晶。
(1)由聚合物导向直接合成 Tan 等[35]将0.2g乙酸铜溶于40mL 去离子水中,然后加入8μL 的邻甲氧基苯胺,在室温下均匀混合搅拌5min,形成深绿溶液,然后将溶液转移到50mL 聚四氟反应釜,在180~250℃反应5~10h,自然冷却得到黄色Cu2O 纳米线沉淀,将沉淀用无水乙醇多次洗涤分离得到纯Cu2O 纳米线。在反应过程中,邻甲氧基苯胺生成聚邻甲氧基苯胺,聚合物在Cu2O 纳米线上形成保护层,并在Cu2O 纳米线生长过程起导向作用,形貌如图9。

图9 180℃和250℃邻甲氧基苯胺导向合成Cu2O 纳米线的SEM 和TEM 图[35]
(2)有机物配合形成纳米线介晶 Deng 等[36]将0.2g 乙酸铜和0.3mL 3mg/mL GO 溶解在40mL去离子水,然后加入80µL 邻甲氧基苯胺,反应5min,调节pH 值在7~8,转移到50mL 的反应釜中,200℃反应15h,冷却分离得到不同于传统的介晶Cu2O 复合物,该复合物以各向异性生长的纳米线为构建体系,形成了具有8 个类似{111}晶面的八面体,八面体内为超薄的层状结构。在形成过程中,水连接了石墨烯和Cu2+,邻甲氧基苯胺与Cu2+发生配位,从而形成了超薄的层状结构,如图10。石墨烯不仅改变了传统晶体以离子为基础的生长机理,还对凝聚成无定形球状晶体起到至关重要的作用。

图10 八面体Cu2O 纳米线介晶的FESEM 图[36]
(3)由中间体转化合成 Wang 等[37]使用间接法将制备的Cu(OH)2纳米线前体还原得到了Cu2O纳米线。首先将聚乙二醇(相对分子质量20000)和CuCl2·2H2O 直接加入到水中,搅拌至完全溶解,然后把 NaOH 逐滴加入该溶液中,形成蓝色Cu(OH)2纳米线悬浊液,继续搅拌15min 后,逐滴加入水合肼,Cu(OH)2纳米线沉淀逐渐形成红色Cu2O 纳米线。在该过程中,水合肼作为一种强还原剂将二价铜还原成一价铜,但保留了纳米线的形貌(Cu2O 纳米线的SEM 如图11),由该方法制备的Cu2O 纳米线有较大的纵横比,直径在8nm 左右,长度可以达到10~20μm,所制备的Cu2O 纳米线形貌比较均一。另一方面,Cu2O 纳米线也可以在金属Cu 基底上实现,如Li 等[38]首先将Cu 片表面在碱性的过硫酸铵溶液中氧化成Cu(OH)2纳米线,然后在450℃空气氛下退火1h 即可得到Cu2O 纳米线(图12),与前体不同的是,得到是针状的纳米线,纵横比低,直径在300~400nm,长度5~10μm。Ren等[39]将制备的介孔Cu/Cu2O 中间体在无水乙醇中浸泡一个月,得到了直径在50~100nm、长度在5~10µm 的纳米线,所制纳米线的禁带为2.8eV,发生了蓝移。此外,Wu 等[40]使用碳热还原法在CO 还原气氛中将制备的CuO 纳米线还原为带结节的Cu2O 纳米线,起始还原温度为350℃。表面还原的不稳定性以及持续扩散的氧气是带节点的纳米线形成的主要原因。Zhao 研究小组[41]通过一种新颖的氧化法制备了类似虎刺梅茎部形状的Cu2O 纳米线。湿法还原制备出铜纳米线后,将其暴露在湿度为65%~70%、温度为60℃的空气中,氧化为带片层的Cu2O 纳米线。在主干上生长的片状结构尺度为8~12nm,所有的纳米线有相似的纵横比,图13 为其SEM 图。而带有多层毛刺结构的纳米线不仅具有较大的比表面积,而且在一定程度上能减少光生空穴电子的复合,使得其光催化性能显著提高。
(4)由电化学硬模板法制备 硬模板方法主 要是采用预制的一些具有孔道结构的刚性模板,如多孔阳极氧化铝膜、多孔聚碳酸酯膜、碳纳米管、分子筛以及其他模板,它们的均匀孔道为反应物提供了反应场所。到目前为止,用这种方法制备的一维纳米材料数不胜数。Wu 等[42]使用有序介孔硅为硬模板制备出同轴多层螺旋线圈状的纳米线。他们首先在PAA 薄膜上负载了平均直径为60nm 的介孔硅制的模板,然后在该模板上电沉积Cu2O,最后将沉积物浸蚀到NaOH 溶液中除去模板,得到螺旋状 的Cu2O 纳米线。

图11 Cu2O 纳米线SEM 图[37]

图12 针状Cu2O 纳米线SEM 图[38]

图13 虎刺梅茎部形状的Cu2O 纳米线SEM 图[41]
3.2 氧化亚铜纳米管
相对于Cu2O 纳米线,Cu2O 纳米管报道的相对较少,主要方法是溶液合成和电沉积。2003 年,Cao等[43]首次报道了Cu2O 纳米管的合成,其方法是以CTAB 作为结构导向的表面活性剂,使用弱还原剂葡萄糖将Cu(OH)42-前体还原成一维的Cu2O 纳米结构,其中 CTAB 所形成的棒状胶束为Cu2O 纳米管提供了生长模板。2012 年美国威斯康星大学Jin 等[44]在制备Cu2O 纳米线的过程中,发现在Cu2O纳米线生长初期首先形成Cu2O 纳米管,随着生长时间的延长会转变成纳米线。与其他研究不同的是,该研究小组并未添加任何的表面活性剂,并由此证明了一维纳米材料的另一种生长机理,即轴向螺旋位错生长机理,图14 为该纳米管的TEM 图。 Zhong等[45]报道用电沉积法合成了单分散管道为六边形的单晶Cu2O 纳米管,如图15 所示,制备过程由合成和溶解两个步骤构成。首先是电沉积合成一定取向的Cu2O 纳米棒阵列,然后NH4Cl 添加剂与Cu2O反应生成可溶性的[Cu(NH3)4]2+,引起Cu2O 的不断溶解,同时由于静电吸附作用而附着在纳米棒表面的Cl-和CuCl42-能给Cu2O 中的Cu+提供电子,增强Cu—O 键,使得纳米棒表面Cu2O 溶解速率慢于中心部分,溶解优先沿棒中心开始,留下侧面,最终形成纳米管结构。

图14 Cu2O 纳米管TEM 图[44]

图15 Cu2O 纳米管TEM 图[45]
3.3 氧化亚铜纳米棒
Cu2O 纳米棒的制备在最近几年才有报道,主要制备方法有溶剂热法和电化学沉积法。溶剂热法是以羟基化合物或其与水组成的混合溶液为溶剂,加入一定的还原剂、羟基化合物或其他表面活性剂,在特定温度或溶剂热条件下合成,通过调节羟基化合物和水的比例可调控纳米棒的长径比。但是这种通过控制粒子生长、聚集的自组装方法一般很难合成尺寸均匀、单分散的Cu2O 纳米棒。Guan 等[46]在水-甲苯体系界面上利用还原剂水杨醛与Cu2+形成微米级平板状复杂化合物,然后在水热条件下通过控制刻蚀复杂化合物制备了分散性较好的Cu2O纳米棒,棒端部连接在同一根基体上,整体呈梳子状,图16 为纳米棒的SEM 图。该研究发现水杨酸是该合成的关键,蚀刻是发生在水油界面的,但刻蚀机理未见报道。电沉积是另一种制备纳米棒的重要方法,即通过预制的一些具有孔道结构的刚性模板为模型制得,所以硬模板的成功制备是获得预想产物的重要前提。Musselman 等[47]首先通过直流磁控管依次将Ti、W、Al 溅射到ITO 基底或者Si 基底上制得电镀阳极板,然后进行阳极处理将Al2O3镀层酸蚀刻形成多孔的矩阵,最后恒压电沉积制得纳米棒矩阵。Ju 研究小组[48]亦采用电沉积法在AAO模板上碱性条件恒电流获得Cu2O 纳米棒,其沉积速度快达360nm/min。该研究表明,纳米管是生长纳米棒的过渡态,即在恒电流下先制备成Cu2O 纳米管,然后把纳米管填充为纳米棒。Haynes 等[49]首先在氧化物基底上形成ZnO 纳米棒薄膜,利用硝化纤维将ZnO 纳米棒包裹而聚乳酸填充纳米棒列阵之间的缝隙,然后把ZnO 蚀刻除去并电沉积Cu2O,用有机溶剂把聚合物溶解后制得Cu2O 纳米棒列阵。

图16 Cu2O 纳米棒SEM 图[46]
4 Cu2O 光催化剂降解有机污染物
随着人们对能源环境问题的日益关注,寻找一种节能环保的光催化剂以降解环境有机物污染是近几十年人们研究的重点之一。到目前为止,Cu2O 作为一种能高效利用可见光的催化剂,在降解有机污染物方面引起了人们的广泛研究,但是大多数Cu2O光催化降解有机污染物的研究主要集中于具有完整晶面的纳米晶的应用过程[6,14,18-19,50-51]。一维Cu2O没有纳米晶体类似的多晶面,应用于光催化降解有机污染物的研究较少,其催化性能有待于深入研究。由此,针对Cu2O 纳米晶的光催化应用作了以下 讨论。
晶体粒径的大小导致晶体的比表面积大小不同,从而影响催化剂的催化活性。Xu 课题组[6]研究了不同粒径Cu2O 纳米立方晶体降解甲基橙的光催化活性,得到粒径越小光催化作用越明显的结论。另外,催化剂的晶型也会影响催化剂的光催化活性。Wang 研究小组[18]比较了八面体Cu2O 和立方Cu2O 光催化降解甲基橙的效果,发现具有{111}晶面的八面体Cu2O 的吸附催化性能优于只有{100}晶面的立方Cu2O 晶体。Lu 等[50]通过降解罗丹明B的研究同样发现八面体Cu2O 具有最强的光催化活性,其次为截边的立方Cu2O 和六角八面体Cu2O。Huang 小组[14]比较了粒径大小均为230nm 的八面体和立方Cu2O,结果仍然表明八面体Cu2O 的活性较高。
研究发现,除了催化剂粒径和晶型对催化效果的影响之外,催化活性和催化剂表面性质和有机染料的电性有关。在该方面,Huang 课题组[51]先后进行了系统的研究,2009 年一项对甲基橙降解的报告指出(图17),拥有更多{111}面的八面体六角型或多角型Cu2O 与八面体Cu2O 相比,光催化活性显著提高,而只有{100}晶面的立方Cu2O 活性较差。其原因是因为{111}表面上具有铜的悬挂键,使得带负电性的甲基橙容易吸附到{111}晶面,从而有利于甲基橙的降解;{100}晶面没有铜的悬挂键而显电中性。与此同时,通过降解正电性的亚甲基蓝(图18)和甲基紫溶液一段时间后,发现催化剂漂浮到溶液的表面和黏附到器壁上,证实了{111}晶面和正电性有机物发生了静电排斥作用,有机物几乎没有降解。2012 年的研究[21]表明正十二面体晶体对甲基橙的降解表现出更强的催化活性,并指出正十二面体每个单元{110}晶面上铜的悬挂键是{111}晶面的1.5倍,{100}晶面无铜的悬挂键且为中性是该现象发生的根本原因,图19 为Cu2O 晶面的模型图。Zhang等[24]比较了立方晶体、八面体及混合18~26 面体Cu2O 的催化活性,同样发现具有较多{110}晶面的混合18~26 面体Cu2O 有较高的催化活性。
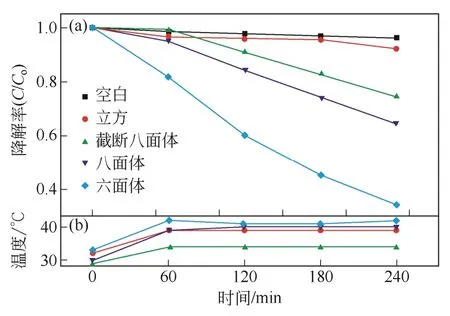
图17 不同Cu2O 纳米结构光降解甲基橙曲线[51]
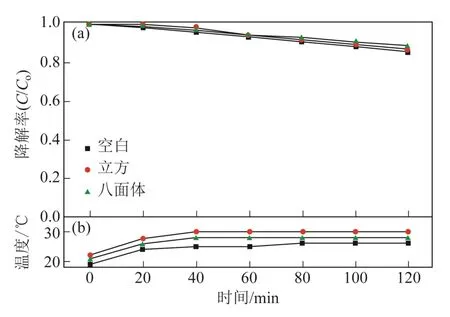
图18 立方Cu2O 和八面体Cu2O 光催化降解亚甲基蓝 曲线[51]
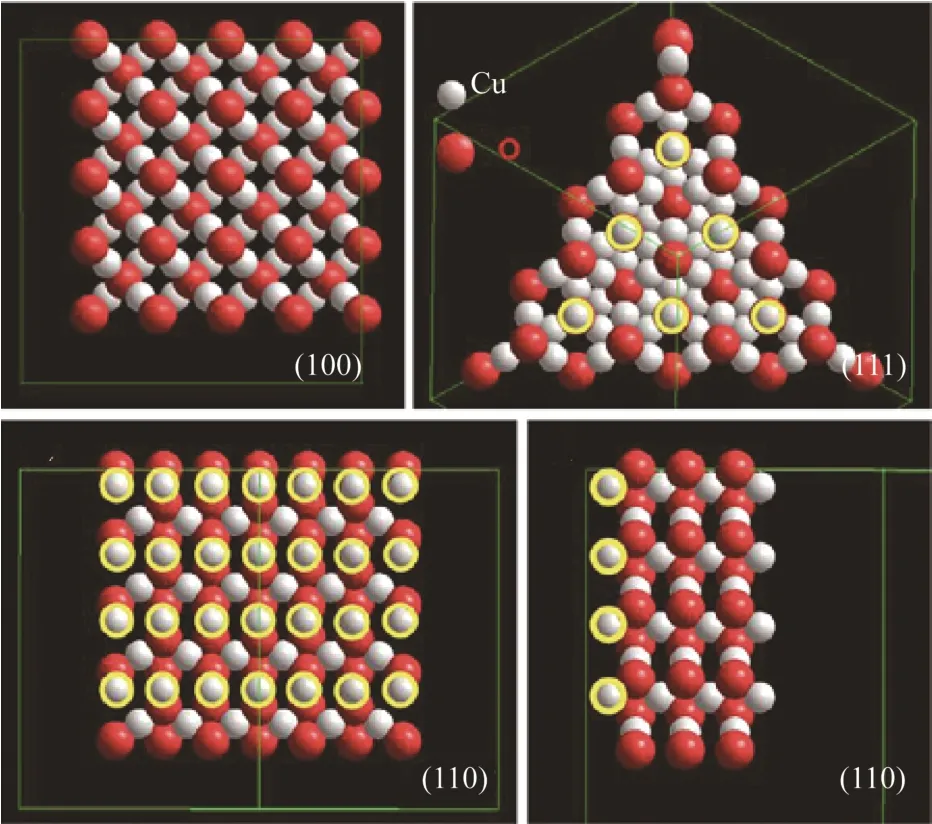
图19 Cu2O 晶面结构图[21]
5 结语与展望
不同形貌结构的Cu2O 具有不同的物理和化学性能,受到人们广泛的重视。随着研究方法和研究理论的不断深入,已经可以在微观层面上对形貌、结构、粒径等方面进行适当调控。通过添加不同的表面活性剂或者通过一些特别的离子来调控晶体的形貌。通过改变溶液的碱性或所加还原剂的速率调节晶体的生长速率,从而调控晶体的大小。Cu2O 纳米笼及纳米骨架的合成首先是微粒自组装成一定的晶体结构,然后在无机酸的作用下对晶体的某些棱或面进行选择性蚀刻,通过严格控制蚀刻时间和反应条件,最终合成形貌较好、几何对称、粒径均匀的Cu2O 纳米笼或纳米骨架。一维Cu2O 纳米结构主要通过硬模板和软模板提供导向作用来获得。
虽然目前对Cu2O 的形貌控制合成取得了一系列的研究进展。但是仍然存在诸多挑战性的问题:①对不同尺寸和形貌Cu2O 的可控合成机理研究还比较粗浅,各个因素如何影响晶体的形貌还比较模糊,因此,合成机理的研究仍是一个困难但重要的课题;②非传统多晶面的Cu2O 有较高的表面能,在合成过程中不稳定而趋向低能晶面的晶体转变相对较难合成,但非传统高晶面指数的Cu2O晶体具有一些显著的化学特性及潜在优势,所以是今后研究的热点之一;③Cu2O 纳米笼的研究仍处于摸索阶段,蚀刻的条件及实验环境比较苛刻,合成具有完整晶面且中空Cu2O纳米笼的文献鲜有报道,所以Cu2O纳米笼的进一步研究是将来的发展趋势。当然,不同形貌Cu2O 可控合成的研究将给其他晶体的合成提供一些借鉴。
Cu2O 在光催化降解有机污染物方面应进行的研究有如下几方面。
(1)Cu2O 稳定性较差,容易发生光腐蚀,致使其光催化效率不高。基于此,一方面可以将Cu2O和其他稳定的半导体材料进行复合,在发挥Cu2O光催化特性的同时并提高其稳定性。另一方面,应从电子理论和电化学理论方面找到从根本上避免光腐蚀的办法,这样不仅可以提高Cu2O 的光稳定性,还提高了光催化效率。
(2)不同形貌Cu2O 在不同环境所引起催化效率的差别虽然从晶面原子组成的方面给予了一定的解释,但不同晶面和有机污染物的相互作用机理仍不明确,未来对这方面应作进一步的研究。
(3)Cu2O 在光降解有机污染物的过程中发生了一系列的有机光反应,所以未来可以将Cu2O 光催化同有机反应相结合,这将是一个新的研究方向。
[1] Mizuno K,Izaki M,Murase K,et al. Structural and electrical characterizations of electrodeposited p-type semiconductor Cu2O films[J]. J. Electrochem. Soc.,2005,152(4):c179-c182.
[2] Hara M,Kondo T,Komoda M,et al. Cu2O as a photocatalyst for overall water splitting under visible irradiation[J]. Chem. Commun.,1998,3:357-358.
[3] Roos A,Chibuye T,Karlsson B. Properties of oxidized copper surfaces for solar applications[J]. Sol. Energ. Mater.,1983,7(4):467-480.
[4] Ng C H B,Fan W Y. Shape evolution of Cu2O nanostructures via kinetic and thermodynamic controlled growth[J]. J. Phys. Chem. B,2006,110(42):20801-20807.
[5] Kim J Y,Kwon Y W,Lee H J. Metal ion-assisted reshaping of Cu2O nanocrystals for catalytic applications[J]. J. Mater. Chem. A,2013,1(45):14183-14188.
[6] Cao Y Y,Xu Y Y,Hao H Y,et al. Room temperature additive-free synthesis of uniform Cu2O nanocubes with tunable size from 20nm to 500nm and photocatalytic property[J]. Mater. Lett .,2014,114 :88-91.
[7] Kwon Y W,Soon A,Hanb H,et al. Shape effects of cuprous oxide particles on stability in water and photocatalytic water splitting[J]. J. Phys. Chem. C,2015,3(1):156-162.
[8] Mcshane C M,Choi K S. Photocurrent enhancement of n-type Cu2O electrodes achieved by controlling dendritic branching growth[J]. J. Am. Chem. Soc.,2009,131(7):2561-2569.
[9] Jayaramulu K,Suresh V M,Maji T K. Stabilization of Cu2O nanoparticles on a 2D metal-organic framework for catalytic huisgen 1,3-dipolar cycloaddition reaction[J]. Dalton Trans.,2015,44(1):83-86.
[10] Yuhas B D,Yang P. Nanowire-based all-oxide solar cells[J]. J. Am. Chem. Soc.,2009,131(10):3756-3761.
[11] Kuo C H,Chen C H,Huang M H. Seed-mediated synthesis of monodispersed Cu2O nanocubes with five different size ranges from 40 to 420nm[J]. Adv. Funct. Mater.,2007,17(18):3773-3780.
[12] Gou L F,Murphy C J. Solution-phase synthesis of Cu2O nanocubes[J]. Nano Lett.,2003,3(2):231-234.
[13] Kim M H,Lim B,Lee E P,et al. Polyol synthesis of Cu2O nanoparticles:Use of chloride to promote the formation of a cubic morphology[J]. Mater. Chem.,2008,18(34):4069-4073.
[14] Huang M H,Kuo C H. Morphological controlled synthesis of Cu2O nanocrystals and their properties[J]. Nano Today,2010,5(2):106-116.
[15] Chang I C,Chen P C,Lee C Y,et al. Large-scale synthesis of uniform Cu2O nanocubes with tunable sizes by in-situ nucleation[J]. Cryst. Eng. Comm.,2013,15(13):2363-2366.
[16] Chen K,Xue D. pH-Assisted crystallization of Cu2O:Chemical reactions control the evolution from nanowires to polyhedra[J]. Cryst. Eng. Comm.,2012,14(23):8068-8075.
[17] Nikam A V,Arulkashmir V,Prasad B L V,et al. pH-Dependent single-step rapid synthesis of CuO and Cu2O nanoparticles from the same precursor[J]. Cryst. Growth Des.,2014,14(9):4329-4334.
[18] Xu H L,Wang W Z,Zhu W. Shape evolution and size-controllable synthesis of Cu2O octahedra and their morphology-dependent photocatalytic properties[J]. J. Phys. Chem. B,2006,110(28):13829-13834.
[19] Siegfried M J,Choi K S. Directing the architecture of cuprous oxide crystals during electrochemical growth[J]. Angew. Chem. Int. Ed.,2005,44(21):3282-3287.
[20] Kuo C H,Huang M H. Facile synthesis of Cu2O nanocrystals with systematic shape evolution from cubic to octahedral structures[J]. J. Phys. Chem. C,2008,112(47):18355-18360.
[21] Huang W C,Lyu L M,Yang Y C,et al. Synthesis of Cu2O nanocrystals from cubic to rhombic dodecahedral structures and their comparative photocatalytic activity[J]. J. Am. Chem. Soc.,2012,134(2):1261-1267.
[22] Susman M D,Feldman Y,Rubinstein I,et al. Chemical deposition of Cu2O nanocrystals with precise morphology control[J]. ACS Nano,2014,8(1):162-174.
[23] Yao K X,Yin X M,Wang T H,et al. Synthesis,self-assembly,disassembly,and reassembly of two types of Cu2O nanocrystalsunifaceted with {001} or {110} planes[J]. J. Am. Chem. Soc.,2010,132(17):6131-6144.
[24] Zhang Y,Deng B,Zhang T R,et al. Shape effects of Cu2O polyhedral microcrystals on photocatalytic activity[J]. J. Phys. Chem. C,2010,114(11):5073-5079.
[25] Leng M,Liu M Z,Wang Z Q,et al. Polyhedral 50-facet Cu2O microcrystals partially enclosed by {311} high-index planes:Synthesis and enhanced catalytic CO oxidation activity[J]. J. Am. Chem. Soc.,2010,132(48):17084-17087.
[26] Wang X P,Jiao S H,Wu D P,et al. A facial strategy for crystal engineering of Cu2O polyhedrons with high-index facets[J]. Cryst. Eng. Comm.,2013,15:1849-1852.
[27] Chen K F,Sun C T,Xue D F,et al. Polymorphic crystallization of Cu2O compound[J]. Cryst. Eng. Comm.,2014,16(24):5257-5267.
[28] Liu H R,Miao W F,Chen J F,et al. Controlled synthesis of different shapes of Cu2O via γ-irradiation[J]. Cryst. Growth Des.,2009,9(4):1733-1740.
[29] Shang Y,Shao Y M,Guo L,et al. Recrystallization-induced self-assembly for the growth of Cu2O superstructures[J]. Angew. Chem. Int. Ed.,2014,53(43):11514-11518.
[30] Kuo C H,Huang M H. Fabrication of truncated rhombic dodecahedral Cu2O nanocages and nanoframes by particle aggregation and acidic etching[J]. J. Am. Chem. Soc.,2008,130(38):12815-12820.
[31] Tsai Y H,Chiu C Y,Huang M H. Fabrication of diverse Cu2O nanoframes through face-selective etching[J]. J. Phys. Chem. C,2013,117(46):24611-24617.
[32] Sui Y M,Zeng Y,Zheng W T,et al. Synthesis of polyhedron hollow structure Cu2O and their gas-sensing properties[J]. Sens. Actuators B,2012,171-172:135-140.
[33] Xu Y Y,Jiao X L,Chen D R. PEG-assisted preparation of single-crystalline Cu2O hollow nanocubes[J]. J. Phys. Chem. C,2008,112(43):16769-16773.
[34] Lu G H,Qi L M,Yang J H,et al. One-pot synthesis of octahedral Cu2O nanocages via a catalytic solution route[J]. Adv. Mater.,2005,17(21):2562-2567.
[35] Tan Y W,Xue X Y,Peng W,et al. Controllable fabrication and electrical performance of single crystalline Cu2O nanowires with high aspect ratios[J]. Nano Lett.,2007,7(12):3723-3728.
[36] Deng S Z,Tjoa W,Fan H M,et al. Reduced graphene oxide conjugated Cu2O nanowire mesocrystals for high-performance NO2gas sensor[J]. J. Am. Chem. Soc.,2012,134(10):4905-4917.
[37] Wang W Z,Wang G G,Wang X S,et al. Synthesis and characterization of Cu2O nanowires by a novel reduction route[J]. Adv. Mater.,2002,14(1):67-69.
[38] Qian F , Wang G M , Li Y. Solar-driven microbial photoelectrochemical cells with a nanowire photocathode[J]. Nano Lett.,2010,10(11):4686-4691.
[39] Ren Y,Ma Z,Bruce P G. Transformation of mesoporous Cu/Cu2O into porous Cu2O nanowires in ethanol[J]. Cryst. Eng. Comm.,2012,14(8):2617-2620.
[40] Wu F,Myung Y,Banerjee P. Rayleigh instability driven nodular Cu2O nanowires via carbothermal reduction of CuO nanowires[J]. Cryst. Growth Des.,2015,15(4):1588-1595.
[41] Zhao Y X,Wang W T,Huo Z Y,et al. Hierarchical branched Cu2O nanowires with enhanced photocatalyticactivity and stability for H2production[J]. Nanoscale,2014,6(1):195-198.
[42] Wu Y Y,Livneh T,Zhang Y Z,et al. Templated synthesis of highly ordered mesostructured nanowires and nanowire arrays[J]. Nano Lett.,2004,4(12):2337-2342.
[43] Cao M H,Hu C W,Wang Y H. A controllable synthetic route to Cu,Cu2O,and CuO nanotubes and nanorods[J]. Chem. Commun.,2003,39(15):1884-1885.
[44] Hacialioglu S,Mengw F,Jin S. Facile and mild solution synthesis of Cu2O nanowires and nanotubes driven by screw dislocations[J]. Chem. Commun.,2012,48(8):1174-1176.
[45] Zhong J H,Li G R,Wang Z L,et al. Facile electrochemical synthesis of hexagonal Cu2O nanotube arrays and their application[J]. Inorg. Chem.,2011,50(3):757-763.
[46] Guan L,Pang H,Wang J J,et al. Fabrication of novel comb-like Cu2O nanorod-based structures through an interface etching method and their application as ethanol sensors[J]. Chem. Commun.,2010,46(37):7022-7024.
[47] Musselman K P,Mulholland G J,Robinson A P,et al. Low-temperature synthesis of large-area,free-standing nanorod arrays on ITO/glass and other conducting substrates[J]. Adv. Mater.,2008,20(23):4470-4475.
[48] Ju H K,Lee J K,Lee G,et al. Fast and selective Cu2O nanorod growth into anodic alumina templates via electrodeposition[J]. Curr. Appl. Phys.,2012,12(1):60-63.
[49] Haynes K M,Perry C M,Rivas M,et al. Templated electrodeposition and photocatalytic of cuprous oxide nanorod arrays[J]. ACS Appl. Mater. Interfaces,2015,7(1):830-837.
[50] Pang H,Gao F,Lu Q Y. Glycine-assisted double-solvothermal approach for various cuprous oxide structures with good catalytic activities[J]. Cryst. Eng. Comm,2010,12(2):406-412.
[51] Ho J Y,Huang M H. Synthesis of submicrometer-sized Cu2O crystals with morphological evolution from cubic to hexapod structures and their comparative photocatalytic activity[J]. J. Phys. Chem. C,2009,113(32):14159-14164.
