脂肪酶固定化及其催化生物柴油研究
2015-07-23赵兴秀何义国赵长青方春玉张静邹伟四川理工学院四川自贡643000
赵兴秀,何义国,赵长青,方春玉,张静,邹伟(四川理工学院,四川自贡643000)
脂肪酶固定化及其催化生物柴油研究
赵兴秀,何义国,赵长青,方春玉,张静,邹伟
(四川理工学院,四川自贡643000)
摘要:得到脂肪酶固定化的最佳条件及固定脂肪酶对生物柴油的转化率。利用单因素试验和正交试验确定脂肪酶固定化的最佳条件,通过气相色谱-质谱联用仪分析合成生物柴油的主要成分。结果:脂肪酶固定化的最佳条件:缓冲液pH 7.5、载体/酶液比为25mg/mL、固定化温度应为40℃,其固定化酶活力为68.25U/g,利用固定脂肪酶催化合成生物柴油的转化率高达75%。结果表明:固定化酶比游离酶具有更高的催化效率,对高温和pH具有更高的耐受性。固定化脂肪酶催化效率高、操作稳定性较强,具有较好的工业化生产潜力。
关键词:脂肪酶;固定化;大孔树脂;生物柴油
脂肪酶是一类具有多种催化能力的酶,广泛应用于食品、化妆品、皮革、洗涤剂、医药、印染、能源等领域[1]。利用脂肪酶催化合成生物柴油是制备新能源的一条新途径[2-3],由于生物柴油可再生,对环境友好,且石化资源逐渐减少,研制生物柴油极具经济和社会效益[4]。目前美国、巴西、日本及欧洲发达国家,已经开始利用脂肪酶大规模催化合成生物柴油[5-7]。我国这在方面起步晚,但国家对新能源战略非常重视,尤其关注生物柴油的研究进展,已有不少文献对脂肪酶合成生物柴油进行了报道[8-10],其中脂肪酶的催化条件是合成生物柴油的关键,虽然游离酶和固定化酶均可发挥作用,但作用环境和作用效果如何,却鲜有文献将二者的催化效果同时研究。
本论文系统研究了从脂肪酶的制备到生物柴油合成的全过程,包括酶的固定化条件和固定化酶的稳定性,比较了游离酶和固定化酶的催化效果,将合成的生物柴油进行气相-质谱分析,以期对工业上固定化酶催化合成生物柴油提供参考数据和理论参考。
1 材料与方法
1.1材料
1.1.1菌株
四川理工学院生物工程学院微生物实验室保存产脂肪酶菌株,编号分别为1、2、3、4。
1.1.2仪器与试剂
生化培养箱(LHP-250):上海经艺仪器设备有限公司;酶标仪ELx808美国伯腾仪器有限公司;气相-质谱联用仪(GC-MS 6800):江苏天瑞仪器股份有限公司。所有试剂均为分析纯。
1.2培养基的配制
斜面培养基(%):蛋白胨0.5 g,葡萄糖0.5 g,酵母膏0.3 g,NaCl0.5 g,Na2HPO40.1 g,琼脂20 g。
种子培养基(%):蛋白胨0.5 g,蔗糖0.5 g,NaCl 0.3 g,K2HPO40.2 g,酵母浸膏0.5 g。
发酵培养基(%):蛋白胨2 g,蔗糖0.5 g,橄榄油0.5g,(NH4)2SO40.1 g,MgSO4·7H2O 0.1g,K2HPO40.1g。1.3脂肪酶活力测定(NaOH滴定法[11])
游离酶活力的测定:在40℃、pH 7.5条件下游离酶液水解脂肪(油脂),每分钟水解产生1μmol脂肪酸的脂肪酶量定义为1个脂肪酶活单位(U/mL)。
固定化酶活力的测定:在40℃、pH 7.5条件下固定化酶水解脂肪(油脂),每分钟水解产生1μmol脂肪酸的脂肪酶量定义为1个脂肪酶活单位(U/mL)。
1.4蛋白质含量的测定
采用考马斯亮蓝法。

1.5出发菌株发酵产酶
将斜面培养基中的出发菌株接种于种子液,于37℃、160 r/min摇床培养16 h,再接种于发酵培养基,同等条件培养36 h,将发酵液于8 000 r/min离心15 min,获得上清液即为酶液。
1.6脂肪酶固定化
1.6.1大孔树脂预处理
用95%的乙醇浸泡D101型大孔树脂24 h,真空抽滤后,用蒸馏水冲洗。再依次用5%盐酸的和5%氢氧化钠溶液浸泡4 h,抽滤,用蒸馏水洗至中性。抽滤后置于4℃冰箱保存备用。
1.6.2大孔树脂固定脂肪酶
将经预处理的D101型大孔树脂、缓冲液和脂肪酶置于水浴锅中恒温震荡吸附4 h后,真空抽滤,用缓冲液洗涤固定化酶3次~5次,抽干后于4℃保存。
1.7固定化脂肪酶单因素实验
分别用不同的pH缓冲液、固定化温度和载体/酶液比,测定磁力搅拌吸附4 h脂肪酶蛋白固定率和固定化酶活力。
1.8固定化脂肪酶正交试验
根据单因素实验结果,以缓冲液pH、固定化温度和载体/酶液比3因素为考察对象,进行L9(33)正交试验,确定脂肪酶固定的最佳条件。
1.9固定化脂肪酶的水解性质研究
分别在不同温度和不同pH条件下测定固定化酶和游离酶的水解活力。
1.10固定化脂肪酶催化合成生物柴油
将大豆油、甲醇、正己烷和固定脂肪酶按质量比为5∶5∶15∶1的比例依次加入反应器中,于45℃、160 r/min反应4 h,反应过程中甲醇分3次加入。反应结束后滤出固定化脂肪酶,并离心除去粗甘油,水浴蒸馏除去有机溶剂,用气相-质谱联用仪检测合成生物柴油的成分及含量。滤出的固定化脂肪酶用正己烷洗涤3次后作为下一轮反应的催化剂,重复试验8批次,计算每批次生物柴油转化率,确定固定化脂肪酶的催化效率和操作稳定性。

1.11气相-质谱联用仪检测分析生物柴油
将合成的生物柴油用Agilent TSQ8000气相-质谱联用仪(美国)检测分析,其色谱条件:初始温度60℃,保留时间1.0min,15℃/min升温至280℃,保留时间7min,进样器温度300℃,检测器温度280℃,载气N2,柱前压8.16 kPa,流量1.8mL/min,分流比为1∶25。质谱条件:离子源EI,离子源温度230℃,离子化能量70 eV,辅助线温度280℃,扫描范围20 amu~500 amu,扫描时间0.35 s,回扫时间0.05 s。
2 结果与分析
2.1产脂肪酶菌株的复筛
将保存的4株产脂肪酶菌进行产酶发酵培养,发酵液经离心后得上清液,以NaOH滴定法分别测定其酶活,结果如图1。
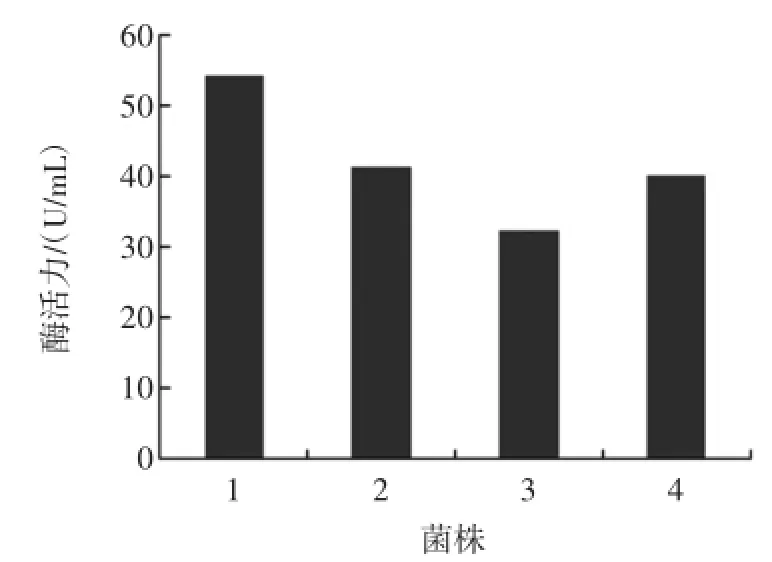
图1 菌株酶活力测定Fig.1 Theenzym eactivity of the stains
由图1可知,4菌株所产脂肪酶均具有较高的酶活,酶活最小的是3号菌,为32.25U/mL,1号菌的酶活最大,为54.38U/mL,后续实验中将1号菌作为本试验的产酶菌株。
2.2蛋白质标准曲线
以牛血清蛋白含量为横坐标,其OD595为纵坐标,得到蛋白质量与其OD595的关系图,如图2。
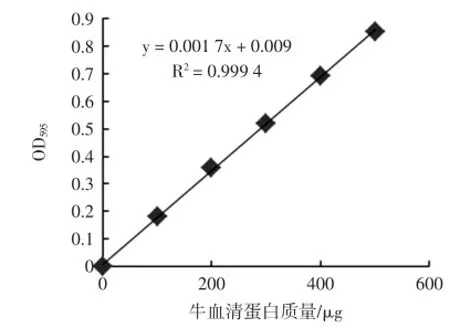
图2 蛋白质含量的标准曲线Fig.2 Thestandard curveof protein determ ination
从图2可以看出,蛋白质量与蛋白的OD595值成正比,R2=0.999 4,线性关系良好,实验中的蛋白含量均通过图2的标准曲线进行换算。
2.3脂肪酶固定化的单因素试验
2.3.1缓冲液pH对脂肪酶固定化的影响
在载体/酶液比为25mg/mL、温度为40℃条件下,分别调节缓冲液pH为5、6、7、8、9、10,测得各pH条件下蛋白固定率和固定化酶酶活,结果如图3。
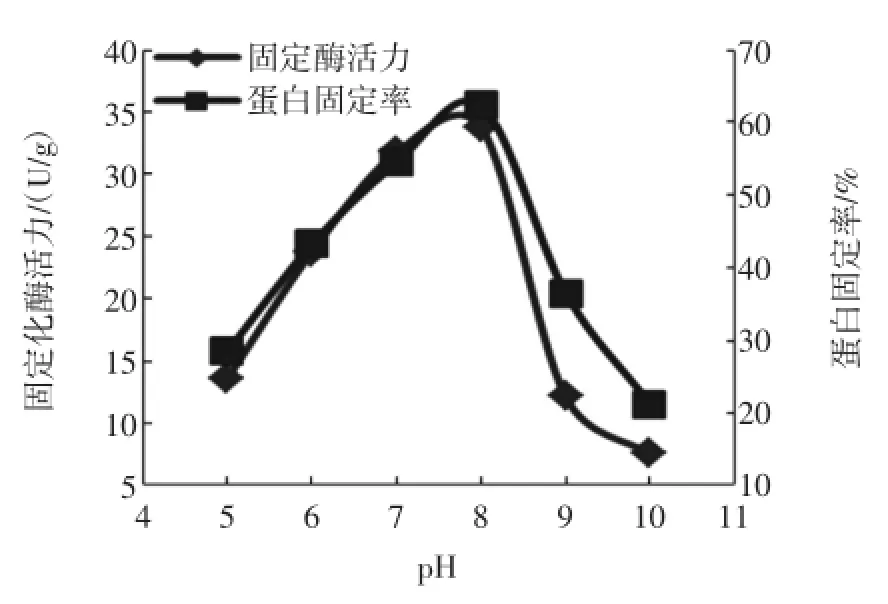
图3 pH对脂肪酶固定化的影响Fig.3 Effect of pH on imm obilization of lipase
由图3可知,D101型大孔树脂对酶液中蛋白质的固定率和固定化脂肪酶酶活均呈现随pH升高先上升后下降的趋势,当pH 8时,二者均达到最大值,蛋白固定率为62.4%,固定化脂肪酶酶活为33.8U/g。随着pH继续增加固定化酶活迅速减小,可能是由于随着pH值的增加,酶分子表面离子化程度减低,使得酶分子与载体之间的结合能力消弱所致。因此,脂肪酶固定化的最佳pH为8。
2.3.2载体/酶液比对脂肪酶固定化的影响
在pH 8、温度为40℃条件下,将载体/酶液比分别配制为10、15、20、25、30、35mg/mL,测得了蛋白固定率和固定化酶酶活,结果如图4。
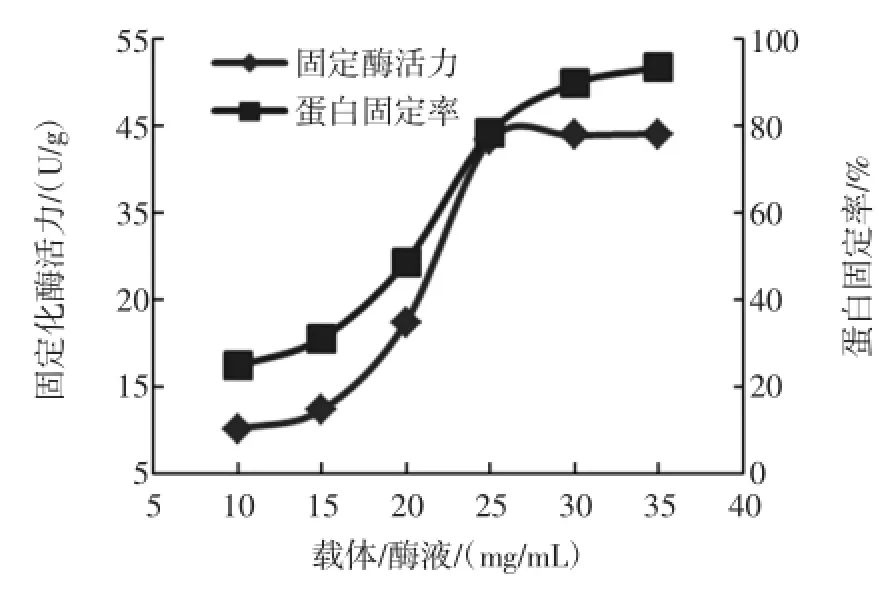
图4 载体投放量对脂肪酶固定化的影响Fig.4 Effectof car rier'squantity on imm obilization of lipase
由图4可知,D101型大孔树脂对脂肪酶的固定率和固定化酶活随载体投放量的增加而上升,载体/酶液比达到25mg/mL时,蛋白固定化率上升缓慢,可能是由于大孔树脂的内部孔径空间被占有,载体固定化的脂肪酶已基本达到饱和,此时的固定化酶活为44.1U/g、蛋白固定率为93.5%,再增加载体投放量对固定化酶酶活无明显提高,因此载体/酶液比确定为25mg/mL。2.3.3固定化温度对脂肪酶固定化的影响
在缓冲液pH 8、载体/酶液比为25mg/m L条件下,将温度分别设为25、30、35、40、45、50℃,测得了蛋白固定率和固定化酶酶活,结果如图5。
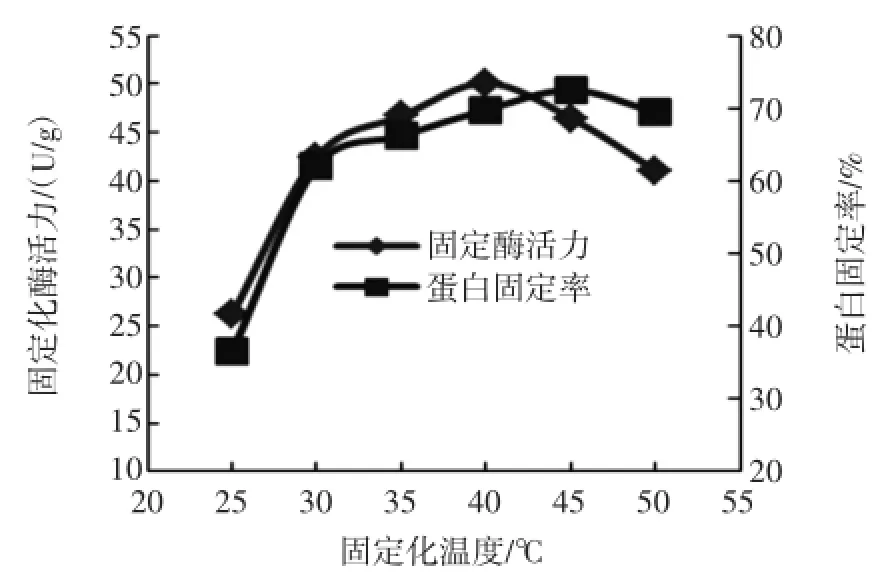
图5 温度对脂肪酶固定化的影响Fig.5 Effect of tem peratureon immobilization of lipase
由图5可知,在温度较低时,蛋白的固定率较小,脂肪酶酶活也比较小,随着温度的升高蛋白固定率和固定化酶活都逐渐增大,在40℃时固定化酶活达到最大值50.1U/g,蛋白固定率也达到较大值为69.8%,当温度继续上升时,蛋白固定率略有提高,而脂肪酶酶活下降较快,可见高温导致部分脂肪酶酶活减小或丧失,因此,将固定化的最佳温度确定为40℃。
2.4正交试验
在单因素试验基础上,选取缓冲液pH、固定化温度、载体/酶液比3因素为考察对象,每因素选取3个水平进行正交试验,其正交试验结果如表1所示。
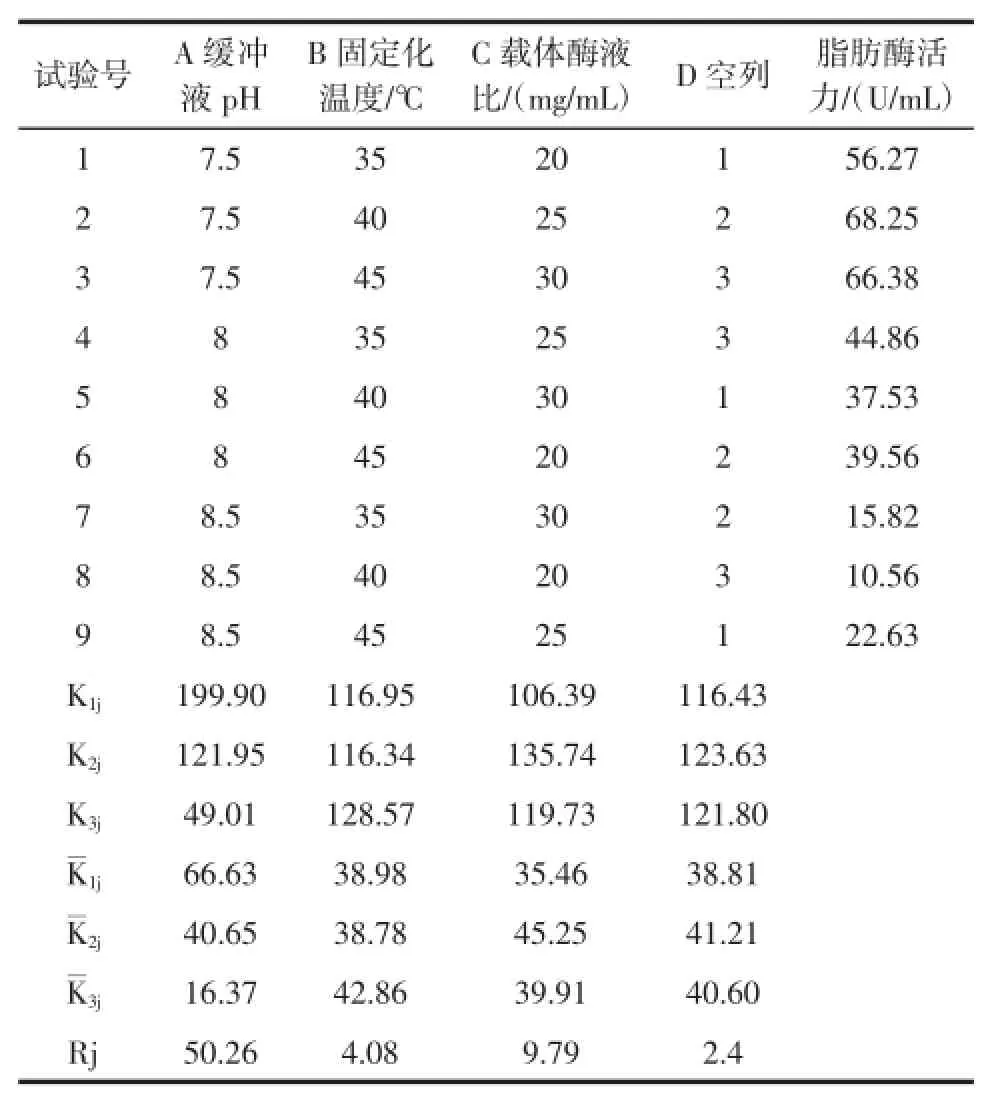
表1 脂肪酶固定化L9(33)正交试验结果Table1 Resultsoforthogonal test
由表1的正交试验结果可知:A、B、C三因素的极差值Rj分别为50.26、4.08和9.79,均大于空列的Rj。表明A、B、C 3个因素的水平试验存在显著差异性。各因素对脂肪酶固定化影响的主次关系为A>C>B,脂肪酶固定化各因素最优水平组合为2号处理,即A1B2C2,对应的固定化条件为:缓冲液pH 7.5,固定化温度应为40℃,载体/酶液比为25mg/m L,在此条件下固定化脂肪酶活力最大达68.25U/mL。
2.5固定化脂肪酶的水解性质研究
2.5.1温度对固定化酶和游离酶的水解活力的影响
在pH 7.5、温度分别为25、30、35、40、45、50、55、60、65℃条件下测得了固定化酶与游离酶的酶活,结果如图6。
从图6可知,从25℃开始,随着温度的增加,游离酶和固定化酶的活性均逐渐增大,固定化酶和游离酶的最适反应温度都是40℃。超过最适温度后,游离酶酶活力随着温度升高下降迅速,温度为65℃时,游离酶酶活力降到9.8 U/m L;超过40℃后,固定化酶酶活也开始下降,但趋势平缓,温度为65℃时,酶活为43.7 U/mL,表明脂肪酶经过固定化处理后,对高温的耐受性有较大提高。
2.5.2pH对固定化酶和游离酶的水解活力的影响
在温度为40℃,pH分别为4、5、6、7、8、9、10条件下测得了固定化酶与游离酶的酶活,结果如图7。
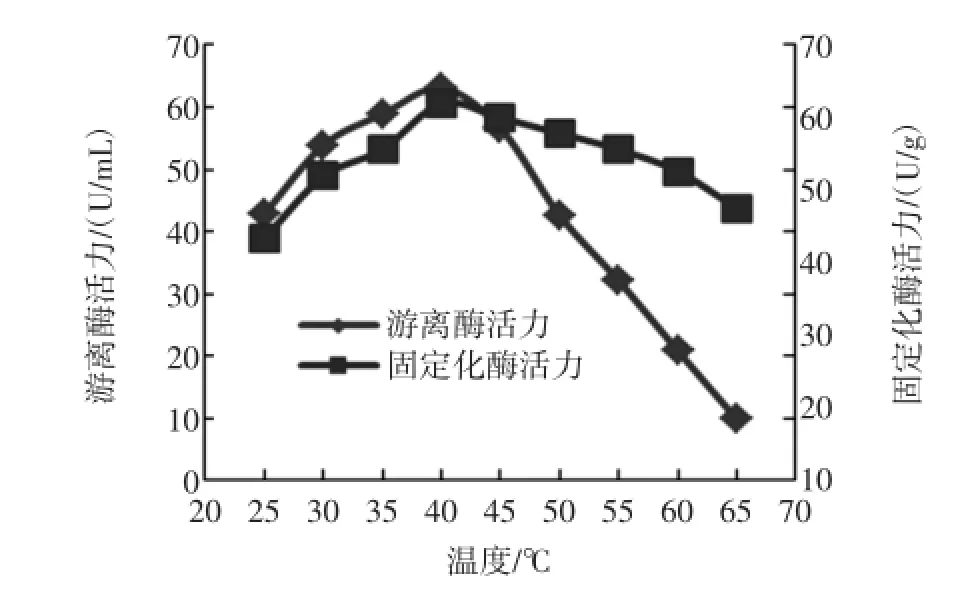
图6 温度对酶活的影响Fig.6 Effectsof tem peratureon activity of enzymes
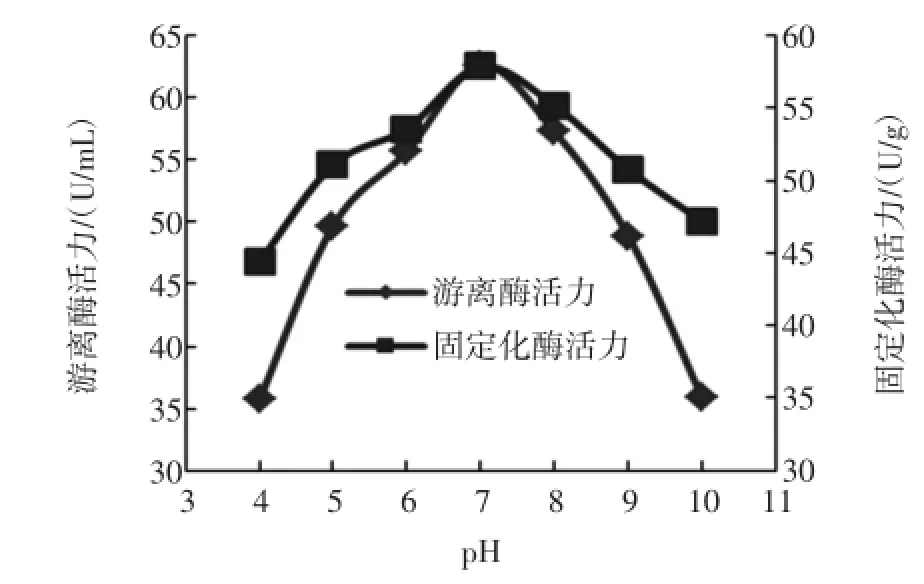
图7 pH对酶活的影响Fig.7 Effectsof pH on activity ofenzymes
由图7可知,当pH 7时,游离酶的酶活为62.6 U/mL,固定化酶的酶活为57.9U/g,均达最高值。当pH大于或小于7时,游离酶酶活力随pH改变而迅速降低,而固定化酶酶活下降趋势较缓。表明固定化酶具有较高的pH稳定性,在过酸或过碱的情况下较游离酶能保持更大的酶活力。
2.6固定化脂肪酶催化合成生物柴油
2.6.1气相色谱-质谱联用仪检测分析生物柴油
利用气相色谱-质谱联用仪对固定化脂肪酶催化合成的生物柴油进行检测分析,其色谱图如图8。
通过分析计算得知生物柴油产品中脂肪酸甲酯的组成主要为:棕榈酸甲酯、硬脂酸甲酯、油酸甲酯、十七碳酸甲酯、花生酸甲酯、亚油酸甲酯和亚麻酸甲酯。其具体结果如表2所示。
2.6.2催化反应次数对生物柴油转化率的影响
通过色谱图计算生物柴油产品中总脂肪酸甲酯的含量,通过生物柴油转化率计算公式得出不同批次催化反应合成生物柴油的转化率,得出催化反应次数对生物柴油转化率的影响,结果如图9。
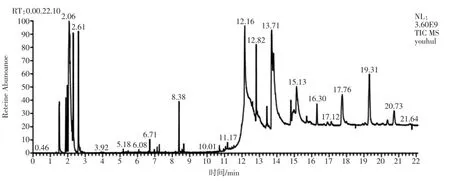
图8 脂肪酶制备生物柴油产品气相色谱图Fig.8 GC spectrum ofbiodieselp roductby lipase
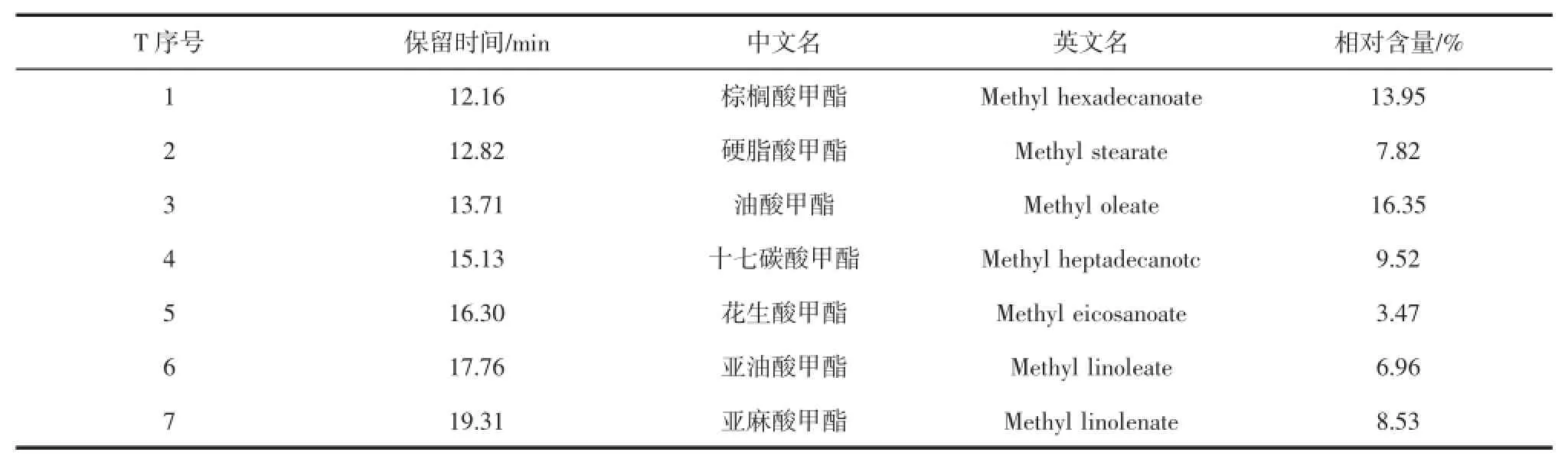
表2 生物柴油产品中脂肪酸甲酯的组成Table2 The com position of fatty acidmethylester ofbiodieselp roduct
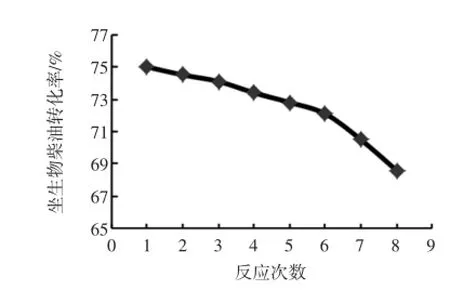
图9 反应次数对生物柴油转化率的影响Fig.9 Effectof the reaction tim esofbiodieselconversion
从图9可知,经D101型大孔树脂固定的脂肪酶催化合成生物柴油反应8次后,转化率仍保持68.6%以上,具有较高的催化活性,转化率仅降低为8.5%,操作稳定性较强。因此,脂肪酶固定化对于生物柴油的生物合成具有很大的应用潜力。
3 讨论与展望
从实验可以得出,脂肪酶固定化的最佳条件为:缓冲液pH 7.5,固定化温度应为40℃,载体/酶液比为25mg/mL,在此条件下固定化脂肪酶活力可达68.25U/mL。固定化酶的最适pH和温度分别为7和40℃,具有转化率高、催化性高和操作稳定等优点。
固定化酶法生产生物柴油一般采用以甲醇为酰基受体的醇解法[12],但高浓度甲醇易使酶失活,且副产物甘油可聚集在固定化酶载体表面,对反应产生严重的副作用,所以本研究在反应中通过分批添加甲醇及用有机溶剂、洗涤除去固定化酶表面的甘油等方法来提高甲酯产率和酶的操作稳定性。反应结束后滤出固定脂肪酶,离心并除去粗甘油,蒸馏除去有机溶剂,最后采用气质联用色谱仪检测生物柴油的成分及含量。
从本文和其他文献[13]可知,固定化后酶的稳定性有较大提高,对温度、pH、有机溶剂、抑制剂等的适应能力增强,可较长时间地保持较高的酶活性,反应结束易与产物分开,便于回收,回收后酶仍保持较大活力,可重复使用,提高了酶的利用率,同时降低了生产成本,其催化过程容易掌控,适合于自动化、连续化生产。我国土地资源资源辽阔,适合种植多种油料作物,在当前石化资源越来越少的情况下,利用植物油料开发生物柴油具有广阔的市场前景和经济价值,掌握了固定化脂肪酶合成生物柴油的关键技术,必将加快生物柴油大规模生产进程,为缓解我国燃油紧缺作出贡献。
参考文献:
[1]戴清源,朱秀灵.非水相中脂肪酶催化合成糖酯类食品添加剂的研究进展[J].食品工业科技,2012,33(10):385-389
[2]黄凌云,赵希岳,蔡志强,等.预处理固定化脂肪酶催化合成生物柴油[J].中国油脂,2007,32(7):47-50
[3]李映霞,赵凤娟,牛秋红.响应面法优化固定化脂肪酶催化棉籽油转化生物柴油的研究[J].中国油脂,2013,38(10):60-63
[4]王巍杰,杨永强,吴尚卓.脂肪酶催化合成生物柴油的研究进展[J].生物技术通报,2010(3):54-57
[5] 贾虎森.生物柴油利用概况及其在中国的发展思路[J].植物生态学报,2006,30(2):221-230
[6]Ognjanovic N,Bezbradica D,Knezevic-Jugovic Z.Enzymatic conversion of sunflower oil to biodiesel inasolvent-free system:process optim ization and the immobilized system stability[J].Bioresour Technol,2009,100(21):5146-5154.
[7]Matassoli A L,Corrüa IN,Portilho M F.Enzymatic synthesis of biodiesel via alcoholysis of palm oil[J].Appl Biochem Biotechnol, 2009,155(1/3):347-55
[8]Junfeng Liu,Li Deng,MengWang,et al.Lipase catalyzed synthesis ofmedium-chain biodiesel from cinnamonum camphora seed oil[J]. Chinese JournalofChemical Engineering,2014,22:(Z1)1215-1219
[9] 侯爱香,覃思,王远亮,等.猪油脂生物转化研究进展[J].粮油食品科技,2013,21(6):41-45
[10]刘伟东,聂开立,鲁吉珂,等.反胶束体系中脂肪酶催化合成生物柴油[J].生物工程学报,2008,24(1):142-146
[11]李丕武,刘瑜,李瑞瑞,等.两种葡萄糖氧化酶活力测定方法的比较[J].食品工业科技,2013,34(12):71-75
[12]吕亮亮,杜伟,刘德华.游离脂肪酶NS81006催化油脂醇解制备生物柴油的酶促反应动力学[J].催化学报,2012,33(11):1857-1861
[13]严祥辉,薛屏,卢冠忠.非水相中固定化脂肪酶的催化特性及其在手性化合物拆分合成中的应用[J].分子催化,2006,20(5):473-481
DOI:10.3969/j.issn.1005-6521.2015.22.041
收稿日期:2015-04-17
基金项目:四川省教育厅项目(14ZA0206);绿色催化四川省高校重点实验室项目(LYJ1304);四川理工学院科研项目(2012PY08);酿酒生物技术及应用四川省重点实验室项目(NJ2012-16);泸州老窖科研奖学金项目(13ljzk05)
作者简介:赵兴秀(1977—),女(汉),副教授,硕士,主要从事微生物研究。
Study on Lipase Immobilization and Immobilized Lipase's Application in Synthesisof Biodiesel
ZHAO Xing-xiu,HE Yi-guo,ZHAOChang-qing,FANGChun-yu,ZHANG Jing,ZOUWei
(Sichuan University of Scienceand Engineering,Zigong643000,Sichuan,China)
Abstract:It was to get the best conditions of lipase immobilization and the conversion rate of biodiesel production.The optimum conditions of lipase immobilization were obtained by single factor experiment and orthogonal test.The main components of the biodiesel were analyzed by the gas chromatograph-mass spectrometer.The optimum conditionsof lipase immobilizationwere obtained thatwas thepH ofbufferwas7.5,the ration of vector:enzyme solution was 25 mg∶1 mL,the immobilized temperature was 40℃.The immobilized enzyme activitywas68.25U/g.With immobilized lipase the conversion rate of biodiesel production wasup to 75%.The result showed that the immobilized lipase had higher catalytic efficiency and its tolerance wasmore improved tohigh-temperature and pH than the freeenzyme.The immobilized lipase had apotential for industrialproduction becauseofitshigh catalytic efficiencyand strong operationalstability.
Key words:lipase;immobilization;macroporous resin;biodiesel
