超声辅助提取海带褐藻多糖硫酸酯的工艺研究
2015-07-23戴圣佳刘振锋吕卫金张浚伟陈士国叶兴乾浙江宇翔生物科技有限公司浙江杭州0024浙江蓝色海洋生物科技有限公司浙江舟山6000浙江大学生物系统工程与食品科学学院浙江杭州0058
戴圣佳,刘振锋,2,*,吕卫金,张浚伟,陈士国,叶兴乾(.浙江宇翔生物科技有限公司,浙江杭州 0024;2.浙江蓝色海洋生物科技有限公司,浙江舟山6000;.浙江大学生物系统工程与食品科学学院,浙江杭州0058)
超声辅助提取海带褐藻多糖硫酸酯的工艺研究
戴圣佳1,刘振锋1,2,*,吕卫金1,张浚伟1,陈士国3,叶兴乾3
(1.浙江宇翔生物科技有限公司,浙江杭州 310024;2.浙江蓝色海洋生物科技有限公司,浙江舟山316000;3.浙江大学生物系统工程与食品科学学院,浙江杭州310058)
摘要:通过单因素试验和正交试验对海带褐藻多糖硫酸酯的超声辅助提取工艺进行优化。确定最佳工艺条件为超声功率250W、超声时间25min、料液比1∶70(g/mL)、温度60℃,多糖提取率达5.58%,粗多糖中岩藻糖含量20.93%,硫酸酯基含量26.87%,均高于热水法提取的多糖。热水提取方法和超声辅助提取方法所得的多糖均不含蛋白质和核酸,超声辅助提取的多糖色素更少。
关键词:海带;褐藻多糖硫酸酯;超声;正交试验
褐藻多糖硫酸酯又名褐藻糖胶、岩藻聚糖硫酸酯、岩藻聚糖等,是一类含有相当数量岩藻糖和硫酸基的水溶性杂聚糖。它是由高度支链化的α-L-岩藻糖-4-硫酸酯形成的聚合物,还伴有半乳糖、甘露糖、糖醛酸、木糖、氨基己糖等,组成和结构十分复杂,且在不同褐藻中种类及含量差异很大[1]。近年来,研究发现褐藻多糖硫酸酯具有多种生理活性,包括抗凝血、抗氧化、保护神经细胞、调节免疫、降血糖和血脂、保护肾脏、抗肿瘤及抗病毒等[2-5]。
目前,国内外提取海藻多糖主要采用稀碱、稀酸与热水抽提的方法。这些方法工艺简单、操作方便、成本低,但是也存在着提取率较低、活性损失大、过滤纯化困难等缺点,大大限制了海藻多糖大规模工业化生产。近年来,微波辅助提取、超声辅助提取与酶解辅助提取等新提取技术的发展[6-8],使得对海藻多糖的深入研究成为可能。
本试验主要研究了超声辅助提取技术对海带褐藻多糖硫酸酯提取率的影响,通过正交设计法优化提取工艺以获得相关参数,并对多糖的部分理化性质进行了研究,以期为深度开发海带资源提供技术参考。
1 材料与方法
1.1材料与试剂
海带:购于杭州世纪联华超市。将海带洗净晒干粉碎后过60目筛,获得海带干粉,置干燥器中以备后续处理。
L-岩藻糖(Sigma);葡萄糖、浓硫酸、苯酚、明胶、氯化钡、硫酸钾、三氯乙酸、无水乙醇、L-半胱氨酸盐酸盐、95%乙醇、浓盐酸等均为分析纯。
1.2仪器与设备
JY88-II超声波细胞粉碎机:宁波新芝科器研究所;HH2型数显恒温水浴锅:国华电器有限公司;RE-52型旋转蒸发仪:上海嘉鹏科技有限公司;紫外可见分光光度计UV-2550:日本SHIMADZU公司;FD1.0-60型冷冻干燥机:丹麦Heto公司;台式冷冻高速离心机:美国Thermo Scientific公司。
1.3方法
1.3.1样品制备
参考刘旭等[9]的方法并稍作修改。取海带干粉4g,在不同条件下超声辅助提取,离心后取上清液抽滤,滤液浓缩,加95%乙醇至其体积分数为30%,静置1 h,离心去除褐藻胶,上清液加入95%乙醇至其体积分数为70%,离心收集沉淀并用无水乙醇、丙酮洗涤,冷冻干燥即得褐藻多糖硫酸酯粗品。
1.3.2多糖含量的测定
多糖含量的测定采用苯酚-硫酸法[10]。以葡萄糖为标准单糖制作标准曲线。在490 nm处测定吸光度,以糖质量浓度为横坐标,光密度值为纵坐标,得到回归方程为Y=0.043 3X+0.006,R2=0.996 2。多糖提取率按下式计算。
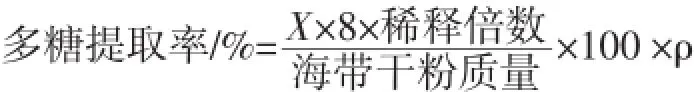
式中:X为在Y吸光度下根据回归方程计算所得的值;ρ为校正系数,以葡萄糖作标准曲线,ρ=0.9。
1.3.3岩藻糖含量的测定
岩藻糖含量的测定采用半胱氨酸盐酸盐法[11]。以L-岩藻糖为标准糖绘制标准曲线,得到回归方程为Y=0.001 8X+0.001 6,R2=0.997 2,通过标准曲线方程计算其岩藻糖含量。
1.3.4硫酸酯基含量的测定
硫酸酯基含量的测定采用明胶-氯化钡法[10]。以标准的硫酸酯基溶液做标准曲线,得到的回归方程为Y=12.769X+0.031 4(R2=0.992 7),其中以硫酸酯基质量浓度为横坐标,吸光度为纵坐标。
样品含量测定:取一定量样品,加1mol/LHCl配成1.5mg/mL的溶液,在100℃水浴锅中水解2 h,取出冷却至室温,取0.6m L按标准品方法测其吸光度,通过标准曲线方程计算其硫酸酯基含量。
1.3.5单因素试验
以超声功率、料液比、时间和温度为4个单因素,按表1进行试验。

表1 褐藻多糖硫酸酯提取的单因素试验Table 1 Single factor test for theextraction of fucoidan
1.3.6正交试验
整合单因素试验的结果,用正交试验进行条件优化。以多糖提取率、粗多糖中岩藻糖含量、硫酸酯基含量为指标,采用L9(34)正交试验对海带干粉多糖进行超声辅助提取试验。
1.3.7蛋白质与核酸的检验
取多糖样品溶液在紫外分光光度计上扫描200nm~400 nm波长范围内的吸收曲线。观察多糖样品的吸收曲线在280 nm和260 nm波长条件下有无吸收峰,确定样品中是否含有蛋白质或核酸。
1.3.8超声波辅助提取法与热水提取法[12]的比较
取一定量的海带干粉,按1.3.6节优化后的提取条件和热水法分别提取,所得粗多糖按1.3.2节、1.3.3节和1.3.4节的方法,分别测定多糖含量、岩藻糖含量和硫酸酯基含量,并对各种指标进行比较。
1.3.9数据处理
采用Origin 8.0制图,采用SPSS 18.0对数据进行方差分析、显著性检验,显著性水平设置为P<0.05,图中不同字母(a、b、c)表示不同水平间存在显著差异。
2 结果与分析
2.1超声辅助提取多糖的单因素试验
2.1.1料液比对多糖提取率的影响
料液比对多糖提取率的影响试验结果见图1。
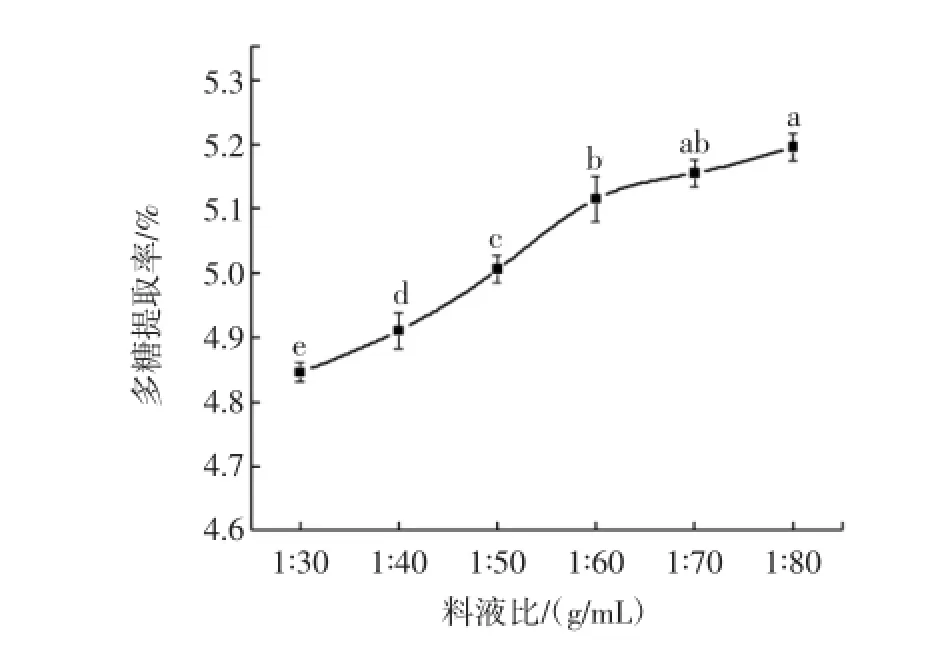
图1 料液比对多糖提取率的影响Fig.1 Effect of solid/liquid ratio on theextraction of fucoidan
从图1可以看出,超声辅助提取多糖的提取率随着料液比增加而不断提高,从最初料液比为1∶30(g/mL)时的4.84%上升到最后料液比为1∶80(g/mL)时的5.20%。这可能是由于超声波能有效地将细胞壁破碎,溶出有效成分,然而同时也溶出了大量的黏性液质,不利于传质扩散[13],而增大料液比,提高溶剂的比例,可以有效地降低提取液的黏度,从而有利于多糖的提取。但在实际操作过程中,溶液体积过大不利于后续的浓缩和醇沉实验,同时也会增加生产成本,因此根据试验条件选取合适的料液比,设定正交表中料液比的3个水平为1∶60、1∶70、1∶80(g/mL)。
2.1.2超声功率对多糖提取率的影响
超声功率对多糖提取率的影响试验结果见图2。

图2 超声功率对多糖提取率的影响Fig.2 Effectof ultrasonic power on the extraction of fucoidan
从图2可以看出,超声功率对多糖提取率有显著的影响。超声辅助提取技术利用超声波具有的强烈震动、强烈空化效应以及高速搅拌作用,使植物细胞内的有效物质快速进入溶剂[14],而超声功率决定了超声波与介质相互作用的程度,从而影响有效成分的提取率。结果所示,多糖提取率从超声功率为100W时的4.24%迅速增加,并在超声功率为250W时达到最大的5.16%,提高21.7%,之后呈下降趋势。这可能是由于超声作用进一步增强,使提取液流动加速,从而物料停留在超声场中的时间减少,破壁作用减弱,多糖溶出速率减缓;另一个原因可能是超声功率过大会引起部分多糖的降解。故根据试验条件,设定正交表中超声功率的3个水平为200、250、300W。
2.1.3超声时间对多糖提取率的影响
超声时间对多糖提取率的影响试验结果见图3。
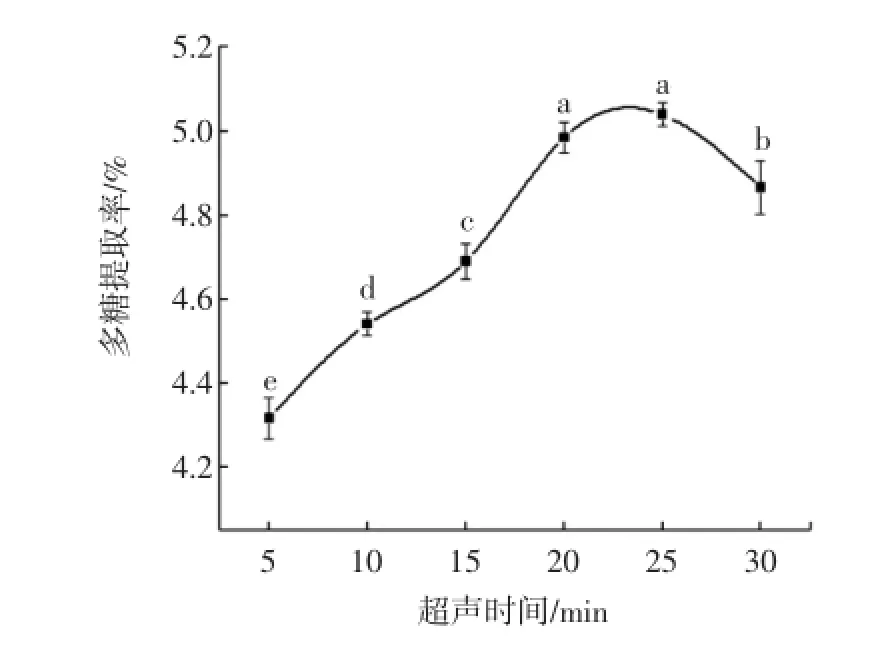
图3 超声时间对多糖提取率的影响Fig.3 Effect of ultrasonic tim eon theextraction of fucoidan
从图3可以看出,多糖提取率和超声时间之间紧密相关。超声5min时,提取率为4.31%,之后随着超声时间延长而显著上升,在超声25min时达到最大为5.04%,提高16.94%,随后有所下降。由于褐藻多糖硫酸酯主要存在于细胞间和细胞壁中,超声能在短时间内破碎细胞,使其释放出来。当超声处理时间太短时,还不足以破碎细胞释放多糖;而时间太长,超声波的机械剪切作用会使多糖降解,破坏多糖结构[15],同时还会导致细胞内大量不溶物及黏液质等溶出,从而增大了传质阻力,影响了有效成分的提取。故根据试验条件,设定正交表中超声时间的3个水平为20、25、30min。2.1.4温度对多糖提取率的影响
温度对多糖提取率的影响试验结果见图4。
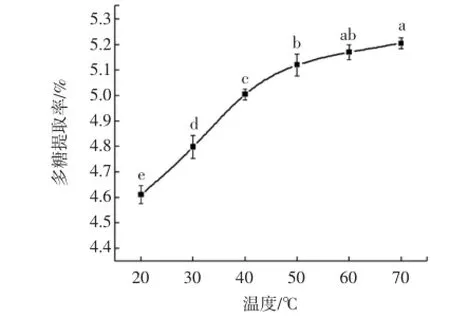
图4 温度对多糖提取率的影响Fig.4 Effectof tem peratureon the extraction of fucoidan
温度是影响多糖提取率的重要因素之一,温度过低,不利于有效成分的溶出;温度过高则可能会使多糖发生降解或者失去活性。温度对多糖提取率的影响变化趋势如图4所示。从图中可以看出,多糖提取率随着温度的上升而不断提高。当温度为20℃~50℃时,多糖提取率上升速度较快,从4.61%提高至5.16%,之后在温度为50℃~70℃时,多糖提取率保持缓慢增加。为保证较高的多糖提取率,同时避免因温度过高而引起多糖失活或发生降解,设定正交表中提取温度的3个水平为50、60、70℃。
2.2超声辅助提取多糖的正交试验
在单因素试验的基础上,选定超声功率、超声时间、料液比、温度4因素进行正交试验,因素水平设计见表2。褐藻多糖硫酸酯的化学组成以L-岩藻糖和硫酸酯基为主,且其生物活性与硫酸酯基的含量呈正相关[13],因此,选择以多糖提取率、岩藻糖含量和硫酸酯基含量作为优化指标。试验结果见表3。
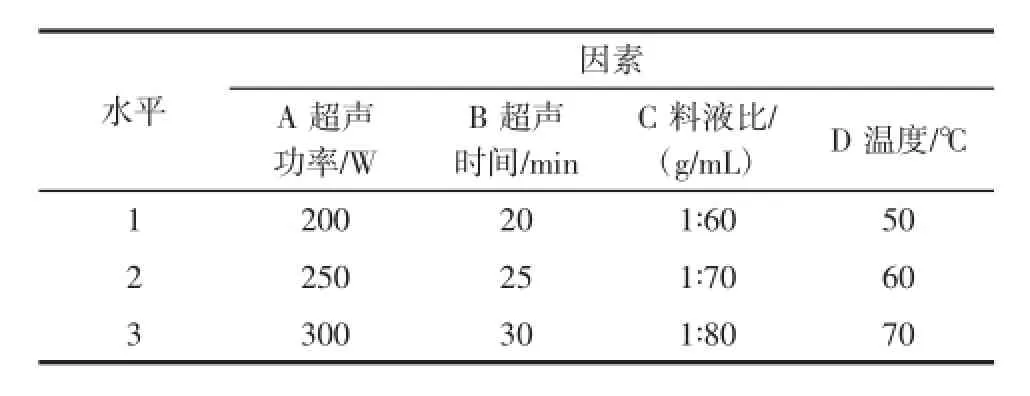
表2 正交试验因素及水平设计Table2 Factorsand levelsin orthogonalarray design

表3 超声辅助提取褐藻多糖硫酸酯正交试验结果Table3 O r thogonalarray designmatrix and cor responding results
由表3极差分析结果可以看出,以多糖提取率为指标的因素影响程度依次为:A、B、D、C,即超声功率>超声时间>温度>料液比,最佳组合为:A2B2C3D2;以粗多糖中岩藻糖含量为指标的因素影响程度依次为:A>B>C>D,即超声功率>超声时间>料液比>温度,最佳组合为:A2B1C2D3;以硫酸酯基含量为指标的因素影响程度依次为:A>D>C>B,即超声功率>温度>料液比>超声时间,最佳组合为:A2B2C2D2。
3个指标单独分析出来的最佳组合条件并不一致,所以需要根据因素对3个指标的影响程度综合考虑,确定最优工艺条件。超声功率对3个指标的影响都是第一位,且都是A2,因此超声功率就选择250W;超声时间对指标的影响有两个第二位,所以考虑B1和B2,但取B2可以获得更高的多糖提取率和硫酸酯基含量,所以超声时间选择25min;料液比对指标的影响有两个第三位,且都是C2,故料液比选择1∶70(g/mL);温度对硫酸酯基含量的影响排第二位,对多糖提取率的影响排第三位,并且都是取D2较好,所以温度选择60℃。经过综合分析可知,本试验的最优条件为A2B2C2D2,即超声功率250W、超声时间25min、料液比1∶70(g/mL)、温度60℃。
2.3超声辅助提取法与热水提取法的比较
根据正交试验所得的超声辅助提取最优工艺条件与热水法提取褐藻多糖硫酸酯的对比结果见表4。
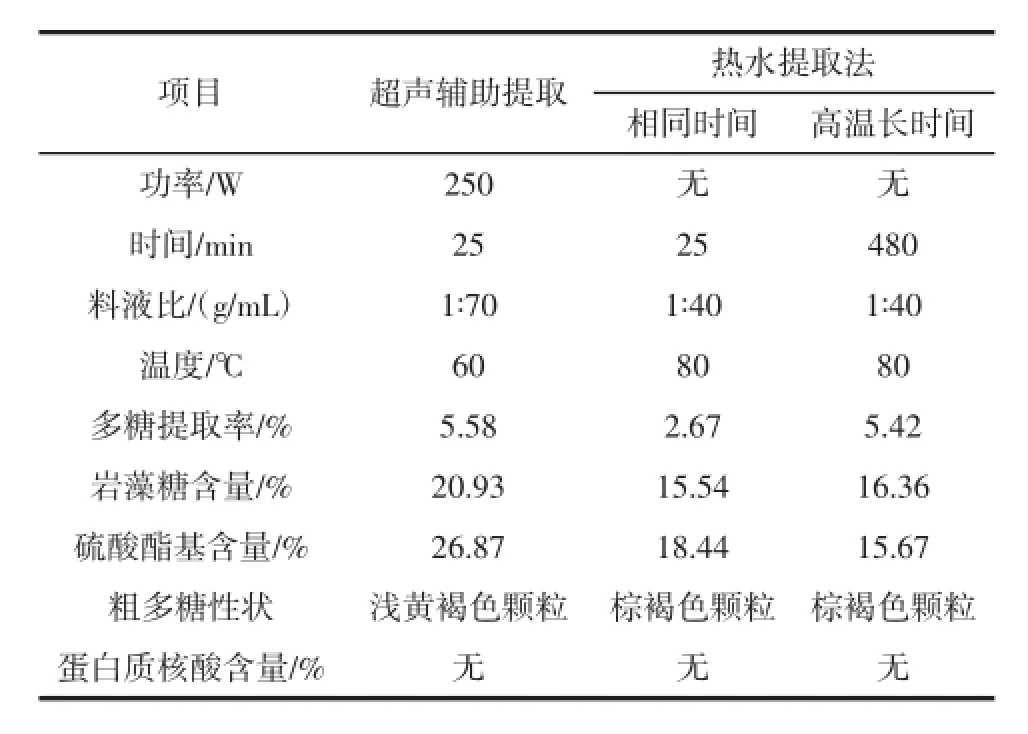
表4 超声辅助提取法和热水提取法的比较Table 4 Com parison between thism ethod and hotwater extractionmethod
由表4可知,超声辅助法的多糖提取率为5.58%,与刘群等[16]测得的结果(5.641%)非常接近,与高温长时间的热水提取相当,而明显优于相同时间下热水法的多糖提取率。超声辅助提取的岩藻糖含量为20.93%,与尤瑜敏等[17]测得的结果(19.56%)相近,而硫酸酯基含量为26.87%,高于王健等[18]测得的21.49%,但低于刘旭等[19]测得的37.14%。但是,两者均显著高于热水法提取,尤其是高温长时间提取获得的粗多糖中硫酸酯基含量最低,这可能是由于较高的温度会在一定程度上破坏多糖分子结构,降低其硫酸酯基含量。
结果表明,超声辅助提取工艺所需时间短、温度较低,能够增加多糖提取率并保持其生物活性,另外,两种方法提取的多糖均不含蛋白质或核酸。超声辅助提取获得的多糖产品颜色也较浅,说明超声辅助提取法能有效减少色素的析出,有利于简化除色素等预处理步骤。可以看出,超声波辅助提取法是一种良好的多糖提取新工艺。
3 结论
通过单因素试验,初步考察了超声辅助提取海带褐藻多糖硫酸酯工艺中超声功率、超声时间、料液比、温度对多糖提取率的影响,确定了正交试验方案并进行条件优化。经极差分析,多重比较,得出海带褐藻多糖硫酸酯的最佳提取条件为:超声功率250W、超声时间25min、料液比1∶70(g/mL)、温度60℃。在此工艺条件下获得多糖样品,多糖提取率为5.58%,粗多糖中岩藻糖含量为20.93%,硫酸酯基含量为26.87%,均显著高于热水法提取。超声辅助提取工艺能够增加多糖提取率并保持其生物活性,还能减少色素、蛋白质等其他物质的溶出,有利于后续的分离纯化过程,为海带的高价值化应用提供了理论参考。
参考文献:
[1]Jiang ZD,Okimura T,Yokose T,et al.Effects of sulfated fucan,ascophyllan,from the brown Alga Ascophyllum nodosum on various cell lines:A comparative study on ascophyllan and fucoidan[J]. Journalofbioscienceand bioengineering,2010,110(1):113-117
[2]王凌,孙利芹,周妍.小球藻多糖体外免疫调节活性研究[J].食品研究与开发,2013,34(7):30-32
[3]Hyun JH,Kim SC,Kang JI,etal.Apoptosis Inducingactivityof fucoidan in HCT-15 colon carcinoma cells[J].Biological&pharmaceuticalbulletin,2009,32(10):1760-1764
[4]冯珍鸽,王力,吴永沛,等.褐藻中岩藻聚糖的化学成分及其对超氧离子的抑制作用[J].食品研究与开发,2010,31(3):66-68
[5]Veena C K,Josephine A,Preetha S P,et al.Renal peroxidative changesmediated by oxalate:the protective role of fucoidan[J].Life sciences,2006,79(19):1789-1795
[6]Zhong K,Lin W J,WangQ,etal.Extraction and radicalsscavenging activity of polysaccharides with microwave extraction from mung bean hulls[J].International journal of biological macromolecules, 2012,51(4):612-617
[7]Hahn T,Lang S,Ulber R,etal.Novelprocedures for the extraction of fucoidan from brown algae[J].Process Biochemistry,2012,47(12): 1691-1698
[8]王晓林,钟方丽,杨蕾.微波法辅助提取玉竹多糖的工艺[J].食品研究与开发,2012,33(3):46-50
[9]刘旭,曲桂燕,周裔彬,等.海带废渣中提取岩藻聚糖硫酸酯的工艺研究[J].海洋科学,2012,36(12):25-30
[10]张惟杰.复合多糖生化研究技术[M].上海:上海科学技术出版社,1987
[11]GibbonsM N.Thedetermination ofmethylpentoses[J].Analyst,1955, 80(949):268-276
[12]丁晓萍,谢玲,颜秀花.海带中提取岩藻多糖[J].广州化工,2012, 40(16):82-83
[13]王永良,范贤,李玉兰,等.超声辅助提取异枝麒麟菜硫酸酯多糖的工艺优化[J].食品科学,2010,31(6):6-10
[14]张昌军,原方圆,邵红兵.超声波法在提取多糖类化合物中的应用研究[J].化工时刊,2007,21(2):54-56
[15]廖建民,张瑾,沈子龙.超声波法提取海带多糖的研究[J].药物生物技术,2002,9(3):157-160
[16]刘群,徐中平.海带硫酸酯多糖的酶法提取工艺条件[J].河北渔业,2007(6):55-57
[17]尤瑜敏,许时婴.羊栖菜中褐藻糖胶的提取工艺[J].无锡轻工大学学报,2002,21(3):233-238
[18]王健,吴永沛,于立国.超滤制备海带岩藻聚糖的工艺研究[J].食品工业科技,2012,33(19):210-213
[19]刘旭,曲桂燕,周裔彬.海带废渣中提取岩藻聚糖硫酸酯的工艺研究[J].海洋科学,2012,36(12):25-31
DOI:10.3969/j.issn.1005-6521.2015.22.007
收稿日期:2014-04-22
基金项目:杭州市“雏鹰计划”(20131131k132);杭州市科研攻关专项(20140432B72);国家自然科学基金(31301417)
作者简介:戴圣佳(1984—),男(汉),本科,研究方向:海洋生物资源开发与利用。
*通信作者:刘振锋(1980—),男(汉),高级工程师,博士,研究方向:海洋生物资源开发与利用。
Ultrasonic-assisted Extraction of Fucoidan from Laminaria japonica
DAISheng-jia1,LIU Zhen-feng1,2,*,LÜWei-jin1,ZHANG Jun-wei1,CHENShi-guo3,YEXing-qian3
(1.Zhejiang Yuxiang Biotech Co.Ltd.,Hangzhou 310024,Zhejiang,China;2.Zhejiang Bluemarine Biotech Co.Ltd.,Zhoushan 316000,Zhejiang,China;3.Schoolof BiosystemsEngineeringand Food Science,ZhejiangUniversity,Hangzhou 310058,Zhejiang,China)
Abstract:One-factor-at-a-time and orthogonalarraymethodswere used to investigate the optimalultrasonicassisted extraction processof fucoidan from Laminaria japonica in thiswork.The optimum extraction conditions wereultrasonic treatmentpowerof250W,ultrasonic treatmenttimeof25min,material/liquid ratioof1∶70(g/mL)and extraction temperature of60℃.Under thisoptimum condition the extraction rate,the contentsof fucose and sulfate group were 5.58%,20.93%and 26.87%,respectively,higher than obtained by hotwater extraction. Neither protein nornucleic acid was found in fucoidan obtained using hotwaterextraction or ultrosonic-assisted extraction method,and less pigment was found in fucoidan obtained using ultrosonic-assisted extraction method.
Keywords:Laminaria japonica;fucoidan;ultrasonic;orthogonalarray design
