骨桥蛋白表达与结直肠癌临床病理特征及预后的关系
2015-07-21尹鹏飞常家聪
尹鹏飞,常家聪
骨桥蛋白表达与结直肠癌临床病理特征及预后的关系
尹鹏飞,常家聪
摘要目的探讨骨桥蛋白(OPN)在结直肠癌组织中的表达与临床病理特征及预后的关系。方法应用免疫组化SP法测定112例结直肠癌患者癌组织及癌旁正常组织中OPN表达水平,分析OPN表达与结直肠癌患者临床病理特征及预后的关系。结果结直肠癌组织中OPN阳性表达率明显高于相应癌旁正常组织,差异有统计学意义(P<0.05),其表达水平与肿瘤直径、分化程度、TNM分期、原发肿瘤浸润深度相关;OPN阳性表达组的无病生存时间和总体生存时间均短于阴性表达组,差异有统计学意义(P<0.05)。OPN的阳性表达是结直肠癌患者预后的独立影响因素。结论结直肠癌患者癌组织中OPN呈高表达,OPN在组织中的高表达与患者的早期复发及不良预后密切相关。
关键词结直肠癌;骨桥蛋白;免疫组织化学;预后
结直肠癌是全世界最常见的恶性肿瘤之一,严重威胁人类的生命健康,统计数据显示其发病率已升至所有恶性肿瘤的第3位[1],死亡率也不断增高。结直肠癌患者早期缺乏特异性的表现,很多患者确诊时已属中晚期,5年生存率不足40%。肿瘤的侵袭转移成为影响预后的主要因素之一,恶性肿瘤发生侵袭和转移包括基质的降解、细胞迁移、血管生成等很多变化,骨桥蛋白(osteopontin,OPN)是一种与肿瘤有关的蛋白质,在结直肠癌的发生发展中有着重要的作用。该实验应用免疫组织化学法检测结直肠癌组织中OPN的表达,探讨其与结直肠癌患者各临床病理特征之间的关系以及对预后的影响。
1 材料与方法
1.1病例资料
收集安徽医科大学第一附属医院普外科2008年3月~2009年4月经手术治疗的112例结直肠癌患者的癌组织及距离癌组织边缘5 cm以上相应的正常癌旁组织标本,癌组织均经术后病理检查确诊。所有患者术前未接受化疗、放疗等其他治疗。手术后电话或者门诊随访,并记录随访资料,所有纳入患者的末次随访时间截至2014年5 月1日。
2015-05-14接收
1.2主要试剂
浓缩型鼠抗人OPN单克隆抗体购于北京博奥森公司;通用型免疫组化试剂盒、PBS缓冲液、DAB显色剂等均购自北京中杉金桥生物技术公司。
1.3方法
采用免疫组化SP法检测结直肠癌组织中OPN的表达,所有标本经过石蜡包埋,4μm厚连续切片。操作步骤按照免疫组化试剂盒说明书进行。用已知阳性结直肠癌组织切片作为阳性对照,PBS缓冲液代替一抗作为阴性对照。
1.4免疫组化结果判定
根据组织切片着色范围和强度表示结果,在高倍镜下,每张切片选择5个具有代表性的视野,每个视野计数100个癌细胞,一共计数500个细胞。采用半定量计分法判定:OPN主要定位于细胞质,呈现黄色或棕黄色颗粒为阳性细胞。按阳性着色程度评分:0分为无着色;1分为浅黄色;2分为棕黄色;3分为棕褐色。按阳性细胞占比例评分:0分为<5%、1分为5%~10%、2分为11%~50%、3分为 51% ~80%、4分为>80%,两者乘积判断阳性结果:0分为阴性(-);1~4分为弱阳性(+);5~8分为中度阳性(++);9~12分为强阳性(+++)。将(++)~(+++)定义为OPN蛋白阳性表达组,(-)~(+)定义为OPN蛋白阴性表达组。
1.5统计学处理使用SPSS 19.0软件进行分析,针对结直肠癌组织与癌旁正常组织中OPN表达阳性率的比较以及OPN表达与结直肠癌患者临床病理特征之间的关系采用X2检验。生存分析使用Kaplan-Meier曲线法,两组间差异采用Log-rank检验。应用COX比例风险回归模型进行多因素分析以确定影响结直肠癌患者生存率的独立预后因素;所有检验为双侧概率检验。
2 结果
2.1OPN在结直肠癌组织及癌旁组织中的表达水平
OPN在结直肠癌组织及癌旁正常组织中有不同程度的阳性表达,结直肠癌组织中OPN阳性表达65例,阳性表达率为58.0%(65/112);癌旁正常组织OPN阳性表达11例,阳性表达率为9.80%(11/112)。结直肠癌组织中OPN阳性表达率明显高于癌旁正常组织,两组差异有统计学意义(X2=58.07,P<0.05)。见图1。
2.2结直肠癌织中OPN表达与临床病理参数的关系
结直肠癌患者的组织中OPN阳性表达率与肿瘤直径、TNM分期、肿瘤的分化程度、原发肿瘤浸润深度相关(P<0.05),而与性别、年龄、肿瘤部位、淋巴结转移无关。见表1。
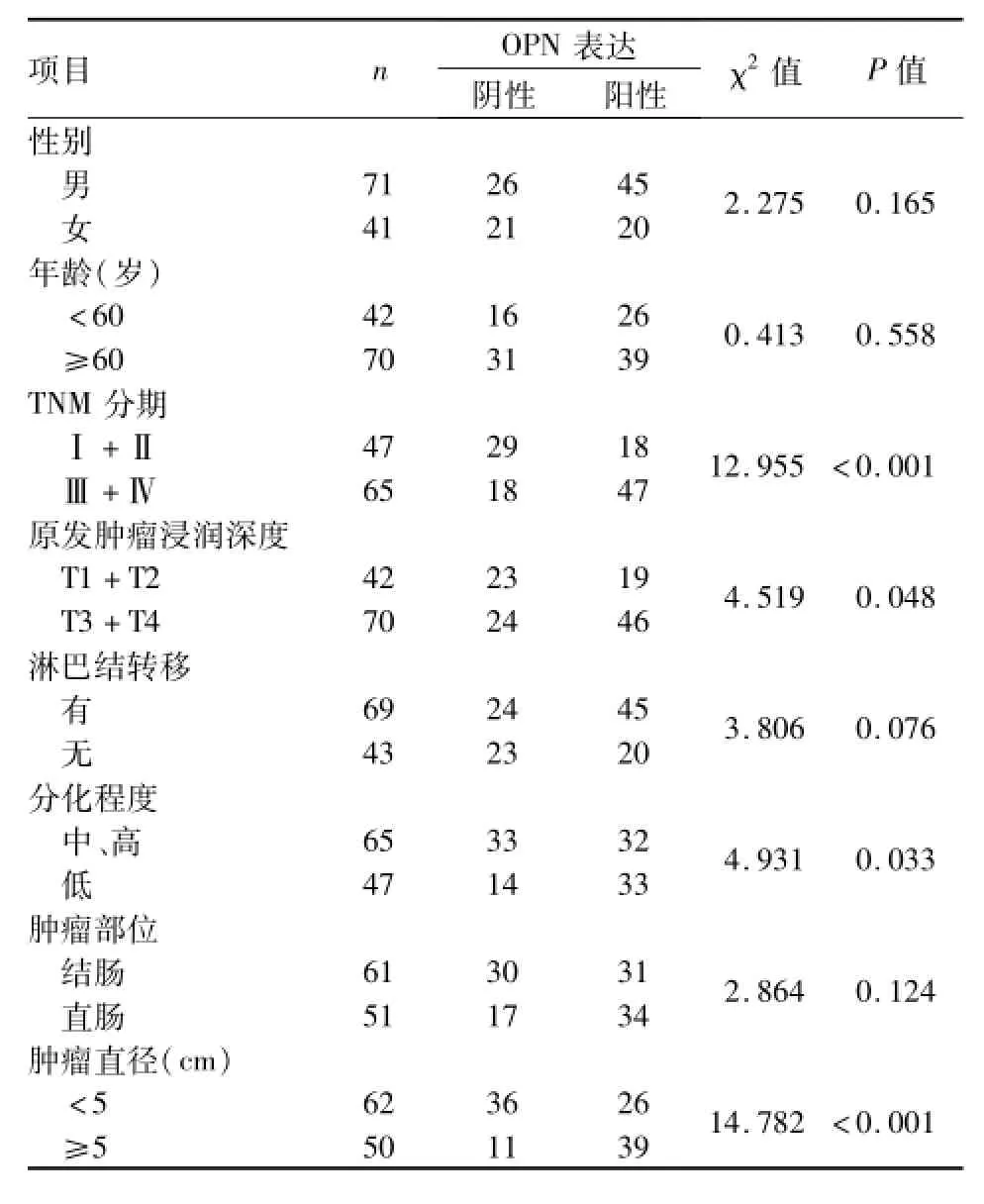
表1 OPN阳性表达与结直肠癌患者临床病理参数的关系(n)
2.3OPN蛋白表达与结直肠癌患者生存预后的分析
截至2014年5月随访结束时,112例结直肠癌患者获得完整的随访资料,随访时间为4~69个月,中位随访时间为38个月;随访期间72例患者死亡,5年累积生存率为36.1%。应用Kaplan-Meier方法分析OPN蛋白在组织中的表达水平与结直肠癌患者预后之间的相关性。结果显示,OPN蛋白阳性表达组的结直肠癌患者的中位生存期为18.6个月,OPN蛋白阴性表达组的患者中位生存期为47.9个月。OPN阴性表达组患者的生存时间明显高于OPN阳性表达组,Log-rank检验提示,两组患者的无病生存期和总体生存期差异有统计学意义(Logrank=12.666、13.250,P<0.001),表明OPN蛋白阳性表达组的结直肠癌患者无病生存期和总体生存期明显比OPN蛋白阴性表达组的结直肠癌患者的无病生存期和总体生存期短。见图2。
2.4结直肠癌患者术后生存时间的多因素回归分析
将性别、年龄、肿瘤大小、淋巴结转移TNM分期、肿瘤分化程度和OPN表达(阴性表达和阳性表达)等因素引入COX模型进行分析。结果显示,OPN表达阳性与原发肿瘤直径是影响结直肠癌患者无病生存期的独立影响因素(P<0.05)。其中OPN表达和原发肿瘤直径的回归系数均为正,表明OPN表达阳性和肿瘤直径大于5 cm的结直肠癌患者术后无病生存时间短;同时,OPN表达阳性、TNM分期和原发肿瘤直径是影响结直肠癌患者总体生存期的独立影响因素,其中OPN表达、TNM分期和原发肿瘤直径的回归系数均为正,表明OPN表达阳性、TNM分期为Ⅲ、Ⅳ期和肿瘤直径大于5 cm的结直肠癌患者术后总体生存时间短。见表2。

表2 无病生存率和总体生存率的单因素及多因素COX比例风险回归分析
3 讨论
OPN是由Senger et al[2]从恶性转化的上皮细胞株中提取出来的,研究[3]表明,OPN在人类恶性肿瘤组织中过度表达,与肿瘤分期密切相关,参与肿瘤的发生发展,但确切的致癌机制尚不明确,可能通过促进肿瘤细胞的黏附、转移[4]以及通过促进肿瘤细胞增殖、抑制肿瘤细胞的凋亡[5]、促进肿瘤血管形成[6]等多种途径促进恶性肿瘤的发生发展。研究[7]显示抑制OPN的表达能够减缓肿瘤的生长及侵犯进程。研究[8]表明,OPN的过度表达与乳腺癌、胃癌、前列腺癌等肿瘤的恶性程度侵袭、转移、复发有关。
本研究显示结直肠癌组织中OPN阳性表达率明显高于癌旁正常组织,提示高表达的OPN可能与结直肠癌发生发展关系密切。本研究探讨了OPN的表达与结直肠癌生物学特性之间的关系,结直肠癌组织OPN的表达水平在TNM分期Ⅲ/Ⅳ期明显高于Ⅰ/Ⅱ期,这表明OPN的水平随着结直肠肿瘤进展而表达逐渐增强;因此可以对组织进行检测OPN水平来判断和评估结直肠癌的侵袭程度、转移情况,与研究[9]结果相似。OPN的表达还与结直肠癌的原发肿瘤直径明显相关,提示OPN不仅参与了肿瘤的浸润、转移,也可能参与了肿瘤的发生。研究[10]显示OPN不仅能通过与整合素受体结合而且能与CD44家族受体相结合,从而促进了肿瘤细胞的趋化、黏附、转移;由上表明高表达的OPN可能成为判断结直肠癌侵袭转移程度的一个指标,研究[11]显示,缺失OPN的模型小鼠形成肺内转移性结节明显减少,因此研究新型的以OPN为基础的抗肿瘤治疗可能为结直肠癌的治疗提供新的分子靶向途径。
本研究的创新之处在于通过对112例有完整随访资料的结直肠癌患者术后生存时间进行分析,结果显示OPN阳性表达组的无病生存时间和总体生存时间均短于OPN阴性表达组。应用COX比例风险模型多因素生存分析,显示OPN阳性表达是结直肠癌患者术后无病生存率和总体生存率的独立影响因素,有可能成为判断和评估结直肠患者预后的一种新的生物学指标。
参考文献
[1]Steward BW,Kleihues P.Word Cancer Report[M].Lyon:IARC Press,2003:198-202.
[2]Senger D R,Wirth D F,Hynes R O.Transformed mammaliam cells secrete specific protein and phosphoproteins[J].Cell,1979,16(4):885-93.
[3]Coppola D,Szabo M,Boulware D,et al.Correlation of osteopontin protein expression and pathological stage across a wide variety of tumor histologies.[J].Clin Cancer Res,2004,10(1 Pt1):184- 90.
[4]Samant R S,Clark DW,Fillmore R A,et al.Breast cancermetastasis suppressor 1(BRMS1)inhibits osteopontin transcription by abrogating NF-kappaB activation[J].Mol Cancer,2007,6:6.
[5]Courter D,Gao H,Kmok S,et al.The RGD domain of human osteopontin promotes tumor growth and metastasis through activation of survival pathways[J].PLoSOne,2010,5(3):e9633.
[6]Dai J,Peng L,Fan K,et al.Osteopontin induces angiogenesis through activation of PI3K/AKT and ERK1/2 in endothelial cells [J].Oncogene,2009,28(38):3412-22.
[7]LiKuiW,HongW,Shuwen Z.Clinical significance of the upregulated osteopontin mRNA expression in human colorectal cancer [J].JGastrointest Surg,2010,14(1):74-81.
[8]Guarino V,Faviana P,Salvatore G,et al.Osteopontin is overexpressed in human papillary thyroid carcinomas and enhances thyroid carcinoma cell Invasiveness[J].J Clin Endocrinol Metab,2005,90(9):5270-8.
[9]王庆娜,朱海杭,刘军.结肠癌中骨桥蛋白与环氧化酶-2的表达及临床意义[J].胃肠病学和肝病学杂志,2012,21(2):137-9.
[10]Tuck A B,ArsenaultD M,O′Malley F P,et al.Osteopontin induces increased invasiveness and plasminogen activator expression of humanmammary epithelial cells[J].Oncogene,1999,18(29):4237 -46.
[11]Nemoto H,Rittling SR,Yoshitake H,et al.Osteopontin deficiency reduces experimental tumor cellmetastasis to bone and soft tissues [J].JBone Miner Res,2001,16(4):652-9.
中图分类号R 735.2
文献标志码A
文章编号1000-1492(2015)10-1493-04
基金项目:安徽省卫生厅医学科研资助项目(编号:09A034)
作者单位:安徽医科大学第一附属医院普外科,合肥230022
作者简介:尹鹏飞,男,硕士研究生;常家聪,男,教授,主任医师,硕士生导师,责任作者,E-mail:changjiacong13@aliyun.com
Expression of osteopontin in colorectal cancer with clinical pathological characteristics and prognosis
Yin Pengfei,Chang Jiacong
(Dept of General Surgery,The First Affiliated Hospital of Anhui Medical University,Hefei230022)
AbstractObjectiveTo investigate the relationship between the osteopontin(OPN)expression of colorectal cancer tissueswith the clinical characteristics and prognosis.MethodsThe expressions of OPN in colorectal cancer tissues and their corresponding para-cancerous tissues from 112 cases of colorectal cancer patientswere detccted by immunohistochemistry.The relationship between the expressions ofOPN and the clinicopathological features in paitientswith colorectal cancer were analyzed.ResultsThe OPN expression of colorectal cancer tissues was significantly higher than their corresponding adjacent normal tissues,the difference was statistically significant(P<0.05).Its expression was significantly associated with tumor size,histological differentiation,TNM stage,tumor status.Disease-free survival,and overall survival time of OPN protein positive expression group were lower than thatof the negative group,respectively,the differenceswere statistically significant(P<0.05).The expression of OPN in colorectal cancer tissueswas an independent prognostic factor.ConclusionThe expression of OPN is significantly increased in colorectal cancer tissues,and the positive expression of OPN is associated with the prognostic of patientswith colorectal cancer.
Key wordscolorectal cancer;osteopontin;immunohistochemistry;prognostic
