维持人胚胎干细胞多能性顺式作用元件的筛选
2021-05-12孙梦瑶刘思琪周凡琦马艳妮
孙梦瑶,刘思琪,周凡琦,马艳妮,余 佳
(中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室, 北京 100005)
人胚胎干细胞(human embryonic stem cells,hESCs)是一类源于人囊胚内细胞团,经过体外分离纯化及培养,所得到的稳定的多能干细胞,可在适当的条件下分化形成体内各种类型的细胞,因具有潜在的再生医学应用前景而被广泛研究[1]。多能性是hESCs的重要特征之一,以OCT4、NANOG、SOX2等为代表的一系列转录因子,在维持hESCs多能性上发挥着至关重要的作用[2]。目前,对于参与维持多能性基因表达的顺式作用元件及染色质高级构象,仍不是十分清楚。例如,哪些增强子与绝缘子通过发挥顺式作用影响hESCs的多能性等,因此有待进一步研究和揭示。
成族规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)基因编辑技术为实现大规模的基因功能筛选提供良好的解决方案,通过构建CRISPR文库,感染目的细胞,以细胞某种表型变化作为检测和筛选手段,分离得到具有特殊表型的细胞,测序得到其中的基因敲除信息[3-5]。由于CRISPR关联因子(CRISPR associated, Cas)9,也叫“Cas9蛋白”的持续性表达可能会对hESC的多能性产生影响[6],因此首先构建了诱导型的Cas9稳定表达株,再通过感染CRISPR文库,以OCT4的表达水平作为多能性的衡量标准,通过流式分析,发现存在基因敲除后多能性下降的hESC群体。通过成功创建该种方法,可以获得影响hESC多能性的顺式作用元件的信息,为进行下一步的功能与机制研究做好铺垫。
1 材料与方法
1.1 材料
hESC(中国医学科学院血液病医院石莉红课题组)。hESC培养试剂:mTesR1培养基、RelesR、accutase和dispase(Stem Cell公司);Matrigel(Corning公司)。HEK293T细胞培养试剂:DMEM培养基(Corning公司);胎牛血清(Gibco公司);pcw-Cas9质粒(Addgene公司);流式抗体:human-anti OCT4 流式抗体和human-anti SSEA4流式抗体(BD公司)。药物:强力霉素(doxcycline,DOX,TaKaRa公司);嘌呤霉素(puromycin,puro)和杀稻瘟菌素(blasticidin,BSD,Thermo Fisher Scientific公司)。
1.2 方法
1.2.1 培养hESCs细胞:使用mTesR1培养基培养hESC,一般培养于matrigel包被的6孔板上,每孔使用500 μL RelesR按1∶6~1∶10比例进行传代,每4~7 d传代1次。
1.2.2 诱导型Cas9稳定表达株的获取:将pcw Cas9质粒转染HEK293T细胞进行病毒包装,高速离心收集病毒沉淀。使用病毒感染hESC,48 h后puro筛选得到感染成功的细胞。药筛后的细胞使用accutase消化酶进行单细胞传代,待小克隆长成之后,使用dispase消化并在显微镜下挑取单克隆于24孔板中进行培养。至单克隆增殖成稳定细胞株后,对培养得到的细胞进行Cas9蛋白表达鉴定,从而得到诱导型Cas9稳定表达株(induced Cas9-hESC,iCas9-hESC)。
1.2.3 多能性基因相关顺式作用元件的获取:在NCBI数据库中,得到15个多能性基因的基因组位置(OCT4、KLF4、NANOG、SOX2、DPPA5、DNMT3L、REX1、KLF5、KLF2、DPPA2、STELLA、HORMAD1、MAEL、TFCP2L1和UTF1)。分别在每个基因位置上下游100 Mb(1 Mb=1 000 kb)内筛选其中的增强子与绝缘子,作为候选顺式作用元件研究对象,确定其起始位置。
1.2.4 CRISPR文库的构建:以候选顺式作用元件的起始位置为靶点设计gRNA(guide RNA),每个候选靶点设计3条gRNA,构建双gRNA基因敲除的慢病毒载体。1个载体中包含2个U6启动子,分别表达1条gRNA[7],载体上同时带有mcherry荧光标记和BSD抗性筛选标记。
1.2.5 CRISPR文库感染hESCs:CRISPR文库在MOI(multiple of infection)=0.5时感染hESCs,保证1个细胞中只进入1对gRNA。感染文库48 h后细胞进行BSD药物筛选,药物筛选7 d后,加入2 ng/mL DOX(Doxcycline)诱导Cas9蛋白表达,Cas9蛋白表达7 d后进行后续实验操作[8]。
1.2.6 流式抗体染色和分析:对CRISPR文库编辑后的hESCs进行OCT4流式抗体染色,染色方法为,PBS清洗细胞,细胞使用4%多聚甲醛固定10 min,0.1% T×100通透10 min,流式抗体染色30~45 min,上机分析[9]。
2 结果
2.1 iCas9-hESC特征鉴定
成功构建的hESC诱导型Cas9稳定表达株(iCas9-hESC),可以在DOX诱导后1 d内高水平表达Cas9蛋白(图1A)。选择OCT4和SSEA4两个基因衡量干细胞多能性,研究发现,在hESCs向中胚层诱导过程的第2天和第4天,OCT4和SSAE4的表达水平持续下降(图1B)。当iCas9-hESC表达Cas9蛋白时,OCT4和SSEA4的表达水平并未发生显著变化(图1C)。
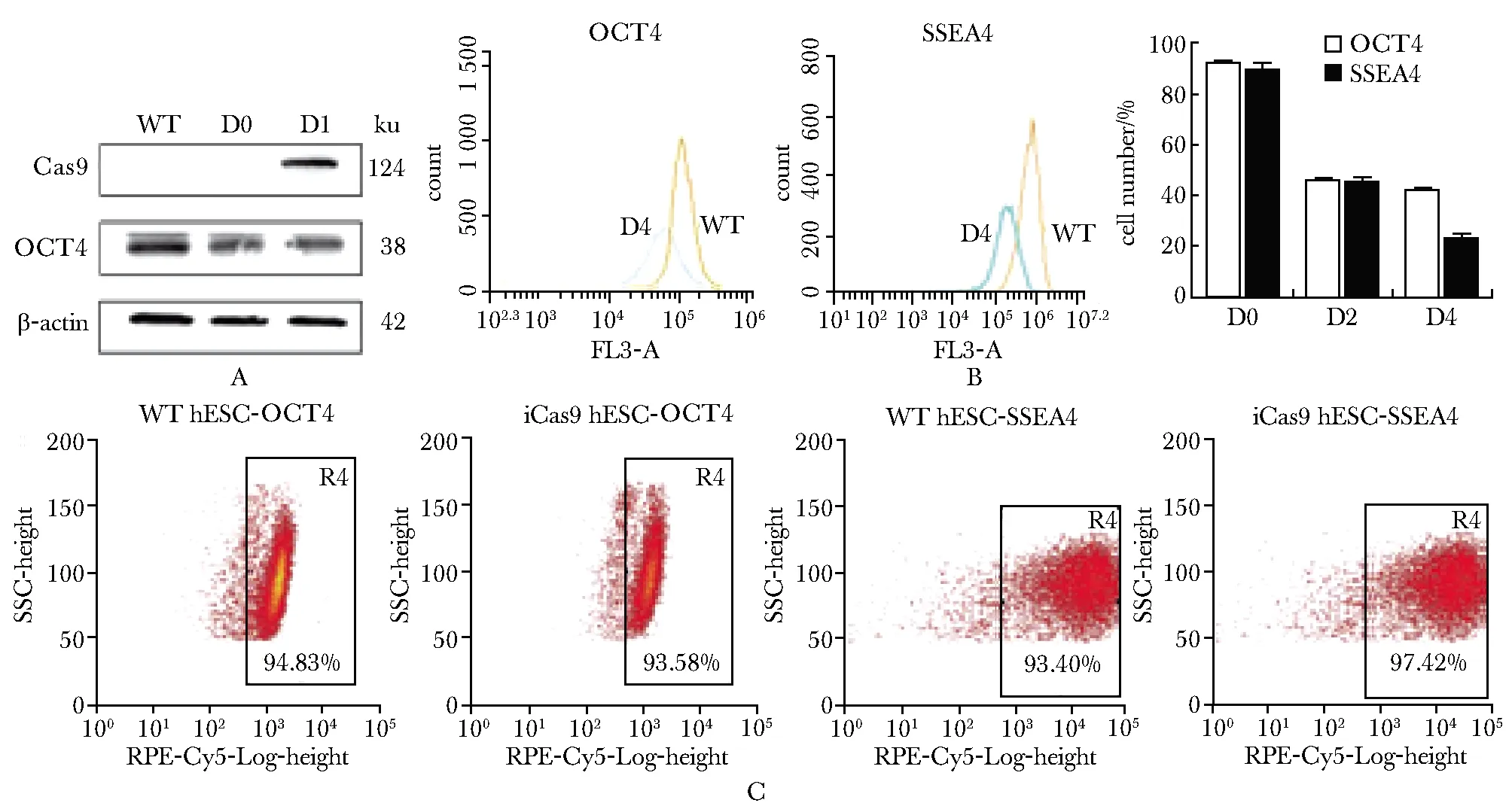
A.expression of Cas9 protein one day after Dox induction; B.with the induction of hESCs to the mesoderm, the expression levels of OCT4 and SSEA4 continued to decline; C.when iCas9-hESC expressed Cas9 protein, the expression levels of OCT4 and SSEA4 did not change significontly图1 iCas9-hESC特征鉴定Fig 1 iCas9-hESC characterization
2.2 成功构建CRISPR文库
以候选顺式元件的两端作为靶点,分别设计3对gRNA进行敲除,通过两步克隆将带有 gRNA 的片段插入到慢病毒骨架上,最终得到由 2.7×107个单克隆组成的慢病毒文库。合成的gRNA文库覆盖率为99.97%,且gRNA丰度的分布符合正态分布,整体分布呈现比较均匀的状态(图2)。

图2 CRISPR文库质控Fig 2 CRISPR library quality control
2.3 使用CRISPR文库感染iCas9-hESC
在MOI=0.5时将CRISPR文库感染进iCas9-hESC,进行BSD药物筛选后仍有细胞存活,对感染文库后的细胞进行流式分析,可检测到mcherry的表达(图3)。
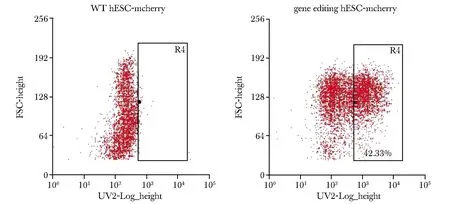
图3 细胞感染CRISPR文库后mcherry的表达Fig 3 Expression of mcherry after cell infected with CRISPR library
2.4 CRISPR文库编辑后hESCs多能性发生变化
流式分析发现确实存在一群细胞,在CRISPR文库感染后OCT4表达水平下降[12]。并可通过流式分选将这批细胞分析出来,进行后续的基因敲除鉴定(图4)。
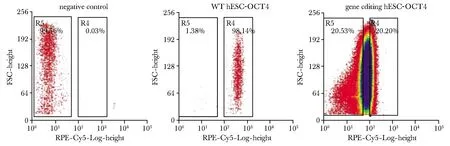
图4 hESCs多能性的变化Fig 4 Changes in hESCs pluripotency
3 讨论
CRISPR技术是目前进行基因编辑的主要方法之一,通过构建CRISPR文库,可以对一系列基因进行敲除,并进一步通过表型的变化筛选出功能性基因。本文主要研究以增强子和绝缘子为代表的顺式元件对hESCs多能性的影响,顺式元件虽然不编码蛋白质,但是可以参与基因的表达调控,通过影响转录进而影响蛋白编码基因的表达水平[13-14]。多能性是hESCs的特殊特征,但在hESCs中特异性影响多能性的顺式元件的研究尚不全面。因此本工作针对hESCs中多能性相关的顺式元件构建CRISPR文库,旨在筛选出潜在影响hESCs多能性的顺式作用元件。
首先通过构建诱导型Cas9稳定表达株(iCas9-hESC),排除Cas9的持续性表达对hESCs多能性的影响,并通过OCT4和SSEA4两种多能性marker的表达水平,鉴定出iCas9-hESC的多能性状态未收到影响。接下来对候选顺式元件构建双gRNA CRISPR敲除文库,在文库成功感染iCas9-hESC后,诱导Cas9蛋白表达,排除Cas9蛋白表达影响CRISPR文库感染效率的可能性。接下来对基因编辑后的细胞,通过OCT4表达水平的变化,成功区分出多能性下降和不变的hESCs,证明确实存在影响hESCs多能性的顺式作用元件。
本工作建立了在hESCs中进行大规模功能性基因组元件筛选的可行性方案,以本工作为基础,可通过流式分选得到多能性下降的细胞群体,对其中的gRNA进行测序分析,即可确定敲除后影响hESCs多能性的重要基因元件。通过建立筛选方案,也可应用于其他DNA序列的功能性筛选,具有较强的应用性与普适性。
