CuI 催化苯丙氨酸与溴苯发生C-N 偶联反应机理理论研究
2015-07-13徐伯华曾建碧
徐伯华,曾建碧
(1. 长江师范学院化学化工学院,重庆408003;2. 重庆工贸职业技术学院,重庆408000)
有机含氮化合物是一类非常重要的化合物,C-N 键不仅存在于许多天然的富有生理活性的物质中,如:蛋白质、多肽、几丁质等,也存在现代工业化生产的重要合成物,如:吗啉、哌嗪、噻唑等. 因此,在一些结构简单的含氮化合物基础上构建新的C -N 键,对合成含有这种结构单元的天然产物、药物、农药、材料等非常重要,一直是有机化学家重点研究的课题之一[1]. Ullmann 反应是使用铜源为催化剂的偶联反应[2-4],铜具有低毒、便宜、易得等优点,所以对使用铜源作为催化剂的Ullmann 反应的研究成为过渡金属催化领域中的一个热门方向,这也是化工生产朝当今社会提倡的绿色环保新要求迈进的必然趋势[5]. Cohen 于1974 年提出了氧化加成/还原消除机理[6];Lindlery 于1984 年提出了自由基阴离子机理[7];Paine 于1987 年提出了p -络合物机理[8]. 马大为实验组在此基础上用CuI 作催化剂,在低于或等于110℃的温和反应温度下相继成功催化完成α-氨基酸、β-氨基酸的N-芳香化反应[9]. 这些研究成果激发了人们深入研究铜催化C-N 交叉偶联反应的兴趣,并为该方法的进一步发展奠定了基础. 但对于氨基酸作为亲核试剂对C-N 偶联反应(反应式如示意图1 所示)的作用尚未见相关理论报道,所以本文采用密度泛函理论对此反应的机理进行了研究,通过对该反应微观反应历程的研究,意在明确其反应机理及不同的氨基酸在反应过程中所起作用的差别之处,为实验科学提供一定的理论依据.
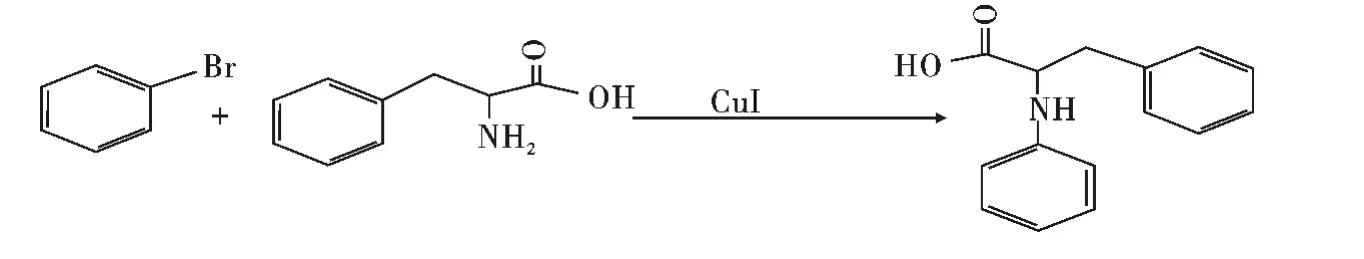
示意图1 反应方程式Scheme 1 Reaction equation
1 计算方法
本文采用密度泛函理论(DFT)中的B3LYP方法,在6 -31 +G* 基组水平上(Cu 采用赝势基组LanL2DZ,Br、I 采用MIDIX 基组)对CuI 催化苯丙氨酸与溴苯发生C -N 环化反应机理中所有反应物、中间体、过渡态和产物进行了几何构型的优化,并在相同基组水平下进行了频率计算,除过渡态以外的其他稳态构型频率皆为正值,证明其均是反应势能面上稳定存在的点,各过渡态仅存在唯一虚频,同时通过内禀反应坐标(IRC)计算和频率振动分析进一步的确认了过渡态的合理性. 同时在此基组水平上运用自然键轨道(NBO)[10]分析了分子的轨道间相互作用,电子分布以及电子转移的过程. 利用AIM2000 程序包[11]计算了反应机理中所有化合物,得到了相应的成键临界点(BCP)和成环临界点(RCP)电荷密度,分析了成键特征. 与此同时反应过程中所有优化后的构型在6 -311 + G* 基组水平上(Cu 采用赝势基组LanL2DZ,Br、I 采用MIDIX 基组)上进行了驻点单点能量计算,计算结果与6-31 +G* 基组水平上相匹配. 所有理论计算均采用Gaussian 03 程序[12]完成.
2 计算结果
2.1 反应机理分析
研究发现了反应物苯丙氨酸与溴苯在CuI 的催化下进行反应存在两条不同的反应通道. 示意图2 所示为CuI 催化苯丙氨酸与溴苯反应机理图;该反应机理中能量校正后的各物质相关能量列于表1;所有反应物、中间体、过渡态和产物的优化分子构型以及部分键临界点 (BCP)电荷密度(图中括号内)列于图1 和图2;各驻点能级变化见图3.
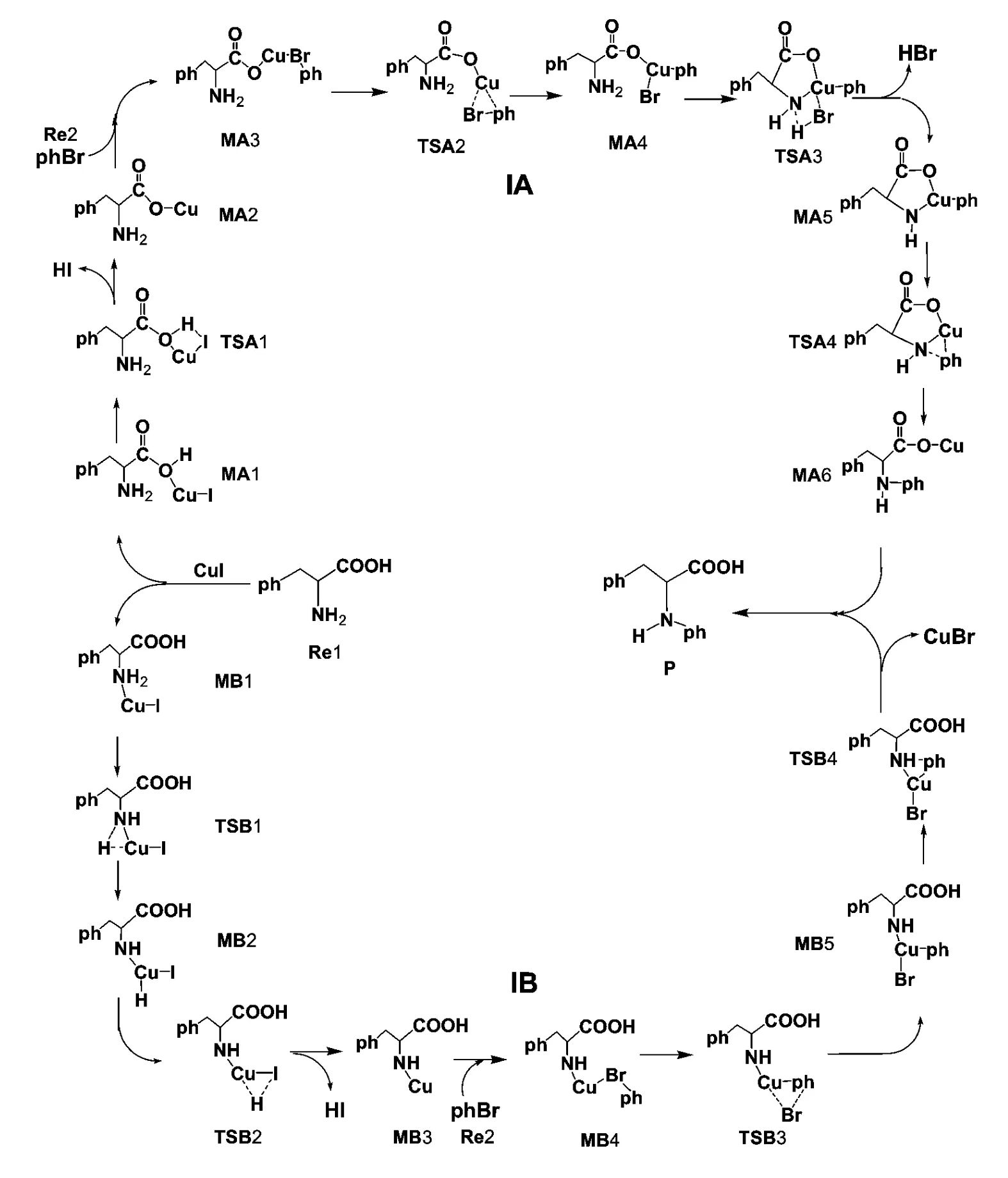
示意图2 CuI 催化苯丙氨酸与溴苯反应机理图Scheme 2 Detailed synthesis route of CuI-catalyzed reaction between phenylalanine and bromobenzene
在路径IA 中,本反应的第一步是催化剂CuI中的Cu 原子与反应物苯丙氨酸中O (1)原子活化络合,得到中间体MA1. 反应物苯丙氨酸中O(1) -H (3)键长为0.0990 nm,BCP 电荷密度为0.3222 a. u.,而中间体MA1 中O (1) - H(3)键长缩短了0.0017nm,BCP 电荷密度增加了0.0152 a. u.;Cu-I 键长比催化剂CuI 中增加了0.0004 nm,说明CuI 中的Cu 原子与苯丙氨酸中的O (1)原子之间配位络合导致O (1) - H(3)键增强,Cu -I 键变弱. 由NBO 计算分析得知,在中间体MA1 中成键轨道中,BD (1)C (3)–O (1)→LP* (6)Cu 的二阶稳定化能E(2)为12.47 kJ·mol-1,LP (6)Cu→BD* (1)C (3)– O (1)的二阶稳定化能E (2)为20.84 kJ·mol-1,这说明C (3) -O (1)键和Cu 原子间存在着轨道间的相互作用. 从表1 能量数据可以看出,中间体MA1 的能量比反应物Re1与催化剂CuI 能量之和低了56.82 kJ·mol-1,表明中间体MA1 易形成且稳定存在,同时催化剂CuI 与反应物Re1 顺利完成了吸附. 在中间体MA1 中,Cu-I 的键长为0.2375 nm,O (1) -H(3)的键长为0.0974 nm,BCP 电荷密度分别是0.3374 a. u.,过渡态TSA1 中,Cu -I 的键长为0.2469 nm;O (1) - H (3)的键长为0.3625 nm,I -H (3)的键长为0.1660nm,BCP 电荷密度为0.0136 a. u.,中间体MA2 中,Cu-O (1)、Cu - O (2)的键长分别为0.2064 nm、0.2098 nm;BCP 电荷密度分别为0.0693 a. u.、0.0648 a. u.. 由此可以看出,从中间体MA1 →过渡态TSA1→中间体MA2 过程中O (1) -H (3)键、Cu-I 键部分断裂,I -H (3)键部分形成,经过渡态TSA1 后,HI 从构型中脱落形成中间体MA2.在中间体MA2 与反应物溴苯结合形成中间体MA3的过程中,Br -C (4)键长增长,BCP 电荷密度降低;Cu -Br 键长为0.2326 nm,BCP 电荷密度为0.0706 a. u.,Br-Cu 完成活化配位络合. 中间体MA3 中Cu 原子经过渡态TSA2 与C (4)靠近,同时Br 原子逐渐与苯环脱落,形成了中间体MA4,从表1 能量数据可以看出该过程反应的活化能为24.28 kJ·mol-1,反应极易进行. 在过渡态TSA3 中Cu - N、Br - H (2)键长分别为0.1888 nm、0.1442 nm,BCP 电荷密度分别为0.1248 a. u.、0.1550 a. u.;N -H (2)、Cu -Br 键长分别由中间体MA4 中的0.1021 nm、0.2288 nm 增加到了0.2945 nm、0.2496 nm 且BCP 电荷密度大幅减小. 中间体MA5 中,Cu -N键的键长为0.1861 nm,BCP 电荷密度为0.1266 a. u.. 由此可知,从中间体MA4→过渡态TSA3→中间体MA5 过程中Cu-N 键和Br- H (2)键部分形成,N-H (2)键、Cu- Br 部分断裂,经过渡态TSA3 后,HBr 从构型中脱落形成中间体MA5. 中间体MA5 中的N 原子经过渡态TSA4 与C (4)靠近,同时Cu 原子逐渐与C (4)及N 原子脱落,形成了产物MA6. 产物MA6 中,Cu 原子与O (1)、O (2)的键长分别为0.2072 nm、0.2093 nm,由此可以看出Cu 原子与O (1)、O(2)间又重新形成共轭状态.
在路径IB 中,本反应的第一步是催化剂CuI中的Cu 原子与反应物苯丙氨酸中N 原子活化络合,得到中间体MB1. 在此过程中,催化剂CuI 键长由0.2371 nm 增加到了0.2375 nm;N-H (1)、N-H (2)键长分别由0.1019 nm、0.1018 nm 增加到了0.1025 nm、0.1023 nm,BCP 电荷密度分别由0.3276 a. u.、0.3286 a. u. 减小到了0.3243 a. u.、0.3266 a. u.. 由此可以说明CuI中的Cu 原子与苯丙氨酸中的N 原子之间配位络合导致N-H (1)、N-H (2)、Cu -I 键均变弱.从表1 能量数据可以看出,中间体MB1 的能量比反应物Re1 与催化剂CuI 能量之和低了127.21 kJ·mol-1,表明中间体MB1 易形成且稳定存在,同时催化剂CuI 与反应物Re1 顺利完成吸附. 在中间体MB1 中,N-H (2)的键长为0.1023 nm;N-Cu 的键长为0.1972 nm,BCP 电荷密度分别是0.0934 a. u.,过渡态TSB1 中,N -H (2)的键长为0.1959 nm;N - Cu 的键长为0.1859 nm,BCP 电荷密度分别是0.1256 a. u.,Cu -H (2)的键长为0.1457 nm,BCP 电荷密度为0.1280 a.u.,中间体MB2 中,N-Cu 的键长为0.1872 nm,BCP 电荷密度分别是0.1228 a. u.,Cu -H (2)的键长为0.1456 nm,BCP 电荷密度为0.1321 a.u.. 由此可以看出,从中间体MB1→过渡态TSB1→中间体MB2 过程中N-H (2)键断裂,Cu -H(2)键形成. 中间体MB2 中H (2)原子经过渡态TSB2 与与I 靠近,脱去HI 分子后形成中间体MB3. 从表1 能量数据可以看出该过程反应的活化能为49.52 kJ·mol-1,反应较易进行. 中间体MB3 与反应物溴苯结合形成中间体MB4 的过程中,Br-C (4)键长增长,BCP 电荷密度降低;Cu - Br 键长为0.2338 nm,BCP 电荷密度为0.0672 a. u.,Br - Cu 完成活化配位络合,由NBO 计算分析得知,在中间体MB4 中成键轨道BD (1)C (4)–Br→LP* (7)Cu 的二阶稳定化能E (2)为14.31kJ·mol-1,LP* (7)Cu→BD* (1)C (4)–Br 的二阶稳定化能E (2)为8.58 kJ·mol-1,这说明C (2) -N 键和Cu 原子间存在着轨道间的相互作用. 中间体MB4 中Cu 原子经过渡态TSB3 与C (4)靠近,同时Br 原子逐渐与苯环脱落,形成了中间体MB5,在此过程中,MB5 中Cu - N、Cu - C (4)键长分别较过渡态TSB3 中减少0.0044 nm、0.0310 nm,BCP 电荷密度分别增加0.0169 a. u.、0.0607 a. u.;N - C(4)键长减小0.1459 nm;从表1 能量数据可以看出该过程反应的活化能为33.12 kJ·mol-1,反应极易进行. MB5 中N 原子键经过TSB4 与C (4)靠近,同时Cu 原子逐渐与C (4)及N 原子脱落,形成了最终产物P. 在产物P 中,N 原子与C (4)的键长为0.1462nm,BCP 电荷密度为0.2668 a. u..由此可以看出N-C (4)键形成.
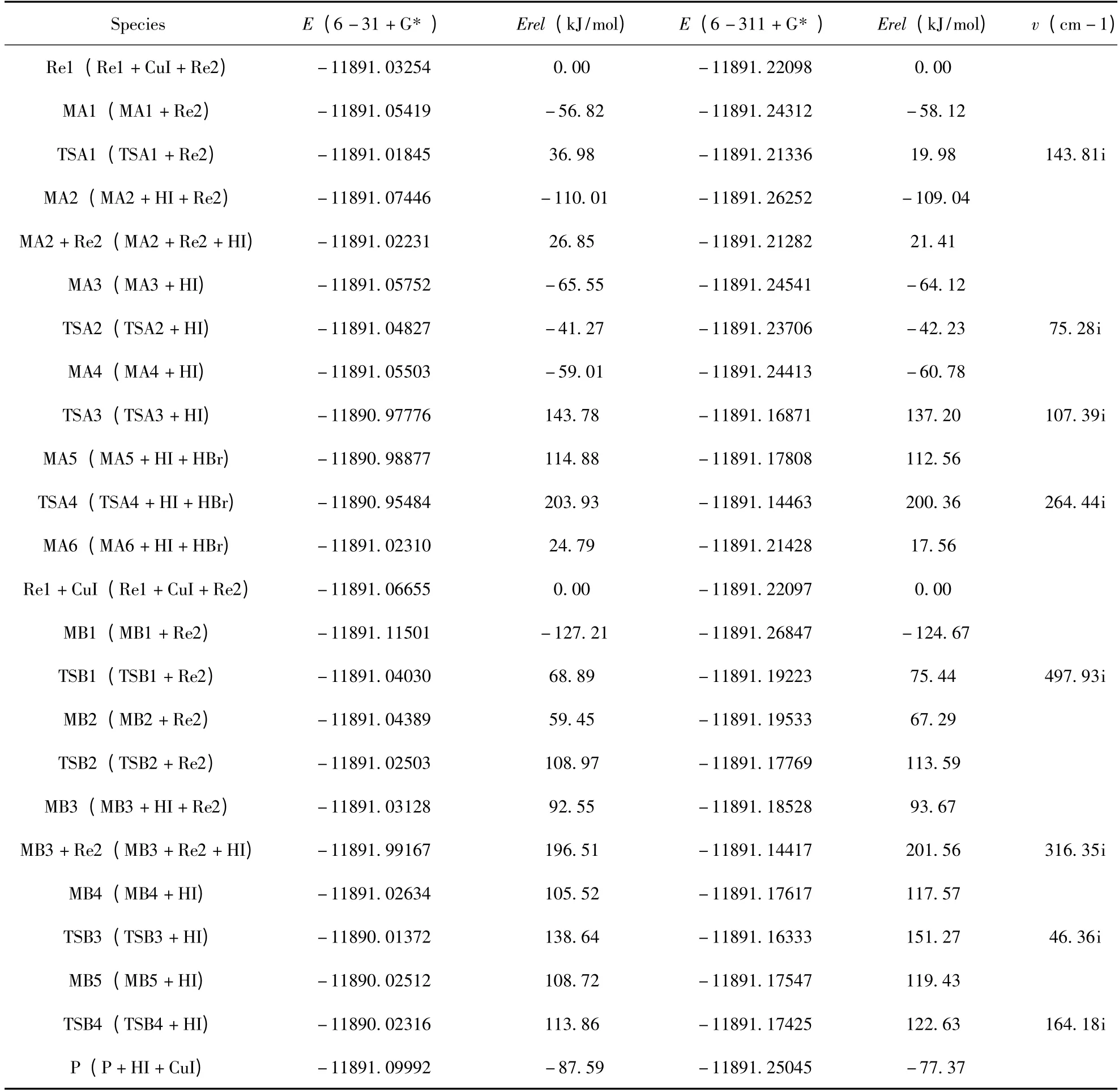
表1 反应各驻点能量E (a. u.),相对能量Erel (kJ/mol)和过渡态的振动频率V (cm -1)Table 1 Energies E,relative energies Erel,and frequencies v of the compounds in the reactions

图1 路径IA 上化合物的构型参数Fig.1 Geometric parameters of the compounds in pathway IA. Bond length is in nm,BCP (in brackets)is in a. u.

图2 路径IB 上化合物的构型参数Fig.2 Geometric parameters of the compounds in pathway IB. Bond length is in nm,BCP (in brackets)is in a. u.
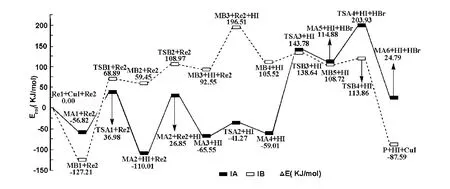
图3 催化各驻点能级变化示意图Fig.3 The diagram of relative energies along catalytic stage of the reactions
2.2 能量分析
从图3 中可以看出,路径IA 和路径IB 经过2-甲基-1,3-顺丁二烯和催化剂活化络合成稳定的中间体MA1 和MB1,该过程中体系分别放出热量56.82、127.21 kJ·mol-1,为后续反应提供了潜热. 路径IA 中催化阶段的速率控制步骤是MA4→TSA3 →MA5 过程,反应活化能为 202.81 kJ·mol-1;路径IB 中催化阶段的速率控制步骤是MB1→TSB1 →MB2 过程,反应活化能为196.10 kJ·mol-1,由以上比较结果可以看出,反应通道IA与IB 在整个反应过程可能同时发生,但IB 通道具有较低的活化能,即IB 通道为整个反应的最优反应通道,通道路径为Re1→MB1→TSB1→MB2→TSB2→MB3→MB4→TSB3→MB5→TSB4→产物P.
3 结 论
采用密度泛函理论(DFT)在B3LYP/6 -31+G* 基组水平上对CuI 催化苯丙氨酸与溴苯发生C-N 偶联反应机理进行了理论研究,研究发现了两条可行的反应通道,路径IA:Re1→MA1→TSA1→MA2→MA3→TSA2→MA4→TSA3→MA5→TSA4→MA6;速率控制步骤为MA4→TSA3→MA5过程,活化能为202.81 kJ·mol-1;路径IB:Re1→MB1→TSB1→MB2→TSB2→MB3→MB4→TSB3→MB5→TSB4→P;速率控制步骤为MB1→TSB1→MB2 过程,活化能为196.10 kJ·mol-1. 通过比较各反应通道中控制步骤的活化能,得出反应通道IA 与IB 在整个反应过程可能同时发生,但IB 通道具有较低的活化能,即IB 通道为整个反应的最优反应通道,该通道的第一步活化络合过程能量降低了127.21 kJ·mol-1为其速率控制步骤MB1→TSB1→MB2 提供了大量的潜热,使反应易于进行. 通过计算发现IB 通道中最终解离产物与文献报道所得产物完全一致,且从理论计算所得的反应活化能数据也证明了其通道的合理性. 与此同时,该反应过程中所有优化后的构型在6 -311 + G * 基组水平上 (Cu 采用赝势基组LanL2DZ,Br、I 采用MIDIX 基组)上进行了驻点单点能量计算,计算结果与6 -31 +G* 基组水平上相匹配. 这也进一步证实了其通道的合理性.很好的解释了实验催化剂的作用机制.
[1] Pei Q,Sun J Y,Jin C X,et al. Synthesis,stereochemistry and anti-cancer activity of 6 -N - alkyl -4-methoxy-3 - oxa-6 -aza-bicyclo[3.1.0]hexan-2 - one[J]. Chinese J. Org. Chem.,2010,30(5):698(in Chinese)[裴强,孙俊永,金春雪,等.6 -N-烷基-6 -氮杂-2 -氧代-3 -氧杂-4 -甲氧基-双环[3.1.0]己烷的合成、立体化学及抗癌活性研究[J]. 有机化学,2010,30(5):698]
[2] Ullmann F,Bielecki J. Ueber synthesen in der biphenylreihe[J]. Chem. Ber.,1901,34(2):2174.
[3] Zhang Q,Wang D P,Wang X Y,et al. (2 -Pyridyl)acetone-promoted Cu-catalyzed O-arylation of phenols with aryl iodides,bromides,and chlorides[J]. J.Org. Chem.,2009,74(18):7187.
[4] Jiao J,Zhang X R,Chang N H,et al. A facile and practical copper powder-catalyzed,organic solvent-and ligand-free Ullmann amination of aryl halides[J]. J.Org. Chem.,2011,76(4):1180.
[5] Deng W,Liu L,Guo Q X. Recent progress in coppercatalyzed cross-coupling reactions [J]. Chinese J.Org. Chem.,2004,24(02):150(in Chinese)[邓维,刘磊,郭庆祥.铜催化交叉偶联反应研究的新进展[J]. 有机化学,2004,24(02):150]
[6] Cohen T,Wood J,Dietz,A G. Organocopper intermediates in the exchange reaction of aryl halides with salts of copper(Ⅰ). The possible role of copper(Ⅲ)[J].Tetrahedron Lett.,1974,15(40):3555.
[7] Lindlery J. Copper-assisted nucleophilic substitution of aryl halogen[J]. Tetrahedron Lett.,1984,40(9):1433.
[8] Paine A J. Mechanisms and models for copper mediated nucleophilic aromatic substitution. 2. Single catalytic species from three different oxidation states of copper in an Ullmann synthesis of triarylamines[J].J. Am. Chem. Soc.,1987,109(5):1496.
[9] Nasani N,Sivan V. Copper-catalyzed C–N coupling reactions of aryl halides with α-amino acids under focused microwave irradiation[J]. Tetrahedron Lett.,2009,50:5159.
[10] Reed A E,Weinhold F,Curtiss L A,et al. Natural bond orbital a nalysis of molecular interactions:theoretical studies of binary complexes of HF,H2O,NH3,N2,O2,F2,CO,and CO2with HF,H2O and NH3[J]. Chem. Phys.,1986,84:5687.
[11] Biegler K F,Schonbohm J,Derdan R,et al. AIM2000,Version 2000.
[12] Frisch M J,Truck G W,Schlegel H B,et al. Gaussian03,Revision A. 7;Gaussian,Pittsburgh,PA,2003.
