异甘草酸镁对奥沙利铂在人胃癌裸鼠模型中抗肿瘤作用的影响研究
2015-07-11郭曼赵园园何信佳于丽张蕊叶宝玲
郭曼,赵园园,何信佳,于丽,张蕊,叶宝玲
(青岛大学附属医院,1.肿瘤科;2.检验科,山东 青岛 266000)
胃癌是中国最常见的消化道恶性肿瘤,多数患者发现时已属中晚期,仅通过手术难以治愈[1]。化疗作为重要的治疗手段,往往引起的肝功能损害,严重的药物性肝损伤使得患者不能按期完成化疗或不能承受应用剂量,从而影响治疗效果[2]。异甘草酸镁(magnesium isoglycyrrhizinate,MgIG)是一种临床常用的保肝药物,在治疗化疗药物性肝损害时具有肝功恢复快、不良反应少的优点[3-4]。本研究建立人胃癌裸鼠皮下移植瘤模型,通过MgIG结合奥沙利铂(oxaliplatin,L-OHP)对动物模型的干预,探讨MgIG对L-OHP抗肿瘤作用的影响,为MgIG在临床中的应用提供参考。
1 材料与方法
1.1 细胞株和动物
人胃癌细胞株SGC-7901由青岛大学医学院实验中心惠赠。BALB/c雄性裸小鼠60只,周龄5~6周,体质量18~23 g,购自购自北京维通利华实验动物技术有限公司,饲养于中国海洋大学医药学院分子药理实验室。
1.2 药品与试剂
MgIG注射液(国药准字H20051942)购自江苏正大天晴药业股份有限公司;L-OHP(国药准字H20000337)购自江苏恒瑞医药股份有限公司;DMEM培养液购自美国Sigma公司。
1.3 细胞的培养和人胃癌裸鼠模型的建立
人胃癌细胞株SGC-7901在DMEM培养液(含体积分数 0.1灭活胎牛血清、10 U/L青霉素、10 U/L链霉素),在37℃下于体积分数0.05的CO2培养箱中培养。将处于数生长期细胞运用胰酶消化,用PBS液稀释,制备成细胞密度为4×1010/L的单细胞悬液。在超净工作台内于裸鼠右腋下皮下注射0.2 mL细胞悬液,10 d后所有裸鼠右腋下均出现长径约5~8 mm的皮下结节,提示移植瘤模型建立成功。
1.4 分组与处理
将60只人胃癌裸鼠移植瘤模型随机分为6组,每组 10只:高(40 mg/kg)、中(20 mg/kg)、低(10 mg/kg)剂量MgIG联合L-OHP组(6 mg/kg)、单纯L-OHP(6 mg/kg)组、单纯MgIG(20 mg/kg)和葡萄糖对照组(5%葡萄糖注射液0.2 mL)。L-OHP每3 d给药1次,MgIG和葡萄糖均为1次/d给药。L-OHP和MgIG均用5%葡萄糖溶液稀释,给药途径均为尾静脉注射给药,0.2 mL/只,连续用药14 d。
1.5 检测指标
自首次给药起,连续监测裸鼠一般情况,每2 d用游标卡尺测量移植瘤大小一次,记录长径(a)和短径(b),肿瘤体积=(ab2)/2[5]。并测定裸鼠体质量。停药后第2天用摘眼球取血法采集血样,用于检测裸鼠肝功能,主要包括丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)。处死裸鼠后剥离肿瘤组织,称取瘤质量,计算质量抑瘤率,抑瘤率(瘤质量)=(对照组平均瘤质量-实验组平均瘤质量)/对照组平均瘤质量×100%;测量移植瘤体积,计算体积抑瘤率,抑瘤率(瘤体积)=(对照组平均瘤体积-实验组平均瘤体积)/对照组平均瘤体积×100%。TUNEL法检测移植瘤细胞凋亡率,操作方法严格按照试剂盒说明,每张切片随机选取10个视野在400倍镜下计数,计算凋亡细胞百分比及其标准差,阳性细胞率=阳性细胞数/总细胞数×100%。裸鼠肿瘤组织于-70℃冰箱保存备检。
1.6 统计学分析
采用SPSS19.0统计软件,计量资料以均数±标准差(x-±s)表示,两组间均数比较采用配对t检验,组间差异采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 裸鼠一般情况
各组裸鼠均于接种10 d后成瘤明显,成瘤率及移植瘤大小无明显差异,对各组移植瘤大小进行方差齐性检验示方差齐(P=0.376),方差分析显示各组间差异无统计学意义(F=0.801,P >0.05)。见表1。
给药期间,各组裸鼠均未出现死亡,移植瘤未出现破溃,不同剂量MgIG联合L-OHP组裸鼠出现不同程度的消瘦,精神状态稍差,进食、饮水尚可,大小便正常;单纯L-OHP组裸鼠消瘦明显,进食量最少,精神萎靡,出现不同程度腹泻。单纯MgIG和葡萄糖对照组裸鼠精神状态好、进食正常,大小便正常,较活跃。处死裸鼠并解剖,各组均未见腹水及其他部位转移病灶。与用药前比较,高、中、低剂量MgIG联合L-OHP组和单纯L-OHP组裸鼠用药后体质量有不同程度的降低,差异有统计学意义。见表2。

表1 接种10 d后各组裸鼠成瘤大小比较(mm3)
表2 用药前后裸鼠的体质量变化(g±s,n=10)

表2 用药前后裸鼠的体质量变化(g±s,n=10)
高剂量MgIG联合L-OHP组24.58 ±1.71 21.74 ±1.58 -2.84 ±0.47 3.89 <0.05中剂量MgIG 联合 L-OHP组 24.81±1.30 22.06±1.34 -2.75±0.89 4.65 <0.01低剂量MgIG 联合 L-OHP组 24.55±1.10 21.77±1.21 -2.79±0.84 5.40 <0.01单纯 L-OHP 组 25.04 ±0.99 21.56 ±1.04 -3.48 ±0.46 7.67 <0.01单纯 MgIG 组 24.61 ±1.09 25.31 ±1.09 0.70 ±0.40 1.44 >0.05葡萄糖对照组25.03 ±1.20 25.27 ±1.26 0.24 ±0.60 0.44 >0.05
2.2 各组裸鼠移植瘤生长曲线
给药后,各剂量MgIG联合L-OHP组及单纯LOHP组的皮下移植瘤生长速度低于葡萄糖对照组及单纯MgGI组。单纯MgGI组和葡萄糖对照组移植瘤生长曲线较陡,高、中剂量MgIG联合L-OHP组生长曲线较缓,低剂量MgIG联合L-OHP组和单纯L-OHP组介于上述两者之间。见图1。
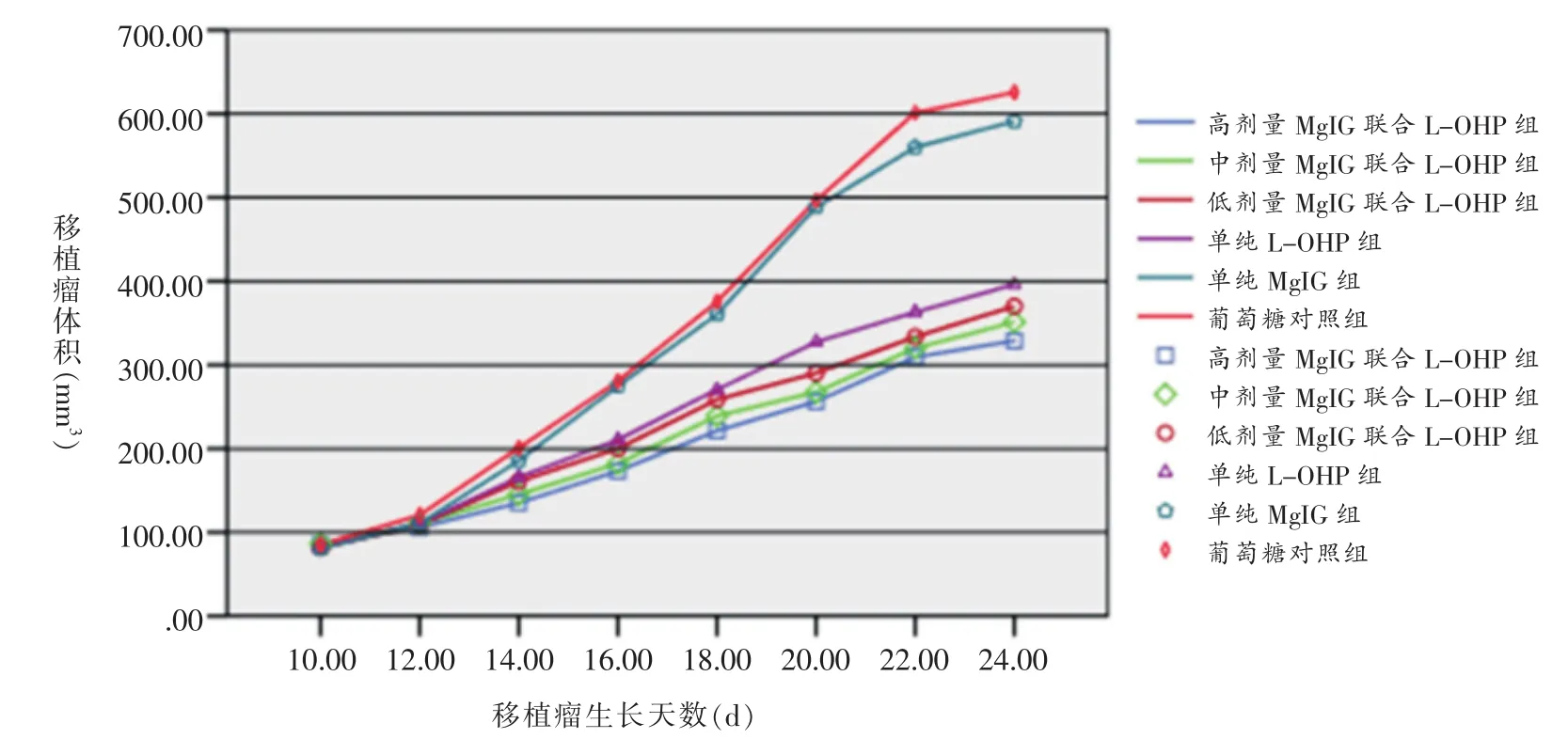
图1 各组裸鼠胃癌移植瘤生长曲线
2.3 各组移植瘤的瘤体积、瘤质量相应抑瘤率比较
移植瘤体积变化方面,与葡萄糖对照组相比,高、中、低剂量MgIG联合L-OHP组及单纯L-OHP组表现出了明显的抗肿瘤作用,体积抑瘤率分别为46.92%、43.03%、40.08%、35.53%,移植瘤体积减少幅度随着MgIG剂量的增加而增加(F=611.39,P<0.05),提示与L-OHP联用时,MgIG提高了奥沙利铂的抗肿瘤作用,并且呈剂量依赖性。此外,与葡萄糖对照组相比,单纯MgIG组未表现出明显的抗肿瘤作用,差异无统计学意义(P>0.05);高、中、低剂量MgIG联合L-OHP组与单纯L-OHP组相比,差异有统计学意义(P<0.05)。见表3和图2。
移植瘤质量变化方面,与葡萄糖对照组相比,高、中、低剂量MgIG联合L-OHP组及单纯L-OHP组表现出了明显的抗肿瘤作用,质量抑瘤率分别为44.61%、41.62%、39.21%、35.12%,移植瘤质量减少幅度随着MgIG剂量的增加而增加(F=337.60,P<0.05)。此外,与葡萄糖对照组相比,单纯MgIG组未表现出明显的抗肿瘤作用,差异无统计学意义(P>0.05);高、中、低剂量MgIG联合 L-OHP组与单纯 L-OHP组相比,差异有统计学意义(P<0.05);组间两两比较,高、低剂量MgIG联合L-OHP组差异有统计学意义(P<0.05)。见表3和图2。
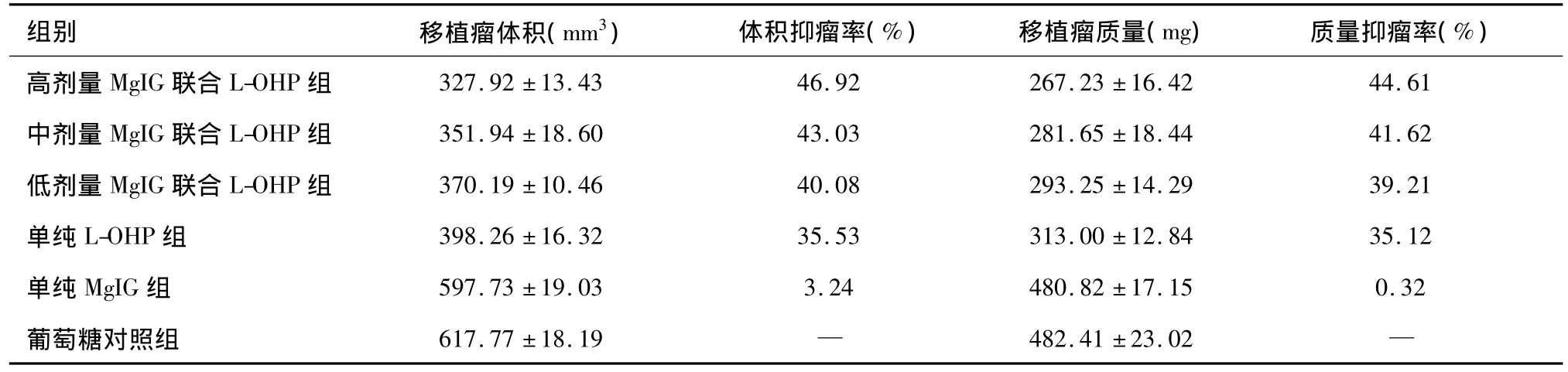
表3 各组移植瘤的瘤体积、瘤质量抑瘤率比较(n=10)

图2 用药后各组移植瘤的瘤体积、瘤质量抑瘤率比较
2.4 各组裸鼠移植瘤细胞凋亡指数比较
高、中、低剂量 MgIG联合 L-OHP组,单纯 LOHP组,单纯MgIG组及葡萄糖对照组的细胞凋亡指数分别为(15.62 ±1.63)%、(15.59 ±2.15)%、(14.57 ± 2.39)%、(13.74 ± 1.89)%、(3.79 ±1.19)%和(3.58±0.92)%。各剂量MgIG联合LOHP及单纯L-OHP组的细胞凋亡指数均高于单纯MgIG组及葡萄糖对照组(F=112.04,P <0.05);高、中剂量MgIG联合L-OHP组的凋亡指数高于单纯L-OHP组,差异有统计学意义(P<0.05);低剂量MgIG联合L-OHP组与单纯L-OHP组的凋亡指数差异无统计学意义(P>0.05);高、中剂量MgIG联合L-OHP组的凋亡指数差异无统计学意义(P>0.05)。见图3。

图3 各组裸鼠移植瘤细胞凋亡指数比较
2.5 各组裸鼠肝功能比较
与葡萄糖对照组相比,单纯L-OHP组ALT、AST显著升高,各剂量MgIG联合L-OHP组均显著降低,其中以高剂量MgIG联合L-OHP降低幅度最大。AST水平变化方面,高剂量MgIG联合L-OHP组、单纯MgIG组及葡萄糖对照组差异无统计学意义(P>0.05);中、低剂量 MgIG联合 L-OHP组及单纯 LOHP组与葡萄糖对照组相比,差异有统计学意义(P<0.01)。ALT水平变化方面,高剂量MgIG联合L-OHP组、单纯MgIG组及葡萄糖对照组的差异无统计学意义(P>0.05);中、低剂量 MgIG联合 LOHP组及单纯L-OHP组与葡萄糖对照组相比,差异有统计学意义(P<0.05或P<0.01)。见表4。
表4 各组裸鼠肝功能的比较±s,n=10)
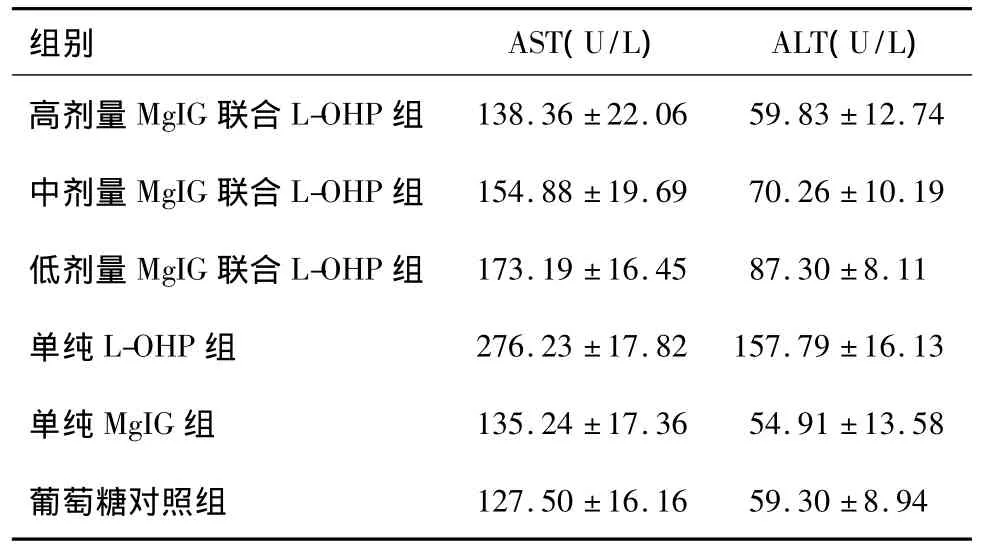
表4 各组裸鼠肝功能的比较±s,n=10)
高剂量MgIG联合L-OHP组138.36 ±22.06 59.83 ±12.74中剂量 MgIG 联合 L-OHP 组 154.88 ±19.69 70.26 ±10.19低剂量 MgIG 联合 L-OHP 组 173.19 ±16.45 87.30 ±8.11单纯 L-OHP 组 276.23 ±17.82 157.79 ±16.13单纯 MgIG 组 135.24 ±17.36 54.91 ±13.58葡萄糖对照组127.50 ±16.16 59.30 ±8.94
3 讨论
对于不能手术切除的中晚期胃癌患者,化疗是主要的治疗措施。然而化疗药物经过肝脏代谢和排泄,可造成不同程度的肝损伤。临床研究证实,保肝药物与化疗药物联用时,可降低肝损伤的发生[6],然而是否会影响化疗药物的疗效目前尚存在争议。本研究通过建立裸鼠移植瘤模型,观察L-OHP联合不同剂量的MgIG对裸鼠移植瘤抑瘤率及凋亡指数的影响,以探讨MgIG对L-OHP抗肿瘤作用的影响。通过比较各组裸鼠的肝功能,结果显示高剂量MgIG联合L-OHP组、单纯MgIG组及葡萄糖对照组ALT和AST水平差异无统计学意义(P>0.05);与单纯L-OHP组相比,不同剂量MgIG联合L-OHP组ALT和AST水平均较低,差异有统计学意义(P<0.01),提示MgIG能一定程度缓解化疗药物L-OHP引起的血清AST升高,具有保护肝功能的作用,与王慧芳等[7]的研究结论基本一致。从肿瘤生长曲线可见,各剂量MgIG联合L-OHP组的肿瘤生长速度明显较单纯L-OHP组缓慢;同时,各剂量MgIG联合L-OHP组及单纯L-OHP组移植瘤质量和体积显著低于葡萄糖对照组,随着MgIG剂量的增加,移植瘤质量和体积缩小程度更加显著,提示MgIG提高了L-OHP的抑瘤率,与L-OHP联用具有协同作用。本研究中,各剂量MgIG联合L-OHP组的移植瘤凋亡指数显著高于单纯L-OHP组,提示MgIG对L-OHP的协同抗肿瘤作用可能与其提高移植瘤的凋亡率有关,但相关机制有待通联合检测其他指标进一步研究阐述。
MgIG是第四代甘草酸制剂,是一种肝细胞保护剂,具有抗炎、保护肝细胞膜、清除氧自由基及改善肝功能的作用[8]。MgIG中有效物质甘草酸,由1分子甘草苦质酸和2分子葡萄糖醛酸组成,以18α和18β两种异构体形式存在,作用于激素受体,影响离子通道的开放,通过激活和抑制酶的活性,调节物质代谢,调节胆碱能神经的兴奋性,具有肾上腺皮质激素样作用,从而呈现抗炎及免疫调节作用[9-10]。研究表明,异甘草酸镁能抑制肝星状细胞的增殖和氧化,减轻肝组织炎症活动度及纤维化程度;降低血清转氨酶及血浆 NO水平,从而减轻肝组织损害[11-12],不仅能够对 D-氨基半乳糖引起大鼠急性肝损伤、四氯化碳引起的慢性肝损伤、Gal/FCA诱发的免疫性肝损害以及对慢性酒精性肝损伤有防治效果,也能够有效地改善肝切除后及化疗药物引起的肝损伤[13-15]。与以往保肝药物相比,在治疗化疗药物引起的急性肝损伤时,MgIG具有更好的疗效和安全性,总有效率可达91.43%,同时可以缩短肝损伤病程,减轻不良反[16]。体外实验也显示MgIG与部分化疗药物联用时,表现出了明显的协同作用[17]。综上所述,MgIG在L-OHP对肿瘤的化疗中,不仅表现出了明显的保肝作用,而且潜在增加了L-OHP的抗肿瘤作用,初步体现了协同作用,但机制仍需要进一步研究。
[1]Okines A,Verheij M,Allum W,et al.Gastric cancer:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2010,21(suppl.5):50 - 54.
[2]Grant LM,Rockey DC.Drug-induced liver injury[J].Curr Opin Gastroenterol,2012,28(3):198 -202.
[3]叶建新,黄永健,郑炜,等.异甘草酸镁在胃肠道恶性肿瘤术后辅助化疗时的保肝作用研究[J].实用临床医药杂志,2010,14(2):42-44.
[4]李志宏,郝磊,孔佩艳,等.异甘草酸镁治疗化疗药物性肝损害的临床疗效观察[J].实用临床医药杂志,2011,15(1):88-89.
[5]赵立民,刘玉国,徐恒卫.马钱子碱对SGC-7901裸鼠移植瘤模型抑瘤作用的研究[J].中华肿瘤防治杂志,2012,19(19):1464-1466.
[6]张华,金建华,陆文斌,等.凯西莱联合天晴甘美治疗化疗后肝损害的临床疗效[J].中国现代药物应用,2012,6(18):5 -6.
[7]王慧芬.甘草酸二铵治疗各类肝病629例临床观察[J].中华传染病杂志,2004,22(2):113 -115.
[8]Mao YM,Zeng MD,Chen Y,et al.Magnesium isoglycyrrhizinate in the treatment of chronic liver diseases:a randomized,double-blind,multi-doses,active drug controlled,multi-center study[J].Zhonghua gan zang bing za zhi,2009,17(11):847 -851.
[9]Abe M,Akbar F,Hasebe A,et al.Glycyrrhizin enhances interleukin-10 production by liver dendritic cells in mice with hepatitis[J].J Gastroenterol,2003,38(10):962 -967.
[10]Dai JH,Iwatani Y,Ishida T,et al.Glycyrrhizin enhances interleukin-12 production in peritoneal macrophages[J].Immunology,2001,103(2):235 -243.
[11]Beskina OA,Abramov AI,Gabdulkhakova AG,et al.Possible mechanisms of antioxidant activity of glycyrrhizic acid[J].Omeditsinskaia khimiia,2005,52(1):60 -68.
[12]Chen WH,Lu LG,Zeng MD,et al.Effect of magnesium isoglycyrrhizinate on the proliferation and oxidative stress of rat hepatic stellate cells in vitro[J].Zhonghua gan zang bing za zhi,2006,14(6):426-430.
[13]徐中南,吴锡铭,王佩,等.18-α甘草酸对大鼠四氯化碳慢性肝损伤的治疗作用[J].实用临床医药杂志,2011,15(21):1 -4.
[14]董丽萍,于锋,柳静,等.异甘草酸镁对D-氨基半乳糖急性肝损伤模型小鼠的保护作用研究[J].中国药房,2006,17(12):902-904.
[15]张宪祥,张炳远,吴力群,等.异甘草酸镁对肝切除术后的保肝作用[J].世界华人消化杂志,2010,18(2):189 -194.
[16]汤丽娜,林峰,沈赞,等.异甘草酸镁治疗抗肿瘤药物引起的急性药物性肝损伤的Ⅲ期临床试验[J].肿瘤,2012,32(9):738-743.
[17]朱林忠,宁涛,朱旭.异甘草酸镁与化疗药的相互作用的基础研究[J].中华肝胆外科杂志,2012,18(12):944 -947.
