肌肽对谷氨酸诱导SH-SY5Y细胞凋亡的保护作用
2015-07-07赵艳赵颂李晴方超张龙杨菁
赵艳,赵颂,李晴,方超,张龙,杨菁Δ
(1.辽宁医学院 科学实验中心,辽宁 锦州 121001;2.辽宁医学院 辽宁省心脑血管药物基础研究重点实验室,辽宁 锦州 121001)
肌肽对谷氨酸诱导SH-SY5Y细胞凋亡的保护作用
赵艳1,赵颂1,李晴2,方超2,张龙2,杨菁2Δ
(1.辽宁医学院 科学实验中心,辽宁 锦州 121001;2.辽宁医学院 辽宁省心脑血管药物基础研究重点实验室,辽宁 锦州 121001)
目的 探讨肌肽对谷氨酸所致人神经母细胞瘤株(SH-SY5Y)细胞损伤的保护作用及其机制。方法 用谷氨酸建立SH-SY5Y细胞损伤模型;倒置显微镜下观察细胞形态的变化;用四甲基偶氮唑蓝(MTT)法测定细胞存活率;Hoechst33258染色观察细胞核形态的变化;流式细胞仪检测细胞凋亡情况;荧光探针CDFH-DA法检测细胞中活性氧(ROS)的水平。结果 与正常组相比较,谷氨酸组的细胞存活率明显降低(P<0.01),荧光显微镜下可观察到细胞核固缩裂解等凋亡改变,细胞凋亡率、细胞中ROS水平明显升高(P<0.01);与谷氨酸组相比较,0.6、3、15 mmol/L肌肽保护组细胞存活率明显提高,细胞核的凋亡改变有明显改善,细胞凋亡率、细胞中ROS水平明显降低(P<0.01);单纯肌肽组的细胞形态、细胞存活率及细胞凋亡率与正常组相比无明显变化,细胞中ROS水平比正常组略低,但差异无统计学意义。结论 肌肽对谷氨酸所致的SH-SY5Y细胞凋亡具有保护作用,其机制可能与其抗氧化作用有关。
谷氨酸; 肌肽; SH-SY5Y细胞; 细胞凋亡
谷氨酸是哺乳动物脑内最主要的兴奋性神经递质,在中枢神经系统疾病中,谷氨酸常常大量释放并堆积,通过兴奋性毒性和氧化毒性等作用对神经细胞造成明显的损伤,从而引起各种神经退行性病变[1]。
肌肽是一种含组氨酸的二肽,在肌肉和脑组织中高表达,在生物体内具有多种生理活性作用,包括维持酸碱平衡、抗氧化作用、螯合剂、以及神经调节作用等[2]。肌肽作为一种内源性的抗氧化剂,它具有水溶性好、性质稳定、分子量小和易于被机体利用等优点[3]。本课题组研究表明,肌肽对大鼠脑片缺氧缺糖/再灌损伤具有保护作用[4]。在此基础上,进一步用SH-SY5Y细胞为研究对象,用谷氨酸诱导建立损伤模型,探讨肌肽对谷氨酸损伤神经细胞的保护作用及其可能的作用机制,为肌肽临床用药提供理论基础和实验依据。
1 材料与方法
1.1 材料
1.1.1 试剂:SH-SY5Y细胞购自中国医学科学院基础医学研究所北京协和医学院基础医学院;肌肽、胰蛋白酶、胎牛血清、青霉素、链霉素、L-谷氨酰胺、二甲基亚砜(DMSO)及四甲基偶氮唑蓝(methyl thiazolyl tetrazolium ,MTT)均购于Sigma公司;Annexin V-FITC购自北京四正柏生物科技有限公司;Hoechst33258、活性氧检测试剂盒、多聚甲醛购自上海碧云天生物技术有限公司。
1.1.2 仪器:美国BD公司流式细胞仪FACS Calibur;Thermo Scientific HERAcell 240i细胞培养箱;日本Olympus公司倒置显微镜和荧光显微镜;BioTekSynergyz全自动酶标仪。
1.2 方法
1.2.1 细胞培养:细胞置于含10%热灭活胎牛血清、100 U/mL青霉素和100 g/mL链霉素的DMEM培养基中,放于 37 ℃、 5%CO2细胞培养箱中培养。每3~4 d传代1次,取对数生长期细胞进行实验。
1.2.2 实验分组:细胞分为正常组、谷氨酸组、单纯肌肽组、0.6、3、15 mmol/L肌肽保护组。正常组加入新鲜培养基,谷氨酸组加入终浓度为20 mmol/L的谷氨酸[5],单纯肌肽组加入终浓度为15 mmol/L的肌肽,肌肽保护组分别加入终浓度为0.6、3、15 mmol/L的肌肽,培养1 h后再加入终浓度为20 mmol/L的谷氨酸,均继续培养48小时后检测各指标。
1.2.3 检测指标
① 观察SH-SY5Y细胞形态变化:各组细胞分别于倒置显微镜下观察形态并拍照。
② 细胞存活率的检测:各组细胞每孔加入5 g/L MTT溶液20 μL ,于培养箱中继续培养4 h,弃掉培养液,每孔加入150 μL二甲基亚枫,摇床上避光振荡10 min。在全自动酶标仪490 nm处测定光密度(A)值。
细胞存活率%=(实验组A值-空白对照组A值)/(正常组A值-空白对照组A值)×100%。
③ Hoechst33258荧光染色法观测细胞核形态变化: 用4%多聚甲醛室温固定细胞15 min,PBS洗1次,然后用Hoechst33258(50 mg/L)染色,37 ℃避光孵育20 min,PBS洗3次,在荧光显微镜下观察细胞核形态。
④ 细胞凋亡检测:用Annexin V和PI双染试剂盒检测细胞凋亡情况。收集细胞,用PBS洗2次,弃去上清,加入 5 μL Annexin V(10 mg/L)避光孵育10 min,再加入10 μL PI(20 mg/L),避光孵育10 min,流式细胞仪检测细胞凋亡率,采用cell-quest软件对数据进行获取和分析。
⑤ 细胞内活性氧(reactive oxygen species,ROS)检测:收集各组细胞[6],将细胞重悬于DCFH-DA终浓度为10 μM的无血清培养基中,轻轻吹打均匀后避光孵育20 min,以无血清培养基充分洗涤细胞3次后,使用酶标仪在488 nm激发波长和525 nm发射波长下检测荧光强度。ROS水平(%)=实验组FI/对照组FI×100%[7]。

2 结果
2.1 肌肽对谷氨酸损伤细胞形态学的影响 正常组细胞多呈梭形、多边形生长,细胞间连接紧凑,周边有突起,细胞透光性好;谷氨酸组细胞密度显著降低,部分细胞轴突回缩,细胞形态变圆、皱缩,细胞间连接松散,透光率降低;0.6、3、15 mmol/L肌肽保护组细胞密度较谷氨酸组明显增加,皱缩现象减轻,胞体突起增多,细胞间连接恢复紧密,细胞透光率提高,其中15 mmol/L肌肽保护组细胞形态改善最为明显;单纯肌肽组与正常组细胞比较细胞形态无明显变化,见图1。
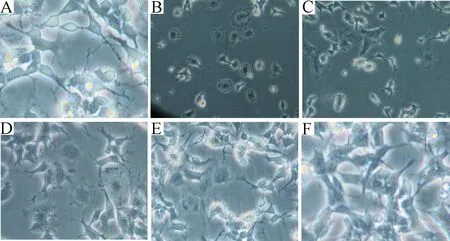
图1 倒置显微镜下观察SH-SY5Y细胞形态的变化(×200)A:正常组; B:谷氨酸组; C:0.6 mmol/L肌肽保护组; D:3.0 mmol/L肌肽保护组; E:15.0 mmol/L肌肽保护组; F:单纯肌肽组Fig.1 Morphological changes of SH-SY5Ycells observed by inverted-microscope(×200)A: Control group; B: Glutamate group; C: 0.6 mmol/L carnosine protection group; D: 3.0 mmol/L carnosine protection group; E: 15.0 mmol/L carnosine protection group; F:Simple carnosine group
2.2 肌肽对谷氨酸损伤的细胞存活率影响 与正常组相比,谷氨酸组的细胞存活率明显降低,达到(59.30±4.00)%(P<0.01),而0.6、3.0、15.0 mmol/L肌肽保护组细胞的细胞存活率较谷氨酸组明显提高,分别为(65.8±3.70)%、(74.80 ±2.60)%和(80.50±3.40)%(P<0.01),其中15.0 mmol/L肌肽保护组细胞的细胞存活率最高。见表1。



组别细胞存活率(λ=490nm)正常组1.000±0.030##谷氨酸组0.593±0.040**0.6mmol/L肌肽保护组0.658±0.037**##3.0mmol/L肌肽保护组0.748±0.026**##15.0mmol/L肌肽保护组0.805±0.034**##单纯肌肽组1.000±0.034##
**P<0.01,与正常组比较,compared with normal control group;##P<0.01,与谷氨酸组比较,compared with glutamate group
2.3 肌肽对细胞核形态的影响 正常组细胞可见细胞核染色均匀,细胞核圆形或椭圆形。谷氨酸组可观察到细胞核变形、核固缩,甚至细胞核裂解(箭头所示)。0.6、3、15 mmol/L肌肽保护组细胞核形态明显改善,核变形固缩减少。单纯肌肽组与正常组比较细胞核形态无明显变化。见图2。
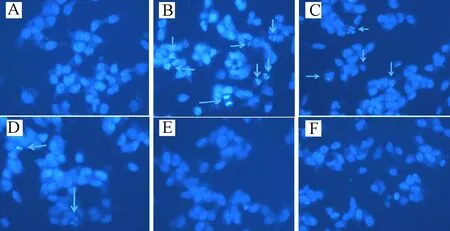
图2 荧光显微镜检测SH-SY5Y细胞核的形态变化A:正常组; B:谷氨酸组; C:0.6 mmol/L肌肽保护组; D:3.0 mmol/L肌肽保护组; E:15.0 mmol/L肌肽保护组; F:单纯肌肽组Fig.2 Morphological changes of SH-SY5Y cells nucleus under fluorescent microscopeA: Control group; B: Glutamate group; C: 0.6 mmol/L carnosine protection group; D: 3.0 mmol/L carnosine protection group; E: 15.0 mmol/L carnosine protection group; F:Simple carnosine group
2.4 肌肽对谷氨酸引起的细胞凋亡的影响 与正常组相比较,谷氨酸组细胞凋亡率明显升高,与谷氨酸组相比较,0.6、3.0、15.0 mmol/L肌肽保护组细胞凋亡率均有所降低,且随着肌肽浓度的增高凋亡率下降更为明显。单纯肌肽组与正常组相比无明显变化(见图3)。
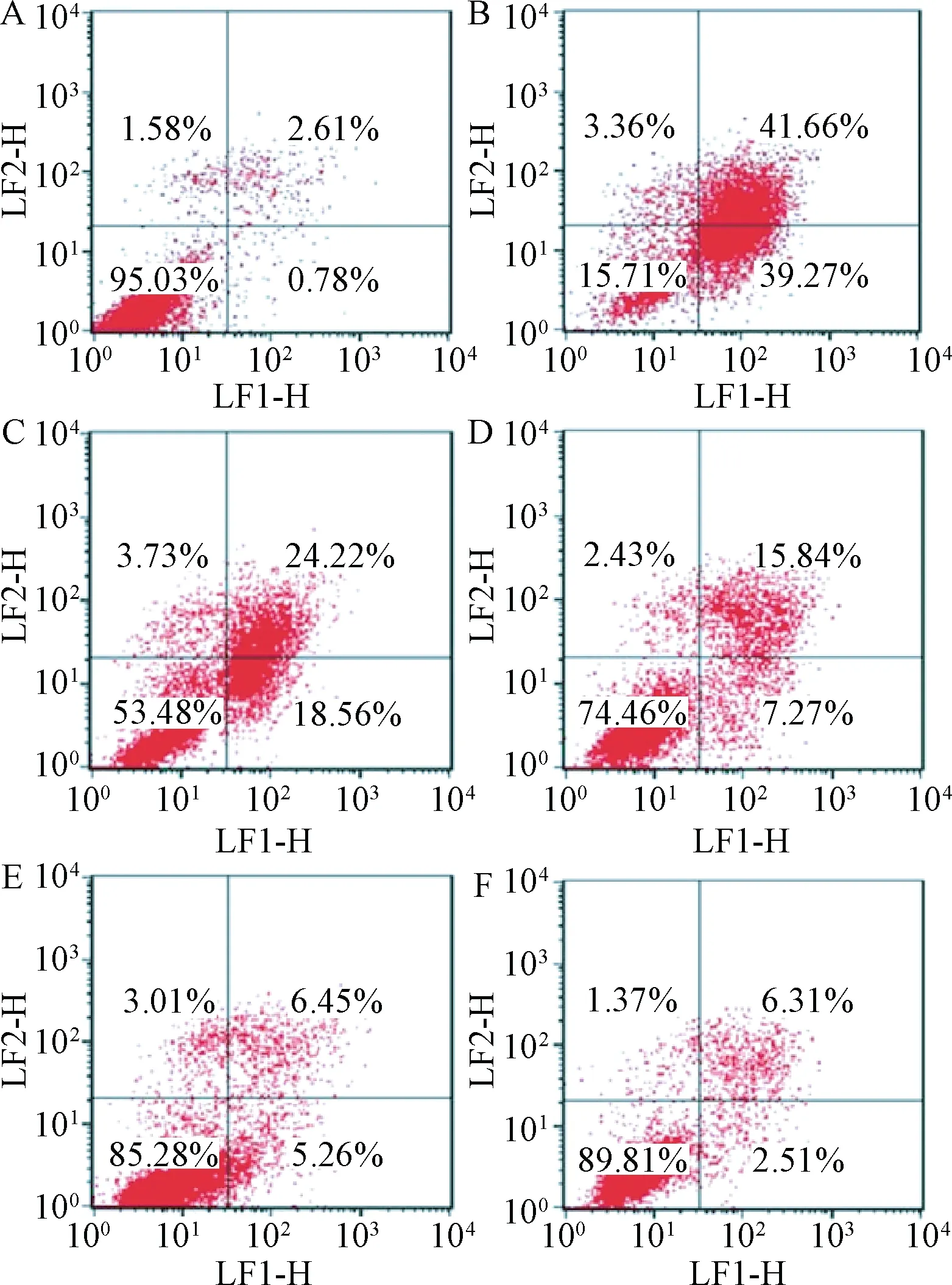
图3 肌肽对谷氨酸诱导SH-SY5Y细胞凋亡率的影响A:正常组; B:谷氨酸组; C:0.6 mmol/L肌肽保护组; D:3.0 mmol/L肌肽保护组; E:15.0 mmol/L肌肽保护组; F:单纯肌肽组Fig.3 Effects of carnosine on apoptosis rate of glutamate injured SH-SY5Y cellA: Control group; B: Glutamate group; C: 0.6 mmol/L carnosine protection group; D: 3.0 mmol/L carnosine protection group; E: 15.0 mmol/L carnosine protection group; F:Simple carnosine group
2.5 肌肽对ROS水平的影响 与正常组相比较,谷氨酸组ROS水平明显增高;0.6、3.0、15.0 mmol/L肌肽保护组细胞的ROS水平与谷氨酸组比较均有一定程度的降低,且随着肌肽浓度的增高ROS水平降低更为明显(P<0.05),单纯肌肽组与正常组比较略有降低,但差异无统计学意义。见表2。


组别ROS水平(%)正常组100±10 谷氨酸组188±19**0.6mmol/L肌肽保护组174±7**#3.0mmol/L肌肽保护组159±10**##15.0mmol/L肌肽保护组137±10**##单纯肌肽组91±11##
**P<0.01,与正常组比较,compared with normal control group;#P<0.05,##P<0.01,与谷氨酸组比较,compared with glutamate group
3 讨论
人神经母细胞瘤株SH-SY5Y细胞系是一种分化程度较低的肿瘤细胞。该细胞繁殖快,细胞形态、生理和生化功能与正常神经细胞相似,已被广泛用于神经分泌模型的建立和神经元损伤机制的研究[8]。实验结果表明,谷氨酸组细胞凋亡率明显升高,细胞核呈现明显的凋亡特征,说明20 mmol/L谷氨酸可以引起细胞凋亡。而0.6、3.0、15.0 mmol/L肌肽保护组细胞的存活率比谷氨酸组大大提高,细胞核形态明显改善,凋亡率显著减少,说明不同浓度的肌肽对谷氨酸诱导的凋亡具有保护作用。
谷氨酸除通过激活谷氨酸受体产生兴奋性毒性引起DNA的氧化损伤外,还可通过抑制细胞膜上谷氨酸/胱氨酸转运体的功能而产生氧化毒性作用,该作用以细胞内谷胱甘肽耗竭和ROS成分升高为主要特征[9]。ROS过多堆积,引起不同程度的细胞毒性反应,如膜脂质、DNA氧化损伤和蛋白质的表达异常等,最终导致细胞凋亡。实验结果可见,谷氨酸组ROS的含量明显升高,而0.6、3.0、15.0 mmol/L肌肽保护组细胞的ROS水平明显降低。有文献报道,肌肽具有的抗氧化作用,可以抑制由铁、铜、肌红蛋白和脂肪氧化酶引起的脂肪氧化反应,还能与大多数自由基相互作用,从而调节ROS的含量[10]。本实验结果与文献报道一致。
综上所述,肌肽能够抑制谷氨酸引起的细胞凋亡,机制可能与其阻止兴奋性和氧化性毒性级联反应的进一步发展,从而抑制细胞凋亡发生相关。
[1] Dong XX, Wang Yan, Qin ZH, et al. Molecular mechanisms of excitotoxicity and their relevance to pathogenesis of neurodegenerative diseases[J] ActaPharmacol Sin, 2009,30(4): 379-387.
[2] Mizuno D, Konoha-Mizuno K, Mori M, et al.Protective activity of carnosine and anserine against zinc-induced neurotoxicity: a possible treatment for vascular dementia [J] .Metallomics, 2015, 7(8): 1233-1239.
[3] Hipkss AR,Cartwright SP, Bromley C,et al.Carnosine:can understanding its actions on energy metabolism and protein homeostasis inform its therapeutic potential?[J].Chem CentJ, 2013, 7(1):38-47.
[4] 方超,李晴,鲁美丽,等.肌肽对大鼠脑片缺氧/再灌损伤的保护作用,中国生化药物杂志,2015,35(9):41-47.
[5] Nampoothiri M,Reddy ND, John J, et al. Insulin blocks glutamate-induced neurotoxicityin differentiated SH-SY5Y neuronal cells[J].Behav Neurol, 2014: 674164.
[6] Ferrarese C, Begni B, Canevari C, et al. Glutamate uptake is decreased in platelets from Alzheimer’s disease patients [J].Ann Neurol, 2000,47: 641-643.
[7] Rosenstock TR,CarvaLNo AC,Jurkiewicz A,et al.Mitochondrial calcium,oxidative stress and apoptosis in a neurodegenerative disease model induced by 3-nitropropionic acid[J].Neurochem,2004,88(5):1220-1228.
[8] Ha JS, Lim HM, Park SS. Extracellular hydrogen peroxide contributes to oxidative glutamate toxicity[J].Brain Res, 2010,1359: 291-297.
[9] 邱瑜,陈红专,金正均. 谷氨酸神经细胞毒作用的新途径-谷氨酸/胱氨酸转运体介导机制[J]中国药理学通报,2000,16(3):251-254.
[10] Hipkiss AR. Carnosine and its possible roles in nutrition and health[J].Adv Food Nutr Res, 2009, 57:87-154.
(编校:谭玲)
Protective effect of carnosine on Glutamate induced apoptosis in SH-SY5Y cells
ZHAO Yan1, ZHAO Song1, LI Qing2, FANG Chao2, ZHANG Long2, YANG Jing2Δ
(1. Scientific Experimental Center, Liaoning Medical University, Jinzhou 121001, China; 2. Provincial Key Laboratory of Cardiovascular and Cerebrovascular Drug Basic Research, Liaoning Medical University, Jinzhou 121001, China)
ObjectiveTo investigate the protective effect of carnosine on Glutamate induced apoptosis in SH-SY5Y cells and its mechanism.MethodsThe injury model was established by treating SH-SY5Y cells with glutamate in vitro. Inverted microscope was used to observe cell morphology. The cell viability was detected by MTT assay, and changes in nucleus were detected by Hoechst33258 staining under fluorescence microscopy. The cell apoptosis rates were measured by flow cytometry. The reactive oxygen species (ROS) level in cells was detected by fluorescent probe CDFH-DA. Results Compared with normal control group, the cell viability in glutamate group decreased (P<0.01), the morphology changes of cell apoptosis such as karyopyknosis and split were observed by Hoechst33258 staining, while the apoptosis rate and the level of ROS were increased (P<0.01). Compared with glutamate group, the cell viability of carnosine 0.6,3,15 mmol/L groups obviously increased(P<0.01), while the morphology changes of cell apoptosis significantly improved, the apoptosis rate and the level of ROS were obviously reduced (P<0.01). Compared with normal control group, the cell viability, the morphology changes and the apoptosis rate did not significantly change in carnosine group. The level of ROS was reduced, but there was no statistically significant difference between two groups. ConclusionCarnosine has apparent protective effect on apoptosis of SH-SY5Y cells injury induced by glutamate. The mechanism may be related to carnosine prevent the occurrence of oxidative stress.
glutamate; carnosine; SH-SY5Y cells; apoptosis
辽宁省科技项目(2013225305);辽宁医学院“校长基金”奥鸿博泽基金医药创新基金(XZJJ20130103-01)
赵艳,女,硕士,研究方向:生化药物,E-mail:zhaoyan73@163.com; 杨菁,通信作者,博士后,教授,研究方向: 神经生物学及相关药物,E-mail:lnmuyangjing@126.com。
R963,R971
A
1005-1678(2015)12-0029-04
