L-肌肽对鱼藤素诱导SH-SY5Y细胞神经毒性的保护作用
2019-03-13柳传毅陈彦洁方琼彤吕满霞吴新荣
柳传毅,陈彦洁,方琼彤,吕满霞,吴新荣
(1.广东药科大学药学院,广东 广州 510006;2. 广州军区广州总医院药剂科,广州市老年慢病患者合理用药重点实验室,广东 广州 510010)
肌肽是主要由β-丙氨酸和L-组氨酸组成的内源性二肽,目前的研究证实,肌肽具有清除自由基、抗氧化活性,药理活性广泛。因肌肽具有高效的药理活性和低毒的特征,研究者认为,其可以为阿尔茨海默症、脑卒中等疾病的治疗提供新的方向。Holliday等[6]在MRC-5成纤维细胞和HeLa细胞模型上,研究得出20~50 mmol·L-1的肌肽并不影响正常二倍体人成纤维细胞的生长,但是能促进细胞的生长。目前尚未完全得出PD发病机制,但已被证实的机制有氧化应激、清除自由基等。Boldyrev等[7]报道,肌肽能够明显改善PD神经症状,并能提高血红细胞中Cu/Zn-超氧化物歧化酶的活性。研究报道,肌肽对临床上的多种抗肿瘤药物诱导的毒副作用具有保护作用。Noori等[8]实验证实,肌肽能够有效抑制由顺铂诱导的氧化应激导致的超氧化物歧化酶、过氧化物水平的降低。综上所述,肌肽主要是通过清除自由基、抗氧化应激等机制发挥作用,由此可得出肌肽是一种极具有潜在治疗PD的药物。本研究以SH-SY5Y细胞作为模型,研究L-肌肽是否通过抗氧化应激作用,来降低由鱼藤素诱导的神经毒性,进而探究鱼藤素的神经毒性。
1 材料
1.1细胞株人神经瘤细胞株 SH-SY5Y,由广州军区广州总医院医学实验科提供。
1.2试剂鱼藤素(deguelin,批号:045M4736V,HPLC级)、L-肌肽(批号:BCBQ8925V)、二甲基亚砜(批号:RNBD6895)、Accutase solution(细胞消化液,批号:SLBN5790V),均购自Sigma公司;Annexin V-FITC细胞凋亡检测试剂盒(批号:C1065-2)、活性氧检测试剂盒(批号:S0033-1),均购自碧云天公司;胎牛血清,杭州四季青生物工程材料有限公司,批号:20151225;CCK-8试剂,日本同仁公司,批号:JU739;RPMI 1640培养基,Gibco公司,批号:8116053;吖啶橙/溴化乙锭(AO/EB)双染试剂盒,索莱宝公司,批号:20160111。
1.3仪器二氧化碳培养箱、Multiscan-GO全波长酶标仪(美国Thermo公司);YSK-319型倒置显微镜、IX7型倒置荧光显微镜(日本Olympus公司);YSK-239型低温高速离心机(Sigma公司);流式细胞仪(美国Millipore公司)。
2 方法
2.1药物的配制
2.1.1鱼藤素的配制 1 mmol·L-1鱼藤素母液配制:在6.3 mL的DMSO溶液中溶解2.5 g鱼藤素,并在-20 ℃条件下避光保存,不同溶度的鱼藤素用培养基稀释,现配现用。
2.1.2L-肌肽的配制 将L-肌肽加入到不同体积的培养基中,配制成实验所需浓度,并用无菌过滤膜过滤,现配现用。
5.实验环境。在检验过程中环境温度控制不到位,使得温度增加变化较大,会影响到检验仪器设备、试剂的正常运行和工作,使得仪器的精准度发生变化,继而影响到食品检验结果的准确性。
2.2细胞培养从细胞库中取出SH-SY5Y细胞,快速解冻并在超净台上将细胞转移到离心管中,加入适量已配好的新鲜培养基,离心,取下沉液,后加入新鲜的培养基,培养于37 ℃、5% CO2的恒温箱中,取对数生长期细胞用于实验。
2.3CCK-8法检测细胞存活率取对数生长期细胞,将细胞接种于96孔板,细胞密度为5×107·L-1,每孔接种细胞100 μL后,放入5% CO2培养箱培养,使细胞贴壁。
2.3.1L-肌肽对SH-SY5Y细胞存活率的影响 次日加药前,去除旧的培养基,每组设5个复孔,其中实验组每孔100 μL,加入不同浓度的L-肌肽(1、10、20、40、60、80、100 mmol·L-1),其中空白组无细胞,只有培养基,对照组只加相同培养基。加药后,96孔板中继续培养24 h。
2.3.2L-肌肽对鱼藤素抑制SH-SY5Y细胞增殖作用的影响 次日加药前,去除旧的培养基,后加入100 μL不同浓度的药物,其中实验组加入情况如下:A组:8 μmol·L-1鱼藤素;B组:8 μmol·L-1鱼藤素+3 mmol·L-1L-肌肽;C组:8 μmol·L-1鱼藤素+30 mmol·L-1L-肌肽;D组:20 μmol·L-1鱼藤素;E组:20 μmol·L-1鱼藤素+3 mmol·L-1L-肌肽;F组:20 μmol·L-1鱼藤素+30 mmol·L-1L-肌肽;G组:50 μmol·L-1鱼藤素;H组:50 μmol·L-1鱼藤素+3 mmol·L-1L-肌肽;I组:50 μmol·L-1鱼藤素+30 mmol·L-1L-肌肽,每组设置5个复孔,对照组只加培养基,空白组无细胞,只加培养基。加药后,置于培养箱中继续培养24 h后,除去旧培养基,将培养基与CCK-8试剂按照9 ∶1的比例配制成混合溶液后,每孔加入100 μL混合液,培养板继续在CO2培养箱培养,避光反应2 h,在450 nm波长处,酶标仪测定吸光度。细胞存活率/%=[(OD实验组-OD空白组)/(OD对照组-OD空白组)]×100%。实验平行重复3次。
2.4AO/EB法检测细胞形态和凋亡情况取对数生长期细胞,接种在6孔板中,每孔接种3 mL密度为5×107·L-1,均匀分布。在恒温培养箱培养,使细胞贴壁。不同实验分组如下:A组:对照组,只加培养基;B组:20 μmol·L-1鱼藤素;C组:30 mmol·L-1L-肌肽;D组:20 μmol·L-1鱼藤素+30 mmol·L-1L-肌肽。作用24 h后,用PBS溶液洗涤2次,每孔加入1 mL的PBS。配制AO溶液 ∶EB溶液=1 ∶1的工作液,每孔加入20 μL工作液,室温放置5 min。最后在荧光倒置显微镜下进行观察,并拍照。
2.5AnnexinV-FITC/PI双染流式细胞术检测细胞凋亡率取对数生长期细胞,接种6孔板,每孔接种3 mL密度为5×107·L-1,均匀分布,在CO2培养箱培养,使细胞贴壁。次日除去旧培养基并加药,实验分组情况同“2.3.2”。药物作用24 h后,收集细胞液,并用PBS液洗涤2次,在显微镜下计数,将细胞液重悬于EP管中,除去上清液,加入195 μL结合液和5 μL Annexin V-FITC混匀,混匀后加入10 μL PI,混匀液再次混匀,后用流式细胞仪检测细胞凋亡率。
2.6流式细胞术检测细胞ROS水平取对数生长期细胞,接种6孔板,每孔接种3 mL密度为5×107·L-1,均匀分布。在CO2培养箱培养,使细胞贴壁。不同实验分组同“2.3.2”。24 h后收集细胞液,离心5 min,吸取上清液,用无血清培养基按1 000 ∶1比例稀释10 mmol·L-1DCFH-DA母液,用1 mL稀释液悬浮细胞,在37 ℃避光条件下孵育30 min,期间每隔5 min振荡1次,离心后,PBS洗涤,PBS重悬细胞。用流式细胞仪检测各组细胞ROS水平。

3 结果
3.1L-肌肽对细胞存活率的影响如Fig 1所示,与对照组相比,药物作用24 h后, 0~100 mmol·L-1的L-肌肽对SH-SY5Y细胞的存活率并没有明显影响,在最高浓度100 mmol·L-1时,其对细胞存活率的影响无统计学意义,结果说明,在0~100 mmol·L-1范围内,L-肌肽对SH-SY5Y细胞没有明显的抑制作用。Holliday等[9]研究证实,20~50 mmol·L-1肌肽不仅不影响正常二倍体成纤维细胞的存活,而且还能促进细胞的生长,故本实验选取低浓度3 mmol·L-1的L-肌肽与30 mmol·L-1的L-肌肽。
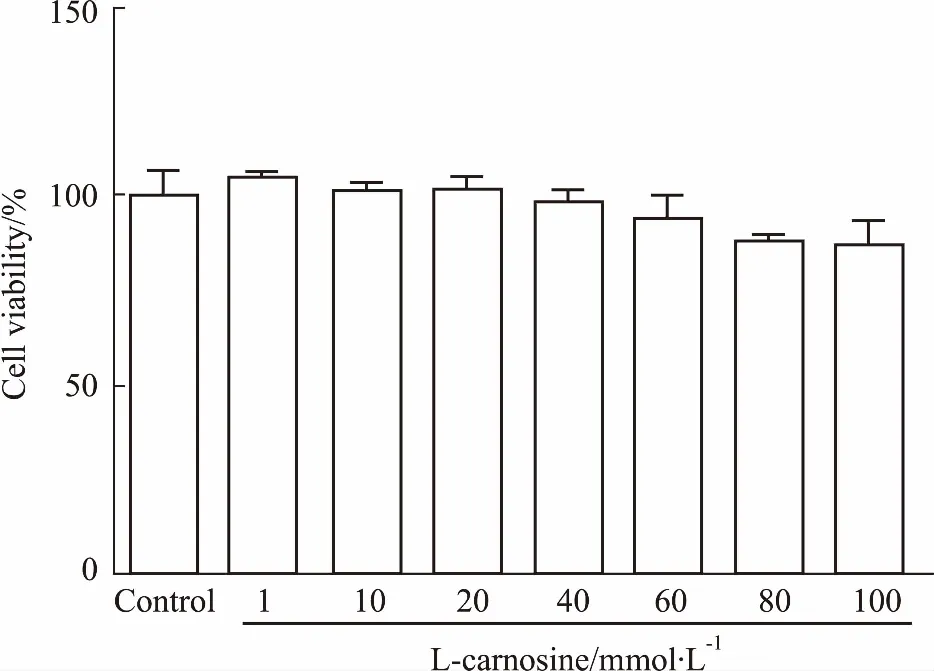
Fig 1 Effect of different concentrations of L-carnosine treated 24 h on viability of SH-SY5Y cells n=3)
如Fig 2 所示,药物作用24后,3 mmol·L-1与30 mmol·L-1的L-肌肽和鱼藤素共作用于SH-SY5Y细胞,能有效降低鱼藤素对细胞的抑制作用。与鱼藤素单独作用的细胞的抑制率相比,3 mmol·L-1L-肌肽与20 μmol·L-1鱼藤素对细胞的抑制率降低了5.01%(P<0.05),30 mmol·L-1L-肌肽与20、50 μmol·L-1鱼藤素对细胞的抑制率分别降低9.07%和6.1%(P<0.05)。结果表明,30 mmol·L-1L-肌肽能够有效降低鱼藤素对SH-SY5Y细胞的增殖抑制作用,保护SH-SY5Y细胞。
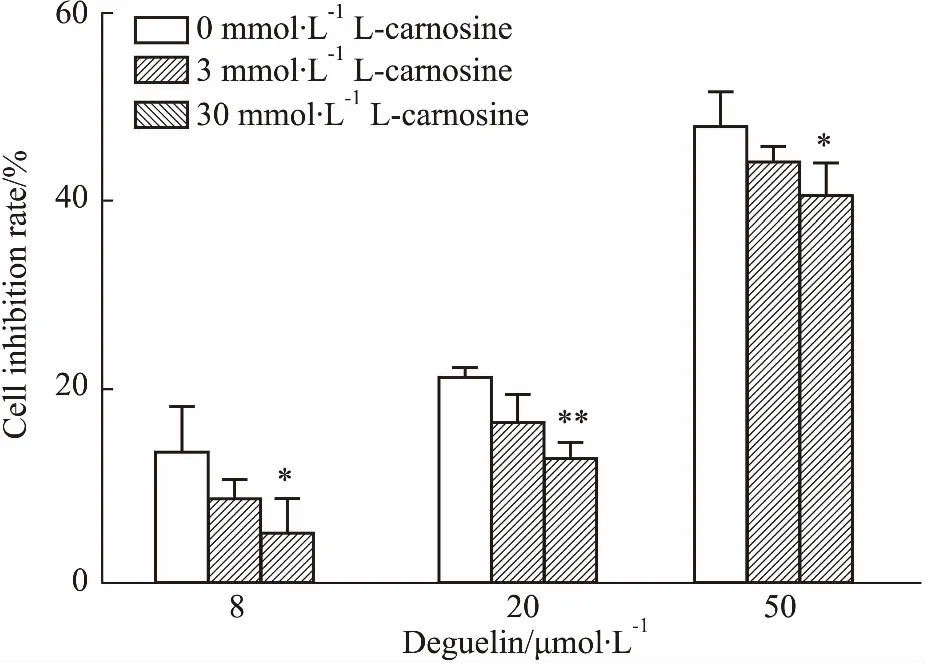
Fig 2 Effect of different concentrations of deguelin and L-carnosine treated 24 h on inhibitory rate of SH-SY5Y cells n=3)
**P<0.05,**P<0.01vs0 mmol·L-1L-carnosine group
3.2L-肌肽对细胞形态和凋亡的影响24 h后,细胞凋亡形态如Fig 3所示,30 mmol·L-1L-肌肽处理组,核内染色质均匀,细胞呈多边形,少见明显的凋亡特征。C组20 μmol·L-1鱼藤素处理组,部分细胞表现出早期凋亡特征,细胞体积减小,核固缩呈新月状。D组30 mmol·L-1L-肌肽和20 μmol·L-1鱼藤素组,早期凋亡细胞数减少,表明L-肌肽能有效的降低鱼藤素对细胞的诱导凋亡作用。
3.3L-肌肽影响细胞凋亡率Tab 1、Fig 4结果显示,与单独鱼藤素的C组相比,D组的早期凋亡率降低9.35%,总凋亡率降低10.7%,差异有统计学意义(P<0.05),表明L-肌肽可有效保护细胞,抑制细胞凋亡。

Fig 3 Apoptotic morphology of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 h with AO/EB double stained (×200)
A: Control group; B: 30 mmol·L-1L-carnosine treated group; C: 20 μmol·L-1deguelin treated group; D: 20 μmol·L-1deguelin and 30 mmol·L-1L-carnosine cotreated group. Arrows: apoptotic cell.
Tab 1 Apoptotic rate of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 n=3)
A: Control group; B: 30 mmol·L-1L-carnosine treated group; C: 20 μmol·L-1deguelin treated group; D: 20 μmol·L-1deguelin and 30 mmol·L-1L-carnosine co-treated group.*P<0.05vsgroup A;#P<0.05vsgroup C.
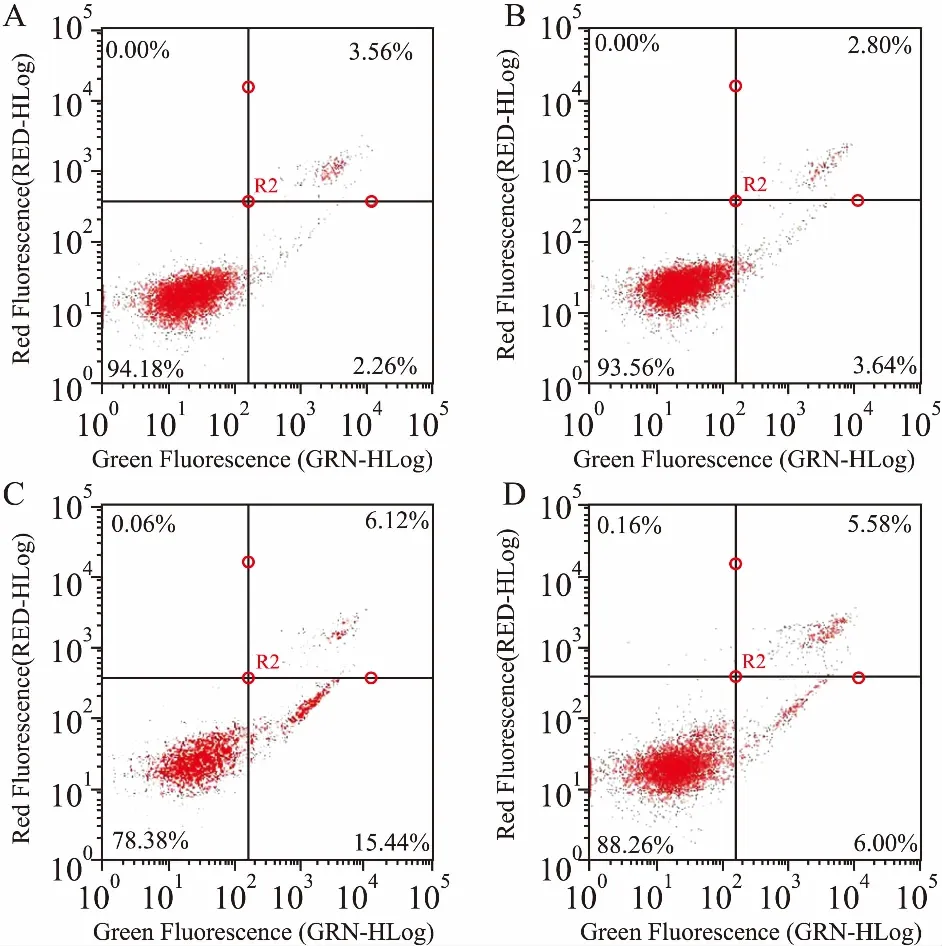
Fig 4 Apoptotic rate of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 h
A: Control group; B: 30 mmol·L-1L-carnosine treated group; C: 20 μmol·L-1deguelin treated group; D: 20 μmol·L-1deguelin and 30 mmol·L-1L-carnosine co-treated group.
3.4L-肌肽影响细胞的ROS水平如Fig 5所示,与对照组相比,30 mmol·L-1L-肌肽作用后,SH-SY5Y细胞的ROS水平较低,差异有统计学意义(P<0.05)。D组30 mmol·L-1L-肌肽和鱼藤素共处理组,ROS水平较鱼藤素单独处理组低,差异有统计学意义(P<0.05)。表明L-肌肽的神经保护作用可能是通过降低细胞内ROS水平实现的。
4 讨论
SH-SY5Y细胞是一种分化程度较低的肿瘤细胞,衍生于人的神经母细胞瘤细胞系,其具有酪氨酸羟化酶、多巴胺羟化酶活性和多巴胺转运体, 因此,该细胞系被广泛运用于神经系统疾病发病机制的研究,特别是应用于PD发病机制的研究。本研究以SH-SY5Y细胞为模型,用CCK-8法检测L-肌肽对细胞增殖的影响,结果表明,高浓度100 mmol·L-1的L-肌肽对细胞的增殖并无明显的抑制作用,3、30 mmol·L-1的L-肌肽在一定程度上能有效降低鱼藤素对细胞的增殖抑制作用,尤其是30 mmol·L-1L-肌肽对20 μmol·L-1鱼藤素导致的细胞增殖抑制作用的效果最为明显(细胞抑制率降低近10%),故采用30 mmol·L-1L-肌肽与20 μmol·L-1鱼藤素组进行其他相关实验。通过AO/EB实验和细胞形态观察发现,与同浓度的单独鱼藤素组相比,30 mmol·L-1L-肌肽共处理组,细胞的形态得到改善,表现为早期凋亡数减少,说明L-肌肽能够降低鱼藤素对细胞的诱导凋亡作用。

Fig 5 Determination of ROS level of SH-SY5Y cells after treatment with deguelin and L-carnosine for 24 h
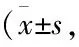
采用Annexin V-FITC/PI双染流式细胞术定量检测细胞凋亡率,结果发现,30 mmol·L-1L-肌肽共处理组比20 μmol·L-1鱼藤素组细胞的早期凋亡率较小,降低9.35%,同时总凋亡率降低10.7%(P<0.05),故可得知L-肌肽对细胞的保护作用可能是通过抑制细胞的凋亡实现的。
线粒体是氧化应激的主要来源之一,因为它利用氧气作为能量,产生应激反应。 ROS通常由紧密调节酶产生,如果过度刺激电子传递链将会导致ROS的过量产生。ROS涉及许多疾病,包括线粒体蛋白质的改变,线粒体脂质和线粒体DNA,这些疾病将导致神经细胞的损伤。氧化应激被认为是许多病因的主要原因,包括PD和阿尔茨海默病。研究者发现几个与PD有关的基因涉及到线粒体的功能,神经退行性疾病发生的原因可能是线粒体功能障碍[10]。Dexter等[11]认为,氧化应激是导致PD的主要原因之一。之前研究发现,鱼藤素存在神经毒性是因为其作用于细胞的同时,抑制了线粒体复合体I,线粒体复合体I被抑制后,电子传递链将无法进行,导致ROS水平升高[12]。本研究采用DCFH-DA染色,流式细胞术检测不同组的细胞ROS水平,结果发现,与对照组相比,30 mmol·L-1L-肌肽组作用于SH-SY5Y细胞后的 ROS水平较低(P<0.05),其中,30 mmol·L-1L-肌肽和鱼藤素共处理组,ROS水平较鱼藤素单独处理组低(P<0.05),表明L-肌肽保护神经细胞毒性的机制可能是通过抗氧化应激反应。
本研究证实,L-肌肽主要通过抗氧化机制来降低细胞的神经毒性,与鱼藤素联用时,可以降低鱼藤素诱导的神经毒性,这为进一步研究鱼藤素神经毒性和寻找降低鱼藤素毒性的方法提供了依据。
