肌肽在体外氧化反应中的作用
2018-07-04章诗琪
章诗琪, 夏 莉, 章 秋
肌肽是一种由β-丙氨酸和组氨酸组成的二肽(histidine containing dipeptides, HCD),是一种水溶性的晶体物质。肌肽具有抗氧化、抗糖基化、抗炎、抗增殖等多种生物学作用[1]。在肌肽的众多保护性作用中,抗氧化功能是最早被发现,也是最为重要的作用。肌肽的保护性作用多是基于其抗氧化功能。例如,肌肽因其抗氧化作用而对糖尿病肾病具有一定的改善作用[2]。然而,有研究者发现肌肽可以增强铁和碘引起的鲁米诺氧化反应[3-4]。这种相悖的结果很可能是由于衡量氧化反应的系统不一致导致的。因此,该研究拟分别以辣根过氧化物酶(horseradish peroxidase,HRP)或FeCl3为氧化剂,在蓝四氮唑比色法[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、3,3′-5,5′-四甲基联苯胺(3,3′,5,5’-tetra-methyl-benzidine,TMB)及鲁米诺反应系统中分别评估肌肽对氧化反应的作用。
1 材料与方法
1.1细胞、主要试剂与仪器人脐静脉内皮细胞(human umbilical cord cells, HUVEC)购自德国Promo Cell公司;内皮细胞生长培养液购自德国Provitro公司;DMEM/F-12(GlutaMAXGibco®)及小牛血清(fetal calf serum, FCS)购自美国Gibco公司;豆蔻酸-12佛波醇-13乙酸酯(PMA)、FeCl3、肌肽、鲁米诺及p-香豆酸均购自美国Sigma公司;HRP购自美国Vector Laboratories公司;TMB购自瑞士Roche公司;过氧化氢购自德国Merck公司;酶联免疫检测仪(Infinite M200)购自瑞士TECAN公司。
1.2人脐静脉内皮细胞的培养本实验用HUVEC来分析肌肽在MTT实验中对细胞的抗氧化作用。接种HUVEC前1 d,细胞培养板需要用1%明胶覆盖过夜,隔日去除明胶,将HUVEC置于含有2% FCS的内皮细胞生长培养液以及5% CO2、37 ℃的培养箱中培养。
1.3中性粒细胞的分离与培养本实验用中性粒细胞来分析肌肽在化学发光法中对细胞的促氧化作用。中性粒细胞从健康志愿者的EDTA全血中分离,志愿者均签署知情同意书。中性粒细胞具体分离方法参考相关文献[5]。从全血中提取出的中性粒细胞由DMEM/F-12稀释,以每孔105个细胞的浓度种植于96孔板。因PMA可以刺激中性粒细胞产生活性氧(reactive oxygen species, ROS),故1 μg/ml PMA以及不同浓度的肌肽随之加入中性粒细胞中,并在37 ℃的培养箱中孵育1 h。不同条件下中性粒细胞产生ROS的量采用化学发光法测量。
1.4MTT实验检测细胞存活率细胞在氧化剂FeCl3作用下可能发生细胞凋亡[6],而本实验则利用MTT实验衡量细胞在FeCl3和肌肽作用下的存活率。HUVEC在96孔板中连续培养2 d后,加入培养液(对照组)或溶有300 μmol/L FeCl3和(或)20 mmol/L肌肽的培养液(实验组)中孵育。每孔溶液的总量为100 μl。孵育24 h后于每孔中加入10 μl MTT溶液(5 mg/ml),继续在37 ℃孵育4~5 h。当孔板中形成不溶的甲臜后,再加入100 μl以10%浓度溶于10 mmol/L盐酸的十二烷基硫酸钠。再次将96孔板孵育过夜直至甲臜结晶完全溶解。MTT实验详细步骤如本项目另一文献[6]所述。最终用酶联免疫检测仪测定细胞在540 nm波长处的吸光值。对照组中HUVEC的细胞存活率被认定为100%,其余实验组的细胞存活率根据相对吸光值计算。本实验中每一个处理条件均重复至少6次。
1.5TMB实验TMB能够与HRP发生反应形成深蓝色沉淀,从而检测实验中的氧化反应。首先,将0.1 μg/ml HRP或300 μmol/L FeCl3作为氧化物,分别与水或20 mmol/L肌肽混匀以100 μl总量加入透明的96孔板,再将200 μl TMB加入溶液用以显色。最终加入50 μl 1 mmol/L的硫酸终止显色反应。实验共分为4组:去离子水对照组、肌肽对照组、HRP或 FeCl3组、HRP或FeCl3+肌肽组。显色反应激发的450 nm波长的吸收光用酶联免疫检测仪测量。
1.6鲁米诺反应鲁米诺能够与氧化剂反应而激发出蓝光。在细胞外的鲁米诺反应中,20 mmol/L肌肽、300 μmol/L FeCl3和0.1 μg/ml HRP以100 μl总量加入白色的96孔板。再加入2.5 mmol/L鲁米诺、0.9 mmol/L p-香豆酸以及0.03%过氧化氢,10 min后再用酶联免疫检测仪测量化学发光。此实验共分为4组:去离子水对照组、肌肽对照组、HRP或 FeCl3组、HRP或FeCl3+肌肽组。另外,本实验在鲁米诺反应中加入抗氧化物质N-辛酰基多巴胺(N-octanoyl dopamine,NOD)、氯化锌(ZnCl2)或铁螯合剂去铁胺(deferoxamine,DFO)进一步证明肌肽在鲁米诺反应中的氧化作用。
与上述细胞外的鲁米诺反应不同,在中性粒细胞中发生的鲁米诺反应则仅用鲁米诺及p-香豆酸显色,而不加入外源性过氧化氢。鲁米诺反应所需的过氧化氢是由PMA刺激中性粒细胞去颗粒化产生的。

2 结果
2.1MTT实验中肌肽对氧化反应的作用MTT实验假定对照组中的HUVEC细胞存活率为100%,本实验结果则显示仅加入肌肽对HUVEC细胞存活没有影响,但300 μmol/L FeCl3使HUVEC的细胞存活率显著下降至(11.06±3.84)%(P<0.05)。而20 mmol/L肌肽能够阻止FeCl3对HUVEC的影响,此组细胞的存活率再次上升至(158.79±3.91)%(P<0.05),见图1。
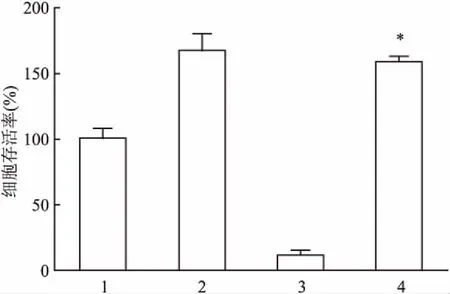
图1 MTT实验检测肌肽及FeCl3对HUVEC的影响
1:对照组;2:20 mmol/L 肌肽;3:300 μmol/L FeCl3;4:20 mmol/L 肌肽+300 μmol/L FeCl3;与300 μmol/L FeCl3组比较:*P<0.05
2.2TMB实验中肌肽对氧化反应的作用在细胞外的TMB实验中,肌肽本身不能激发氧化反应而产生光密度(P>0.05),见图2A。氧化剂HRP(图2A)和FeCl3(图2B)均能增强光密度(P<0.05),且HRP的氧化能力明显大于FeCl3(P<0.05)。另外,肌肽并不影响HRP和FeCl3导致的氧化反应(P>0.05),见图2。

图2 TMB实验观察肌肽对HRP或FeCl3导致的氧化反应的影响
A:HRP;B:FeCl3;1:对照组;2: 20 mmol/L 肌肽;3: 0.1 μg/ml HRP;4: 0.1 μg/ml HRP+20 mmol/L 肌肽;5:300 μmol/L FeCl3;6:300 μmol/L FeCl3+20 mmol/L 肌肽;与对照组比较:*P<0.05
2.3鲁米诺实验中肌肽对氧化反应的作用在细胞外的鲁米诺实验中,肌肽本身可以不依赖任何氧化剂的催化而显著增强化学发光反应(P<0.05),然而,肌肽对鲁米诺实验的氧化作用要远低于HRP的作用(P<0.05),见图3A。但是如果在肌肽参与的反应中加入HRP,化学发光的强度会远远超过单独使用肌肽或HRP(P<0.05),见图3A。本实验中FeCl3并未能氧化并催化鲁米诺反应,只有加入肌肽才能显著性提高其化学发光强度(P<0.05),见图3B。
另外,HRP或FeCl3催化的反应中,抗氧化物质N-辛酰基多巴胺(N-octanoyl dopamine,NOD)、氯化锌(ZnCl2)或铁螯合剂去铁胺(deferoxamine,DFO)均能减弱肌肽激发的鲁米诺发光强度(P<0.05),见图4。

图3 肌肽对HRP或FeCl3催化的鲁米诺反应的影响
A:HRP;B:FeCl3;1:对照组;2: 20 mmol/L 肌肽;3: 0.1 μg/ml HRP;4: 0.1 μg/ml HRP+20 mmol/L 肌肽;5:300 μmol/L FeCl3;6:300 μmol/L FeCl3+20 mmol/L 肌肽;与对照组比较:*P<0.05,**P<0.01;与2组比较:▲P<0.05;与5组比较:#P<0.05
2.4PMA激活的中性粒细胞中肌肽对氧化作用的影响在中性粒细胞中,浓度小于5 mmol/L的肌肽在30 min内不能刺激中性粒细胞产生过氧化氢,从而激发鲁米诺反应。由图5可知,0、1.25、2.5、5 mmol/L肌肽的化学发光强度均表现为低平曲线。而浓度大于10 mmol/L的肌肽,自15 min起可明显增强中性粒细胞内的鲁米诺反应,化学发光强度增强大于2倍,而且这种增强与肌肽的剂量相关。
3 讨论
虽然大多数研究表明肌肽是一种抗氧化物质,但仍有少部分研究质疑此结论。尤其是在体外实验当中,多个研究[3,7]显示肌肽有促氧化作用。而在体内实验中,肌肽则一直表现出抗氧化的特性[2]。本实验发现肌肽在MTT实验中表现出抗氧化特性,在TMB实验为中性物质,而在鲁米诺反应系统中则表现出促氧化的性质。因此,肌肽的抗氧化性质很可能在不同的反应系统中存在差异。
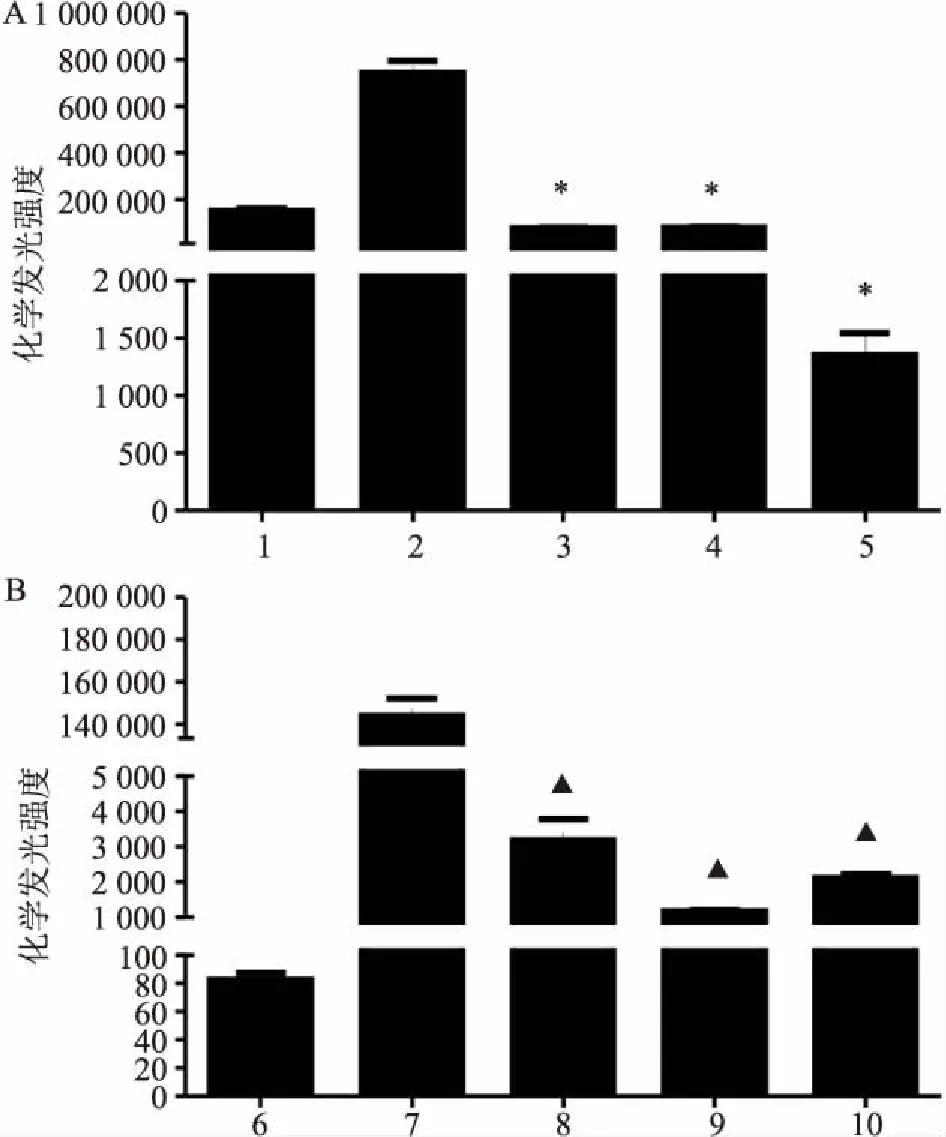
图4 NOD、ZnCl2和DFO对肌肽激发的、HRP和
A:HRP;B:FeCl3;1:0.1 μg/ml HRP;2:0.1 μg/ml HRP+20 mmol/L 肌肽;3:0.1 μg/ml HRP+20 mmol/L肌肽+100 μmol/L NOD;4:0.1 μg/ml HRP+20 mmol/L肌肽+10 mmol/L ZnCl2;5:0.1 μg/ml HRP+20 mmol/L肌肽+1.6 mmol/L DFO;6: 300 μmol/L FeCl3;7:300 μmol/L FeCl3+20 mmol/L肌肽;8:300 μmol/L FeCl3+20 mmol/L肌肽+100 μmol/L NOD;9:300 μmol/L FeCl3+ 20 mmol/L肌肽+10 mmol/L ZnCl2;10:300 μmol/L FeCl3+20 mmol/L肌肽+1.6 mmol/L DFO;与0.1 μg/ml HRP+20 mmol/L 肌肽组比较:*P<0.05;与300 μmol/L FeCl3+20 mmol/L肌肽组比较:▲P<0.05

图5 肌肽对PMA激发的中性粒细胞中氧化反应的化学发光强度的影响
本研究显示肌肽能够拮抗FeCl3对HUVEC的氧化毒性,与相关文献[6]相似。一方面可能由于铁离子可以和肌肽形成螯合物,使其不能进入细胞产生毒性作用;另一方面肌肽能够下调HUVEC中铁离子的转运载体(二价金属离子转运蛋白和转铁蛋白受体),使铁离子转运入细胞的量减少[6]。 另外,Reddy et al[8]发现肌肽的咪唑环可以和ROS或羟自由基中激活的电子形成共价键,形成稳定的中间产物,从而达到拮抗后两者氧化的作用。

Achyuthan et al[3]研究显示肌肽的抗氧化或促氧化作用事实上取决于肌肽的生产商。商业制剂中污染物肼的浓度决定了肌肽的性质[14]。本实验使用的肌肽由Sigma公司生产。与Fluka或Research Organics公司生产的肌肽相比,Sigma公司生产的肌肽抗氧化活性最低。Achyuthan et al[3]研究还表明肌肽的作用受氧化剂的影响。如果化学发光反应的氧化剂由较高浓度的H2O2和较低浓度的铁组成,肌肽表现为抗氧化作用;如果氧化剂由较高浓度的铁组成,肌肽则表现为促氧化作用。本实验的鲁米诺反应使用的铁的浓度为肌肽浓度的3倍以上,这可能也是其表现为促氧化作用的原因。
本研究结果显示肌肽甚至可以促进中性粒细胞的氧化反应。然而,Sharonov et al[15]使用了与本研究相同的实验条件,却得出完全相反的结论:肌肽可以抑制由PMA激发的中性粒细胞的氧化反应。但此二者结论矛盾的具体原因仍不明,有待于进一步研究。
尽管有不同的研究反复论证肌肽的抗氧化或促氧化性质,但到目前为止,还没有研究表明肌肽是中性物质,亦没有研究使用TMB系统测定肌肽的氧化作用。本实验中肌肽在TMB系统中既无抗氧化,也无促氧化作用。这可能是由于肌肽的作用被实验中的终止液H2SO4中和。TMB实验中H2SO4(1 mmol/L)的浓度高于p-香豆酸(0.9 mmol/L),而在这种情况下,肌肽不能形成肌肽-自由基加合物而促进化学发光。迄今,Fenton反应不能在TMB系统中被激活的原因仍未知,有待于进一步研究。
事实上,肌肽被普遍定义为抗氧化剂,但它偶尔表现的促氧化作用一方面可能与溶剂的pH值有关,另一方面与其作用的底物有关。本实验为肌肽在未来的临床应用中提出相关注意事项及用药禁忌。
[1] Boldyrev A A, Aldini G, Derave W. Physiology and pathophysiology of carnosine[J]. Physiol Rev, 2013, 93(4): 1803-45.
[2] Janssen B, Hohenadel D, Brinkkoetter P, et al. Carnosine as a protective factor in diabetic nephropathy: association with a leucine repeat of the carnosinase gene CNDP1[J]. Diabetes, 2005, 54(8): 2320-7.
[3] Achyuthan K E. Enhancement of aminophthalhydrazides chemiluminescence by N-beta-alanyl-L-histidine (L-carnosine)[J]. Luminescence, 1999, 14(2): 75-81.
[4] Shi X, Dalal N, Kasprzak K S. Enhanced generation of hydroxyl radical and sulfur trioxide anion radical from oxidation of sodium sulfite, nickel(II) sulfite, and nickel subsulfide in the presence of nickel(II) complexes[J]. Environ Health Perspect, 1994, 102(Suppl 3): 91-6.
[5] Al Laham F, Kälsch A I, Heinrich L, et al. Inhibition of neutrophil-mediated production of reactive oxygen species (ROS) by endothelial cells is not impaired in anti-neutrophil cytoplasmic autoantibodies (ANCA)-associated vasculitis patients[J]. Clin Exp Immunol, 2011, 161(2): 268-75.
[6] Zhang S, Ntasis E, Kabtni S, et al. Hyperglycemia does not affect iron mediated toxicity of cultured endothelial and renal tubular epithelial cells: influence of L-carnosine[J]. J Diabetes Res, 2016, 2016: 8710432.
[7] Mozdzan M, Szemraj J, Rysz J, et al. Antioxidant properties of carnosine re-evaluated with oxidizing systems involving iron and copper ions[J]. Basic Clin Pharmacol Toxicol, 2005, 96(5): 352-60.
[8] Reddy V P, Garrett M R, Perry G, et al. Carnosine: a versatile antioxidant and antiglycating agent[J]. Sci Aging Knowledge Environ, 2005, 2005(18): pe12.
[9] Chen S, Yan G, Schwartz M A, et al. Penicillin-enhanced chemiluminescence of the luminol-H2O2-Co2+ system[J]. J Pharm Sci, 1991, 80(11): 1017-9.
[10] Li N, Ni S. Amino acids as novel nucleophiles for silver nanoparticle-luminol chemiluminescence[J]. Luminescence, 2014,29(8):1130-4.
[11] Wen C C, Wang C T, Chou W L, et al. Degradation of DMSO in aqueous solutions by the Fenton reaction based advanced oxidation processes[J]. Fresenius Environmental Bulletin, 2012, 21(3): 644-50.
[12] Elias R J, Waterhouse A L. Controlling the fenton reaction in wine[J]. J Agric Food Chem, 2010, 58(3): 1699-707.
[13] Aristova N A, Ivanova I P, Trofimova S V, et al. Influence of luminol on the chemiluminescence intensity in Fenton's reaction[J]. High Energy Chem, 2011, 45(6): 505-9.
[14] Zhou S, Dickinson L C, Yang L, et al. Identification of hydrazine in commercial preparations of carnosine and its influence on carnosine's antioxidative properties[J]. Anal Biochem, 1998, 261(1): 79-86.
[15] Sharonov B P, Govorova N J, Lyzlova S N. Carnosine as a potential scavenger of oxidants generated by stimulated neutrophils[J]. Biochem Int, 1990, 21(1): 61-8.
