融合基因VH-mms13的构建及其蛋白表达鉴定
2015-07-07杨柳青孔登王雪耘王晓红孟丽王小柯
杨柳青,孔登,王雪耘,王晓红,孟丽,王小柯
(潍坊医学院 生物化学与分子生物学教研室,山东 潍坊 261053)
融合基因VH-mms13的构建及其蛋白表达鉴定
杨柳青,孔登,王雪耘,王晓红,孟丽,王小柯Δ
(潍坊医学院 生物化学与分子生物学教研室,山东 潍坊 261053)
目的 构建原核表达载体pET30a(+)-VH-mms13,诱导表达后鉴定融合蛋白表达。方法 分别扩增单克隆抗体基因的重链可变区VH基因和细菌磁小体膜蛋白基因mms13基因,采用重叠延伸PCR技术(splicing by overlap extension,SOE-PCR)构建融合基因VH-linker-mms13,并将融合基因插入pET30a(+)载体,酶切、测序验证;将重组质粒导入大肠杆菌DE3中,0.4 mmol/L异丙基疏代半乳糖苷(Isopropyl β-D-thiogalactoside,IPTG)诱导表达,产物经SDS-PAGE电泳和Western blot双重鉴定。结果 PCR鉴定构建的融合基因VH-mms13大小为738 bp,与理论值相符,测序结果表明序列无误;转入DE3经IPTG诱导,在包含体中检测到融合蛋白表达;Western blot结果显示该表达蛋白可与His-tag抗体特异性结合,蛋白大小符合融合蛋白理论预期。结论 成功构建了融合基因VH-mms13的表达载体pET30a(+)-VH-mms13,且融合蛋白反应原性良好,为生物磁靶向药物的研发奠定了基础。
VH;mms13;重叠延伸PCR;融合蛋白
Ⅳ型胶原酶在肿瘤细胞和血管内皮细胞中高度表达,其能够降解细胞外基质的主要成分Ⅳ型胶原,在肿瘤早期侵袭转移中起重要作用[1]。现阶段关于抗Ⅳ型胶原酶单克隆抗体(McAb 3G11)及其单链抗体(ScFv)的研究较多,发现相关目的基因能在原核表达载体中诱导表达,且目的蛋白能有效抑制肿瘤细胞生长[2-4]。随着生物磁学及靶向药物研究的逐步深入,趋磁性细菌成为研究热点。相对其他纯培养的趋磁细菌而言,趋磁螺菌AMB-1有着氧耐受度高,易培养等优点,且研究发现,在其磁小体众多膜蛋白中,其特有的mms13作为膜表面锚定分子可成功地将绿色荧光蛋白(green fluorescent protein,GFP)稳定展示在磁小体表面,且检测到的GFP强度远远大于其他膜蛋白分子,因此mms13是生物磁靶向的首选锚定基因[5-8]。实验前期,本实验室已成功从趋磁细菌AMB-1中克隆出目的基因mms13,构建了原核表达载体pET30a(+)-ScFv-mms13,并检测发现融合蛋白与Ⅳ型胶原酶有较好的结合活性[9]。现阶段对于Ⅳ型胶原酶单链抗体的重链可变区研究较少,重链可变区形成的单域抗体与单链抗体相比,分子更小,理论上更易透过肿瘤细胞,起到抑制肿瘤细胞迁移的作用,而且在结构上看,通过基因工程改变的单域抗体在体内更稳定,且易被人体排除,对机体的损伤作用小[9-11]。因此,融合基因VH-mms13所表达的蛋白可能更适于生物磁靶向药物的制备。
本研究拟通过融合基因表达技术,将磁小体膜蛋白基因mms13与在肝癌细胞中高度表达的Ⅳ型胶原酶单克隆抗体的重链可变区VH基因相偶联,合成目的基因VH-mms13,构建原核表达载体pET30a(+)-VH-mms13,并经异丙基疏代半乳糖苷(Isopropyl β-D-thiogalactoside,IPTG)诱导表达,采用SDA-PAGE电泳和Western blot对融合表达蛋白进行初步鉴定,为生物磁靶向药物的研究提供物质基础。
1 材料与方法
1.1 材料 大肠杆菌DH5α、Rosetta(DE3)感受态细胞购自生工及康为世纪生物科技有限公司;pET30a(+),pMD18-ScFv-mms13质粒由本实验室保存;pMD18-T Vector购自TaKaRa公司;NdeⅠ核酸内切酶、XhoⅠ核酸内切酶和T4连接酶均购自Thermo公司;PCR所用PCR Master mix购自BIO SCI;His-tag抗体及HRP标记山羊抗小鼠抗体购自康为世纪生物科技有限公司。
PCR引物序列由上海生工生物工程公司合成。基因测序由南京金斯瑞生物公司完成。
主要实验仪器有SW-CJ-1F净化工作台(苏净集团苏州安泰空气技术有限公司);AX224ZH电子天平(奥豪斯仪器上海有限公司);T-Gradient PCR仪(德国Biometra公司);HC-2518R高速冷冻离心机(安徽中科中佳科学仪器有限公司);Gene Genius凝胶成像系统(美国SYNGENE公司);JY92-2D超声破碎仪(宁波新芝生物科技股份有限公司);PHS-3C数显酸度计(上海宇隆仪器有限公司);BS-1E振荡培养箱(常州华普达教学仪器有限公司);JY-SCZ2垂直电泳槽(北京君意东方电泳设备有限公司)。
1.2 方法
1.2.1 融合基因VH-mms13的获得:以pMD18-ScFv-mms13为模版,利用DNAMAN软件设计2对特异性引物。A1上游引物序列:5′-GGAATTCCATATGCAGGTGAAGCTGCAG-3′(横线部分为引入的酶切位点NdeⅠ),A2下游引物序列:5′-GGATCCGCCACCGCCTGAGGAGACGGTGACCGT-3′,用于扩增VH片段。B1上游引物序列:5′-GGCGGTGGCGGATC-CATGCCCTTTCACCTTG-3′,B2下游引物序列:5′-CCGCTCGAGGGCCAGTTCGTCCCG-3′(横线部分为引入的酶切位点XhoⅠ),用于扩增mms13片段。利用引物A1,A2;B1,B2分别扩增VH和mms13片段,产物经PCR产物纯化试剂盒纯化后,用重叠延伸PCR技术(splicing by overlap extension,SOE-PCR)将2个目的基因拼接,获得融合基因VH-mms13。SOE-PCR反应条件:95 ℃变性30 s,53 ℃退火45 s,72 ℃延伸2 min,1个循环后加入引物A1和B2各1 μL,继续进行PCR反应,反应条件同上,进行31个循环,最后延伸10 min。
1.2.2 表达载体pET30a(+)-VH-mms13的构建:将SOE-PCR获得的目的片段按照TaKaRa pMD-18T vector说明书操作,插入到T载体,获得克隆载体pMD18-VH-mms13。以pMD18-VH-mms13为模板,A1、B2为引物,扩增目的基因VH-mms13。将PCR产物和pET30a(+)质粒采用NdeⅠ/XhoⅠ双酶切,回收酶切后的产物,连接后转化至E.coliDH5α。挑取单克隆进行PCR,NdeⅠ/XhoⅠ双酶切鉴定,并测序验证,获得重组表达质粒pET30a(+)-VH-mms13。
1.2.3 诱导表达VH-mms13融合蛋白:将重组质粒pET30a(+)-VH-mms13转化至大肠杆菌Rosetta(DE3)感受态细胞中,涂布于含40 mg/L卡那霉素和50 mg/L氯霉素的LB平板上过夜培养。挑取单菌落至20 mL含40 mg/L卡那霉素和50 mg/L氯霉素的液体LB培养基,37 ℃,150 r/min振荡培养过夜。取5份菌液,按3:100的接种量将菌液转接至20 mL新的液体LB培养基,振荡培养至OD600为0.6左右,向菌液中分别加入IPTG,使终浓度为0.2、0.4、0.6、0.8、1.0 mmol/L,继续振荡培养,分别诱导1、2、3、4、5、6 h后取1 mL菌液离心,回收菌体,提取总蛋白。选择最佳IPTG诱导浓度和最佳诱导时间。
1.2.4 VH-mms13融合蛋白表达鉴定:在1.2.3获得的最佳诱导条件下,对诱导后的菌液经离心、重悬、超声破碎等处理,获得细胞蛋白全细胞组分、上清液组分、细菌周质腔组分、可溶细胞质组分、包涵体组分。将每组蛋白样品经SDS-PAGE电泳,观察目的融合蛋白的表达形式。
1.2.5 Western blot检测融合蛋白表达:将诱导表达的菌体全细胞组分蛋白样品及其包涵体组分蛋白样品各取10 μL,经10%聚丙烯酰胺凝胶电泳分离后,转移至PVDF膜上,用含有5%脱脂奶粉的TBST封闭液室温封闭2 h;TBST洗膜3次,每次10 min,加入一抗His-tag抗体(1:2000稀释),于4 ℃条件下孵育过夜。TBST洗膜3次,每次10 min,后加入HRP标记的山羊抗小鼠IgG(1:2000稀释),于37 ℃条件下孵育1 h。TBST洗膜4次,每次10 min。ECL显影、压片,拍照观察。
2 结果
2.1 融合基因VH-mms13的扩增 目的基因大小应为738 bp。SOE-PCR结果显示获得的融合基因大小与预期值大小相符。见图1。

图1 VH-mms13 PCR产物结果1、2、3:SOE-PCR产物;M:Marker 2000Fig.1 Results of VH-mms13 PCR amplification1,2,3:PCR products;M:Marker 2000
2.2 重组表达载体pET30a(+)-VH-mms13的鉴定 NdeⅠ/XhoⅠ双酶切和PCR扩增结果显示:酶切后的片段在750左右,与PCR产物片段大小相近,见图2。进一步测序结果显示,插入片段大小为738 bp,与融合基因VH-mms13片段序列完全匹配,证明重组质粒构建成功。

图2 PCR产物和双酶切产物电泳结果1:重组质粒NdeI/XhoI酶切产物;2:SOE-PCR产物;M:Marker 2000Fig.2 Results of restrictive enzymes digestion fragments and PCR product1:PCR product; 2:Products digested by NdeI/XhoI; M:Marker 2000
2.3 融合基因最佳诱导表达结果 实验确定IPTG最佳诱导浓度为0.4 mmol/L,37°C条件下最佳诱导时间为6 h。在此条件下的SDS-PAGE凝胶电泳结果显示:诱导菌中有明显异源蛋白表达,而未诱导菌及空载对照菌,在此位置均无相应条带。表达产物分量在25~35ku,与DNAMAN软件计算理论蛋白分子量28 ku相符。见图3。

图3 融合蛋白SDS-PAGE结果1:重组质粒pET30a(+) -VH-mms13转化菌诱导表达;2:重组质粒pET30a(+) -VH-mms13转化菌未诱导表达;3:pET-30a(+)转化菌;M:蛋白Marker Fig.3 SDS-PAGE of fusion protion1:Induced expression of recombinant plasmid; 2:Transformed bacteria without induction; 3:Negative control; M:Protein Marker
2.4 融合蛋白表达定位分析 SDS-PAGE电泳结果显示:融合蛋白主要以包涵体形式存在,可溶细胞质组分中几乎没有。包涵体中蛋白与诱导菌全细胞组分中目的蛋白大小一致,其分子量大小与理论值相符。见图4。

图4 融合蛋白表达结果1:包涵体组分;2:可溶细胞质组分;3:细胞周质腔组分;4:培养液上清组分;5:全细胞组分;M:蛋白MarkerFig.4 Determination of recombinant protein1:Inclusion body composition;2:Volume fraction of cytoplasm;3:Cell cycle mass fraction;4:Culture supernatant fraction;5:Whole cell component;M:Protein Marker
2.5 融合蛋白的Western blot检测 诱导表达的菌体全细胞组分蛋白样品及其包涵体组分蛋白样品经Western blot检测,结果显示,2者在相同的位置,均有特异性结合抗体的条带。表明重组基因VH-mms13表达大小约为28ku的融合蛋白可以与His-tag抗体特异性结合,有相应的反应原性。见图5。
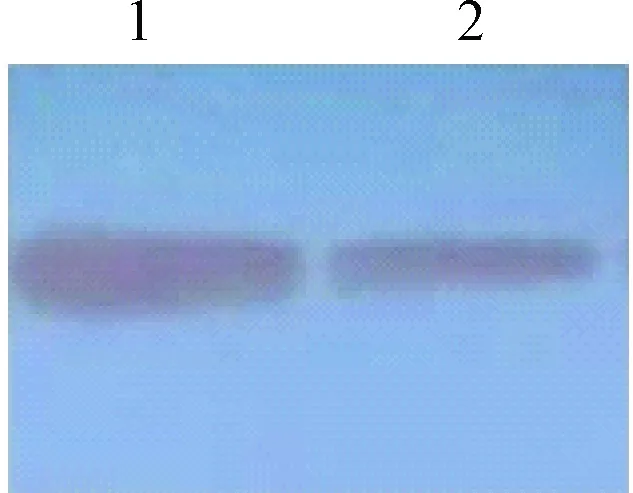
图5 融合蛋白Western blot 检测结果1:包涵体蛋白;2:全细胞蛋白Fig.5 Indentification of fution protein by Western blot1:Inclusion body;2:Whole cell protein
3 讨论
肿瘤严重危害人类健康,传统的治疗方法如手术、放疗、化疗对癌症患者伤害较大。以抗EGFR药物、抗HER-2药物、抗VEGF药物为主的分子靶向药物,相对传统的治疗方法,针对性强,对人体的副作用小,但依旧有着不可忽略的局限性[12]。靶向治疗作为一种新兴的肿瘤治疗手段,它的作用也因人而异[13-14]。此外,免疫细胞存活时间在体内受限,尚需长期的规律治疗。靶向治疗还可能引起人体自身的免疫系统反应,出现低烧等副作用[15]。现在临床上,对于肿瘤的治疗,尚缺乏有效的手段,新型肿瘤药物的研发成为当前的热点[16]。
本实验将AMB-1趋磁细菌磁小体膜蛋白基因mms13与Ⅳ型胶原酶单克隆抗体的重链可变区基因VH,通过重叠延伸PCR技术(SOE-PCR)技术,合成目的基因VH-mms13。其片段大小为738 bp,编码243个氨基酸,所形成的融合蛋白分子量小,更容易在各种系统中表达。由于缺失FC段,VH表达的小分子量蛋白更易与mms13表达的膜蛋白融合。理论上,融合蛋白本身含有VH所形成的单域抗体,穿透性更好,有利于蛋白在组织中的移动,并且可以结合一些普通抗体无法结合的隐蔽表位。以质粒pET30a(+)为载体,构建原核表达载体pET30a(+)-VH-mms13,其转录及翻译机制易调控,操作简单易行。用IPTG在Rossta(DE3)大肠杆菌诱导表达,表达机制明确,短时间内能实现融合基因VH-mms13的高效表达,形成的融合蛋白不易被菌体本身降解,而且蛋白本身带有His-tag标签,便于实验后续过程中蛋白的纯化分离。经SDS-PAGE电泳及Western blot双重检测,原核表达载体pET30a(+)-VH-mms13表达出带有His-tag标签的融合蛋白,为生物磁靶向药物的研究奠定了基础。
[1] Gialeli C,Theocharis AD,Karamanos NK.Roles of matrix metalloproteinases in cancer progression and their pharmacological targeting[J].FEBS J,2011,278(1):16-27.
[2] Wang FQ,ShangBY,ZhenYS.Antitumor effects of the immunoconjugate composed of lidamycin and monoclonal antibody 3G11[J].Europe pubmed central,2003,38(7):515-519.
[3] Dang J,Jing L,Shi W,et al.Expression and purification of active recombinant human bone morphogenetic 7-2 dimer fusion protein[J].ScienceDirect,2015,115(11):61-68.
[4] PanY,Du X,Zhao F,et al.Magnetic nanoparticles for the manipulation of proteins and cells[J].Chem Soc Rev,2012,1039(10):2912-2942.
[5] Arakaki A,Webb J,Matsunaga T.A novel protein tightly bound to bacterial magnetic particles in Magnetospirillummagneticum strain AMB-1[J].J Biol Chem,2002,1074(10):8745-8750.
[6] Toru H,Yoshiaki M,Takayuki Y,et al.Novel designs of single-chain MHC I/peptide complex for the magnetosome display system[J].Protein Eng Des Sel,2015,1903(10):056.
[7] Zhou T,Wu B,Xing D .Bio-modified Fe3O4core/Au shell nanoparticles for targeting and multimodal imaging of cancer cells[J].J Mater Chem,2011,1039(10):470-477.
[8] Yuka K,Masayoshi T,Tsuyoshi T,et al.Effective expression of human proteins on bacterial magnetic particles in an anchor gene deletion mutant of Magnetospirillummagneticum AMB-1[J].ScienceDirect,2012,426(1):7-11.
[9] Kong D,Wang XK,Wang XH,et al.Design,expression and characterization of single chain Fv-Mms13 and the single chain Fv-mms13 fusion protein[J].Mol Med Rep,2015,3892(10):1213-1218.
[10] Yasuhiro S,Tsuyoshi T,Tadashi M,et al.Functional expression of an scFv on bacterial magnetic particles by in vitro docking[J].ScienceDirect,2014,445(1):1-5.
[11] Donga JX,Li ZF,Wang H,et al.Development of a single-chain variable fragment-alkaline phosphatase fusion protein and a sensitive direct competitive chemiluminescent enzyme immunoassay for detection of ractopamine in pork[J].ScienceDirect,736(29):85-91.
[12] 王洪武.肿瘤分子靶向治疗进展(一):分子靶向药物的分类[J].中华医学信息导报,2006(4):14.
[13] 孙燕.肿瘤治疗的新里程碑—靶向药物治疗[J].肿瘤药学,2011(1):1-5.
[14] Santinelli A,Pisa E,Stramazzot D.HER-2 status discrepancy between primary breast cancer and metastatic sites Impact on target therapy[J].Int J Cancer,2008, 122(5):999-1004.
[15] Brannon-Peppas L, Blanchette JO.Nanoparticle and targeted systems for cancer therapy[J].ScienceDirect,Supplement(64):206-212.
[16] Rotman, Maarten W, Mick M van den Boogaarda,etal.Fusion of hIgG1-Fc to 111 In-anti-amyloid single domain antibody fragment VHH-pa2H prolongs blood residential time in APP/PS1 mice but does not increase brain uptake[J].Nucl Med Biol,2015,42(8):695-702.
(编校:吴茜)
Construction of fusion gene VH-mms13 and identification of its protein
YANG Liu-qing, KONG Deng, WANG Xue-yun, WANG Xiao-hong, MENG Li, WANG Xiao-keΔ
(Department of Biochemistry and Molecular Biology, Weifang Medical University, Weifang 261053, China)
ObjectiveTo construct the prokaryotic expression vector pET30a(+)-VH-mms13 and identification of its protein after induced with IPTG.MethodHeavy chain variable region VH gene of typeⅣcollagenase monoclonal antibody and magnetosome membrane protein gene mms13 were amplified separately,the fusion gene VH-linker-mms13 were synthesized by SOE-PCR technique and inserted into pET30a(+)plasmid,which was confirmed by restriction enzyme digest and sequencing.Then the recombinant plasmid pET30a(+)-VH-mms13 was transform intoE.coliDE3 and induced with 0.4 mmol/L IPTG.The fused protein was identified by SDS-PAGE and Western blot.ResultsThe length of fusion gene VH-mms13 was 738 bp,and the sequence was correct.After induced with IPTG,the fused protein was found in the inclusion body and Western blot results suggested that the fused protein can bind with His-tag antibody specifically. ConclusionExpression vector pET30a (+)-VH-mms13 is successfully constructed and the fusion protein has good immunogenicity,which lay the foundation for the development of biomagnetism-targeted drug.
VH; mms13; SOE-PCR; fusion protein
山东省科技攻关计划(2009GG10002079)
杨柳青,男,硕士在读,研究方向:趋磁细菌磁小体形成机制及应用研究,E-mail:815995018@qq.com;王小柯,通信作者,博士,教授,研究方向:趋磁细菌磁小体形成机制及应用研究,E-mail:wangxk@wfmc.edu.cn。
Q78
A
1005-1678(2015)12-0006-04
