端粒酶逆转录酶在胃癌组织中的表达及临床意义
2015-07-05刘丽覃宇周葛莲英
刘丽覃宇周葛莲英
作者单位:530021 南宁 广西医科大学附属肿瘤医院1内镜室,2胃肠外科;3广西医科大学研究生学院
临床研究
端粒酶逆转录酶在胃癌组织中的表达及临床意义
刘丽1,3覃宇周2葛莲英1
作者单位:530021 南宁 广西医科大学附属肿瘤医院1内镜室,2胃肠外科;3广西医科大学研究生学院
目的探讨端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)在胃癌组织中的表达并分析其临床意义。方法以实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)检测胃癌组织中hTERT mRNA的表达,同时用MaxVisionTM即用型快速免疫组化一步法检测胃癌组织中hTERT蛋白的表达,分析hTERT mRNA及其蛋白表达与胃癌临床病理参数之间的关系,并结合随访资料分析其与胃癌患者预后的关系。结果hTERT mRNA在胃癌组织中的表达升高(P<0.05);hTERT蛋白在胃癌组织中的阳性表达率(83.3%)明显高于正常胃组织(40.0%)(P<0.05)。hTERT mRNA和蛋白表达水平呈正相关(r=0.733,P<0.05);hTERT mRNA的表达与淋巴结转移、远处转移及临床分期相关(P<0.05)。胃癌患者hTERT mRNA高表达组与低表达组的生存曲线存在明显差异(P=0.015)。结论hTERT在胃癌组织中的表达升高,且和胃癌进展相关,可作为反映胃癌进展及预后的生物学指标。
胃肿瘤;端粒酶逆转录酶;实时荧光定量PCR;免疫组织化学;表达;预后
胃癌是常见的恶性肿瘤之一,全世界每年大约有951 600例新发病例和723 100例的死亡病例[1]。近年来,越来越多的研究表明端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)在胃癌的发生、发展中起重要作用[2~4]。虽然国内外已有在胃癌组织中检测hTERT mRNA和蛋白表达的研究[5~12],但报道的结果不尽一致。因此,本研究采用实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)技术[13]和Max VisionTM即用型快速免疫组化一步法[14]检测hTERT mRNA和蛋白在胃癌组织中的表达水平,探讨两者在胃癌组织中的表达及其关联性,并分析hTERT mRNA与胃癌临床病理参数及患者预后的关系。
1 材料和方法
1.1 一般资料
收集2007~2010年在广西医科大学附属肿瘤医院行胃癌手术切除标本60例(胃癌组)和30例相对正常胃组织(距离肿瘤>10 cm,正常组)。所有患者术前均未行化疗、放疗或其他治疗,手术切除标本均经病理检查证实。术后病理分级采用美国第七版AJCC胃癌TNM分期指南的标准。所有获取的标本均立即置于液氮中,然后转存于-80℃冰箱中待用。石蜡包埋组织均采用10%福尔马林固定。采用电话或者书信对患者进行随访,随访截止日期为2015年4月30日。本研究经广西医科大学附属肿瘤医院医学伦理委员会批准,且取得患者同意,并签署知情同意书。
1.2 主要试剂和仪器
总的RNA提取试剂为美国Ambion公司提供的TRIzoI Reagent,RNA浓度和纯度的测定使用购自德国的Nanodrop 2000,cDNA逆转录试剂盒和实时荧光定量PCR试剂盒为美国Thermo Scientific公司提供;PCR引物系列 hTERT上游引物为 5′-CTCCCAT-TTCATCAGCAAGTTT-3′,下游引物为5′-CTTGGCTTTC-AGGATGGAGTAG-3′(Invitrogen公司合成);β-actin上游引物为5′-ACCGAGCGCGGCTACAGC-3′,下游引物为5′-CTCATTGCCAATGGTGAT-3′(上海生工合成)。实时荧光定量PCR仪为安捷伦Mx3005P,免疫组化采用迈新的Max VisionTM即用型快速免疫组化一步法试剂盒,hTERT兔抗人单克隆抗体购自美国Abcam公司,DAB试剂盒购自福州迈新技术有限公司。
1.3 实验方法
1.3.1 总RNA提取 所有样本总RNA的提取根据TRIzoI Reagent说明书进行操作。总RNA的浓度和纯度用Nanodrop 2000进行测定。选择A260/A280为1.8~2.1用于下一步试验。
1.3.2 逆转录实验 按照Thermo Scientific RevertAid First Strand cDNA Synthesis Kit的说明书操作方法进行逆转录反应。总RNA取3μg,选择oligo(dT)18引物逆转录得到cDNA。反应条件如下:65℃5 min,冰浴2 min,42℃60 min,70℃5 min。
1.3.3 实时荧光定量PCR 按照Thermo Scientific SYBR Green qPCR Kit的说明书结合预实验进行,PCR反应体系为20μl,包括10μl SYBR-Green qPCR Master Mix,hTERT上下游引物各1μl,2μl逆转录cDNA原液和6μl无酶水。反应条件为95℃7 min,95℃ 10 s,60℃ 30 s,43个循环。每个反应做3次重复实验。每次反应结束均做溶解曲线。β-actin做内参基因。hTERT mRNA的相对表达水平用2-ΔCt计算,-ΔCt=Ctβ-actin-CthTERT。
1.3.4 免疫组化法检测和结果判定 所有组织标本均用10%福尔马林固定,石蜡包埋并连续切片。采用Max VisionTM即用型快速免疫组化一步法,操作步骤按该试剂盒说明书进行。阴性对照采用PBS代替一抗。hTERT蛋白阳性结果判定标准:hTERT蛋白呈棕黄色颗粒定位于细胞质或细胞核中。染色强度及分级标准如下:阳性细胞着色为棕黄色颗粒,以此计算阳性细胞数:≤10%为0分;11%~50%为1分;51%~ 75%为2分;>75%为3分。根据显色程度判定阳性强度:基本不着色为0分;淡黄色为1分;棕黄色为2分;棕褐色为3分。每张切片着色程度得分与阳性细胞百分率得分相乘为最后得分。0~1分为阴性(-);2~3分为弱阳性(+);4~6分为中等阳性(++);6分以上为强阳性(+++)。
1.4 统计学方法
采用SPSS 19.0统计学软件处理实验数据。计量资料的比较采用方差分析,计数资料的比较采用χ2检验或者连续校正χ2检验;等级资料比较采用秩和检验,相关分析采用Spearman秩相关;应用Kaplan-Meier分析绘制生存曲线,并采用log-rank检验比较两组患者生存曲线的差异性。P<0.05为差异有统计学意义。
2 结果
2.1 hTERT mRNA及蛋白的表达情况
hTERT mRNA在胃癌组和正常组中均有表达,但两组hTERT mRNA的表达有明显差异(P<0.001),hTERT mRNA在胃癌组中的表达明显高于正常组(P<0.001)。见图1。
hTERT蛋白在胃癌组和正常组中均有表达,主要表达位于细胞质中。其中正常组hTERT蛋白的表达主要见于胃黏膜腺上皮下2/3层。胃癌组和正常组中hTERT蛋白的阳性表达率分别为83.3%、40.0%,胃癌组中hTERT蛋白的阳性表达率比正常组明显升高,二者差异有统计学意义(P<0.05)。见图2。
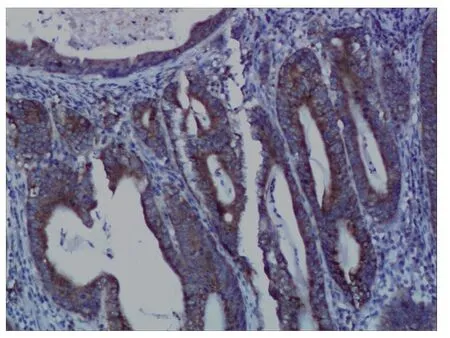
图2 hTERT蛋白在胃癌组织中的阳性表达
运用Spearman秩相关分析hTERT mRNA和蛋白表达水平的关系,结果显示hTERT mRNA和蛋白表达水平呈正相关(r=0.733,P<0.05)。
2.2 hTERT mRNA的表达与胃癌临床病理参数之间的关系
在胃癌组中以hTERT mRNA表达的平均数为截点,分为hTERT mRNA高表达者和hTERT mRNA低表达者。在有淋巴结转移组中hTERT mRNA高表达者所占比例比无淋巴结转移组高(70.2%vs 23.1%,P=0.002);在远处转移组中hTERT mRNA高表达者所占比例比无远处转移者高(100%vs 51.9%,P=0.029);在Ⅲ期+Ⅳ期患者中hTERT mRNA高表达者所占比例比Ⅰ期+Ⅱ期患者高(71.1%vs 36.4%,P=0.009)。hTERT mRNA的表达与患者年龄、性别、肿瘤大小、肿瘤部位、分化程度及浸润深度无关(P>0.05)。见表1。
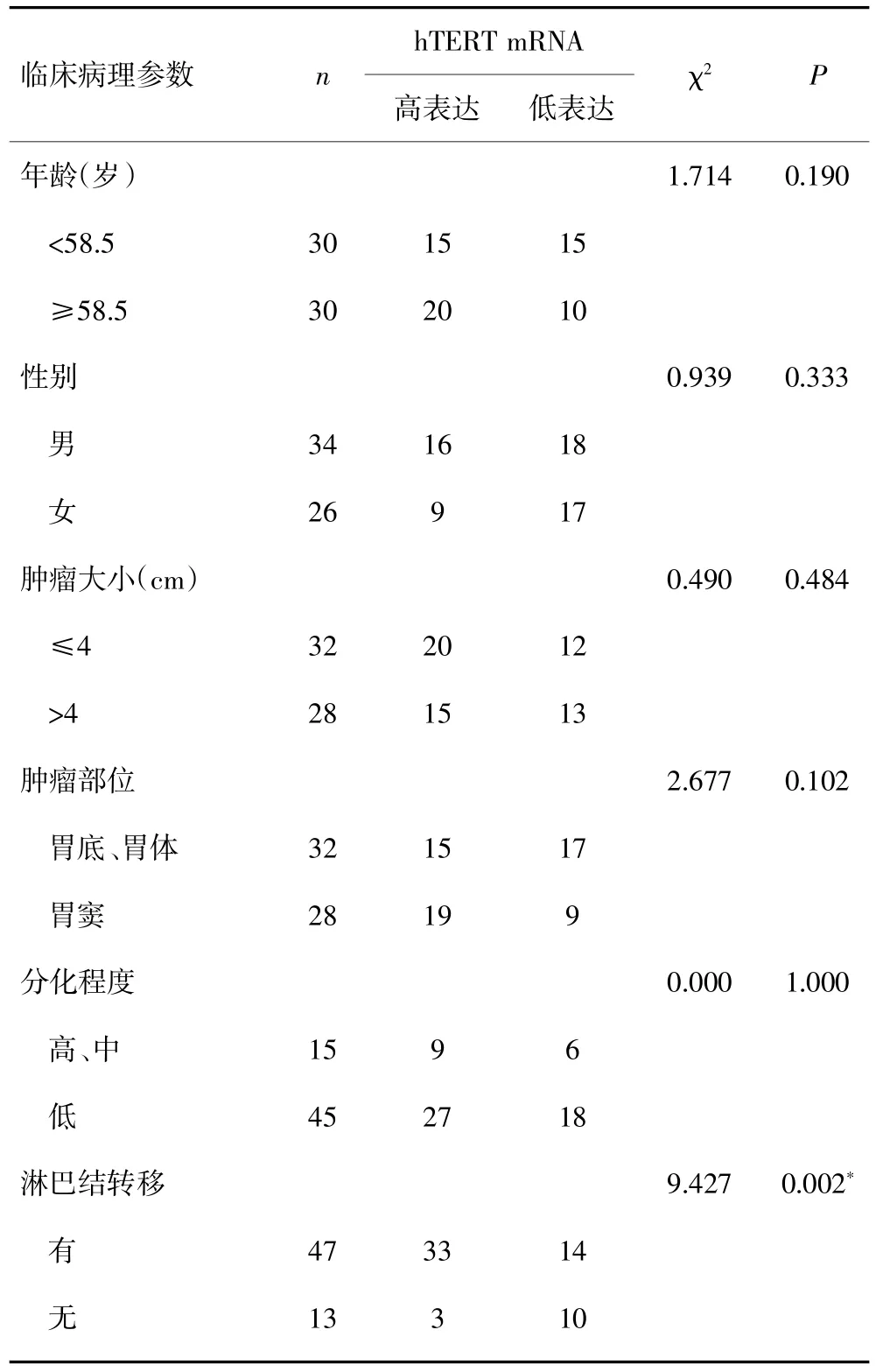
表1 hTERT mRNA的表达与胃癌临床病理参数之间的关系
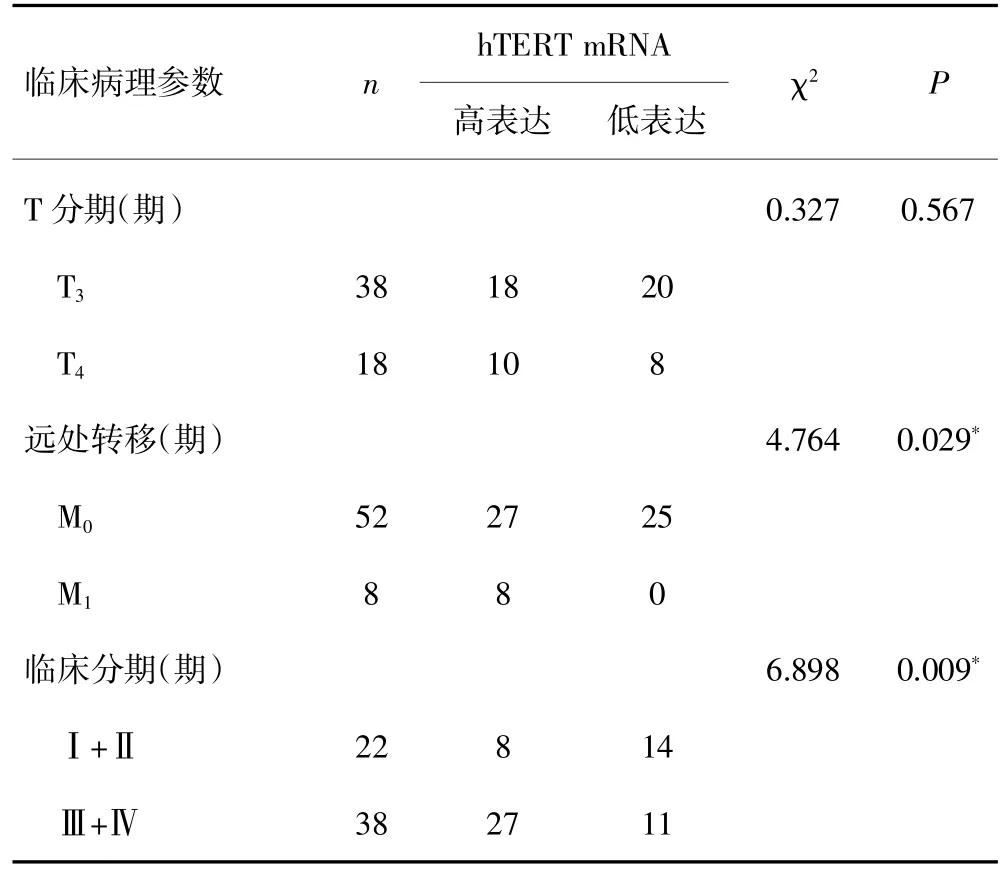
(续表)
2.3 hTERT mRNA的表达与患者生存预后的关系
以hTERTmRNA在胃癌组中表达的平均数为截点,分为hTERT mRNA高表达组、hTERT mRNA低表达组进行统计分析并绘制生存曲线,通过log-rank检验显示胃癌患者hTERTmRNA高表达组与hTERTmRNA低表达组的生存曲线具有明显差异(P=0.015),其中hTERT mRNA在高表达组患者的中位生存时间为24个月,hTERT mRNA低表达组的中位生存时间为64个月,表明hTERT mRNA的高表达能够影响胃癌患者预后。见图3。
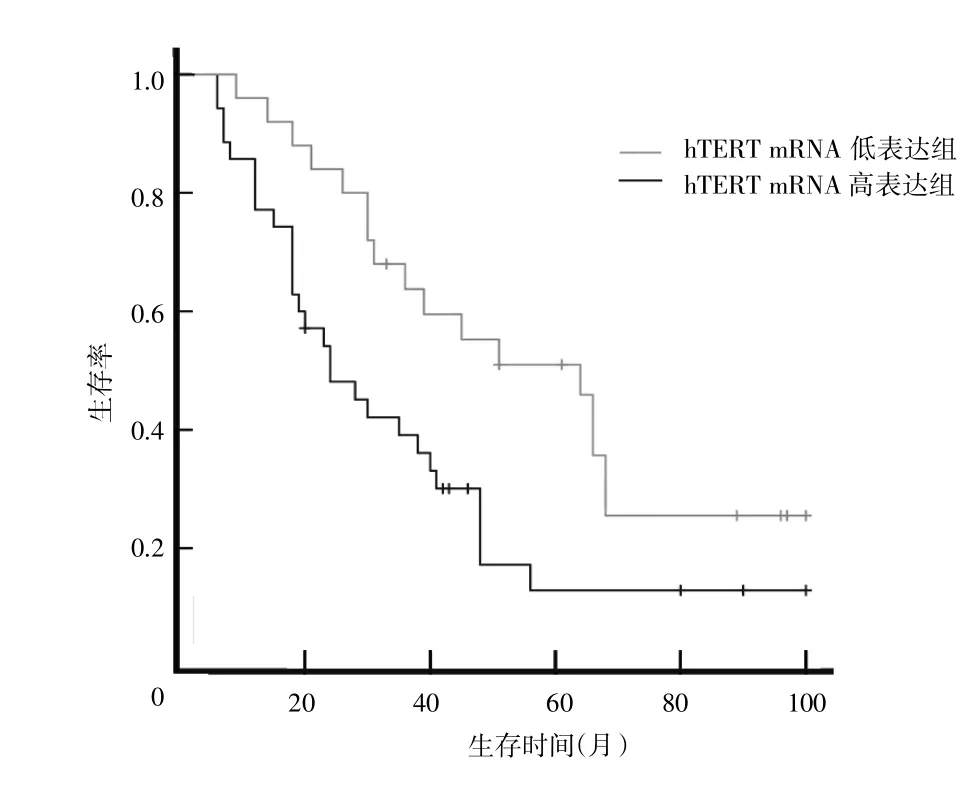
图3 hTERT mRNA高表达组与hTERT mRNA低表达组患者生存曲线的比较
3 讨论
胃癌的发病是一个多因素、多步骤、多基因参与的复杂过程。其中端粒酶参与胃癌的发生[15],它可使细胞发展成为永生化细胞或具有无限增殖能力的癌细胞,在恶性肿瘤的发生、发展过程中起重要作用[16]。hTERT是端粒酶催化亚单位,其表达与端粒酶活性相平行,是端粒酶活性的决定因素[17]。为此,本实验用qRT-PCR和Max VisionTM即用型快速免疫组化一步法检测hTERT在胃癌组织中的表达水平,探讨hTERT与胃癌发展、预后的关系。
本研究显示hTERT mRNA在正常胃组织及胃癌组织中的表达逐渐升高(P<0.001),表明hTERT参与胃癌的发生、发展。Max VisionTM法检测显示hTERT蛋白主要表达在细胞质,其中,hTERT蛋白在正常胃组织中的表达主要集中在胃黏膜腺体下2/3层的腺体细胞质中。其原因可能是胃黏膜更新速度较快,上皮干细胞中存在hTERT的活化[9]。本研究中hTERT蛋白在正常胃组织的阳性表达率(40.0%)与国外报道大致相同[9~11],而国内万顺梅等[7]的研究中hTERT蛋白在25例正常胃组织中阳性表达率为0。张赟等[6]的研究中hTERT蛋白在10例正常胃组织中的阳性表达率为10.0%。这些报道与本研究结果差异较大,其原因可能是其纳入的正常胃组织样本较少,或是本研究采用了更加灵敏的Max VisionTM法[14]检测hTERT蛋白的表达。本研究经Spearman秩相关分析提示hTERT mRNA与蛋白的表达水平呈正相关(r=0.733,P<0.05),说明hTERT基因在mRNA和蛋白的水平表达一致。张赟等[6]研究也表明hTERT mRNA和蛋白的表达呈正相关(r=0.565),与笔者的结果一致。临床病理因素分析显示hTERT mRNA与淋巴结转移、远处转移及临床分期有关,与Lu等[18]和胡海雷[19]的实验结果基本相同;但研究显示 hTERT mRNA与肿瘤浸润深度有关,与笔者的结果不一致,分析可能是本研究未纳入T1期、T2期样本,未统计比较T1期+T2期与T3期+T4期两组患者的差异,仅比较T3期与T4期患者hTERT mRNA的表达水平,结果提示T3期与T4期患者hTERT mRNA的表达水平无差异。生存分析提示hTERT mRNA高表达组患者的术后中位生存时间比低表达组更短(P=0.015),说明hTERTmRNA高表达和患者预后不良有关。门树成等[20]的研究表明hTERT mRNA高表达组患者的5年生存率(17.4%)比hTERT mRNA低表达组(60.0%)低(P=0.002),与胃癌不良预后相关。
最近研究[21]表明,hTERT能够促进胃癌细胞的侵袭是通过提高对FOXO3a的泛素化和上调ITGB1,hTERT/MDM2-FOXO3a-ITGB1信号通路在hTERT诱导的胃癌细胞入侵方面发挥重要作用。Liu等[2]研究显示在胃癌细胞系中hTERT可以促进上皮向间皮转化和诱导多能癌细胞,进而促进胃癌细胞的远处转移和复发,可见hTERT在胃癌发展过程中起重要作用。
综上,hTERT在胃癌组织中的表达升高,且和胃癌进展、预后相关。因此,hTERT可作为反映胃癌进展及预后的生物学指标,但在临床治疗应用方面还需深入研究。
[1] Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2] Liu Z,Li Q,Li K,et al.Telomerase reverse transcriptase promotes epithelial-mesenchymal transition and stem cell-like traits in cancer cells[J].Oncogene,2013,32(36):4203-4213.
[3] Duarte MC,Babeto E,Leite KR,et al.Expression of TERT in pre-cancerous gastric lesions compared to gastric cancer[J].Braz J Med Biol Res,2011,44(2):100-104.
[4] 胡福军,李沛,董子明,等.胃癌组织中hTERT mRNA表达的定量研究[J].浙江实用医学,2009,14(3):177-178,187.
[5] 吴继锋,邵晋晨,王道斌,等.胃癌组织端粒酶逆转录酶基因的表达及意义[J].中国肿瘤临床,2004,31(5):281-291.
[6] 张赟,伍冬梅,李春鸣.端粒酶逆转录酶蛋白及mRNA在胃癌中的表达及相关性研究[J].贵州医药,2011,35(3):211-214.
[7] 万顺梅,房殿春,葛勤利,等.人端粒酶逆转录酶在胃癌组织中的表达及其临床病理意义[J].西北国防医学杂志,2010,31(6):413-415.
[8] 魏青林,张丹,杨仕明.端粒酶逆转录酶和Gli1、Gli2在胃癌中的表达及意义[J].第三军医大学学报,2015,37(9):902-906.
[9] Yasui W,Tahara E,Tahara H,et al.Immunohistochemical detection of human telomerase reverse transcriptase in normal mucosa and precancerous lesions of thestomach[J].JpnJ Cancer Res,1999,90(6):589-595.
[10]Li W,Li L,Liu Z,et al.Expression of the full-length telomerase re-verse transcriptase(hTERT)transcript in both malignant and normal gastric tissues[J].Cancer Lett,2008,260(1-2):28-36.
[11]Cheng YB,Guo LP,Yao P,et al.Telomerase and hTERT:can they serve as markers for gastric cancer diagnosis?[J].World J Gastroen-terol,2014,20(21):6615-6619.
[12]王晓燕,陈萍,吴莺,等.端粒酶和端粒酶逆转录酶在胃癌组织中的表达及临床意义[J].临床荟萃,2010,25(4):299-301.
[13] Provenzano M,Mocellin S.Complementary techniques:validation of gene expression data by quantitative real time PCR[J].Adv Exp Med Biol,2007,593:66-73.
[14] 林秋兰,赵丽华,林竞,等.Max VisionTM即用型快速免疫组化一步法染色的病理应用[J].诊断病理学杂志,2008,15(4):344.
[15]Gumus-Akay G,Unal AE,Bayar S,et al.Telomerase activity could be used as a marker for neoplastic transformation in gastric adenocar-cinoma:but it does not have a prognostic significance[J].Genet Mol Res,2007,6(1):41-49.
[16] Kim NW,Piatyszek MA,Prowse KR,et al.Specific association of human telomerase activity with immortal cells and cancer[J].Sci-ence,1994,266(5193):2011-2015.
[17]Autexier C,Lue NF.The structure and function of telomerase reverse transcriptase[J].Annu Rev Biochem,2006,75:493-517.
[18]Lu MH,Deng JQ,Cao YL,et al.Prognostic role of telomerase activity in gastric adenocarcinoma:A meta-analysis[J].Exp Ther Med,2012,3(4):728-734.
[19]胡海雷.实时荧光定量RT-PCR检测胃癌患者外周血hTERTmRNA表达水平[J].放射免疫学杂志,2011,24(2):182-185.
[20]门树成,黄宝俊.hTERT mRNA在胃癌中表达及其与预后的关系[J].中国当代医药,2013,20(35):4-6.
[21]Hu C,Ni Z,Li BS,et al.hTERT promotes the invasion of gastric can-cer cells by enhancing FOXO3a ubiquitination and subsequent IT-GB1 upregulation[J].Gut,2015.[Epub ahead of print].
[2015-06-09收稿][2015-10-25修回][编辑 阮萃才]
Expression and clinical significance of hTERT in gastric cancer
Liu Li1,3,Qin Yuzhou2,Ge Lianying1(1Department of Endoscopy,Affiliated Tumor Hospital of Guangxi Medical University;2Department of Gastrointestinal Surgery,Affiliated Tumor Hospital of Guangxi Medical University;3Graduate School of Guangxi Medical University,Nanning 530021,P.R.China)
Ge Lianying.E-mail:gelianying2015@163.com
ObjectiveTo investigate the expression and clinical significance of human telomerase reverse transcriptase(hTERT)in gastric cancer tissues.MethodsQuantitative real-time PCR was used to measure levels of hTERT mRNA in gastric tissues,while MaxVisionTMimmunohistochemistry was used to detect expression of hTERT protein in gastric tissue sections.Possible correlations of hTERT mRNA and protein levels with clinicopathological characteristics and with patient survival were explored.ResultsThe mRNA encoding hTERT was overexpressed in gastric caner tissues and adjacent tumor tissues(P<0.05),while the rate of hTERT protein-positive staining was significantly higher in gastric cancer tissues(83.3%)than in normal tissues(40.0%,P<0.05).Levels of hTERT mRNA correlated positively with protein levels(r=0.733,P<0.05).Up-regulation of hTERT was significantly associated with lymph node metastases,distant metastases and TNM stage(P<0.05).Kaplan-Meier survival analysis showed significantly higher survival rates for patients expressing low levels of hTERT than for those expressing high levels(P=0.015).Conclusions These results suggest that hTERT is overexpressed in gastric cancer tissues,and that such overexpression is associated with gastric cancer progression.Assaying hTERT levels may provide an indicator of disease progression and prognosis.
Gastric neoplasm;Human telomerase reverse transcriptase;Quantitative real-time PCR;Immunohistochemistry;Expression;Prognosis
R735.2
A
1674-5671(2015)06-05
10.3969/j.issn.1674-5671.2015.06.03
广西教育厅科研基金资助项目(201012MSO38)
葛莲英。E-mail:gelianying2015@163.com
