松辽盆地湖相烃源岩中生物标志物的单体烃碳同位素组成特征及其意义
2015-07-02曹新星宋之光
王 丽, 曹新星, 李 艳, 尹 琴, 宋之光
(1. 中国科学院 广州地球化学研究所 有机地球化学国家重点实验室, 广东 广州 510640; 2. 中国科学院大学, 北京 100049;3. 中国石油化工股份有限公司 河南油田分公司 勘探开发研究院, 河南 郑州 450018)
0 引 言
松辽盆地为世界上最大的白垩纪非海相含油盆地之一, 发育了高质量的烃源岩, 储存有丰富的油气资源, 保存着完好的古代生物群落沉积序列, 是研究白垩纪油气资源形成时期古气候、古环境状态的理想场所。前人对松辽盆地烃源岩的形成时期的沉积环境以及有机质来源已进行了广泛研究[1–2]。例如: 晚白垩世时期的海侵[3–4]、缺氧事件[5–7]、水体盐度分层[8–9]以及孢粉、藻类等生物化石所反映的古气候意义和有机质来源等[10–11], 而对于沉积环境与有机质生源之间的关系却了解较少, 如不同沉积环境下(水体分层、氧化还原状态)对水体生物的演化及其生物地球化学行为的影响等。
基于以上考虑, 我们选取了松科一井南孔水体环境不同的嫩一段、嫩二段岩芯样品[9,12], 利用生标参数、有机质碳同位素和分子碳同位素等数据进行综合讨论, 重点研究不同沉积环境下有机质输入的异同,目的在于解开有机碳同位素、氧化还原界面(化跃层)与微生物之间的相关关系[13], 继而重建嫩江组沉积时期的生物地球化学过程, 这有助于我们更细致地描述古水体环境和古湖泊生态分布的空间异构型[14], 为完善松辽盆地大规模烃源岩沉积模型提供依据。
1 样品地质背景和实验分析
松辽盆地位于中国的东北部, 是以晚古生代末至早中生代初所固结的大陆地壳为基底的陆相坳陷盆地。松辽古湖泊在发育过程中, 有过多次扩张和收缩, 比较大的湖侵至少有 5次, 在每次湖侵期都形成大面积分布的暗色泥岩或者油页岩。在经历姚家组时期短暂的间歇性上升之后, 松辽古湖泊又一次发生更大规模的快速湖侵, 湖水覆盖面积超出 20万km2, 形成了在盆地内广泛发育的嫩江组一、二段的滨浅湖、半深湖-深湖相沉积体系[15]。本文样品采自松辽盆地“松科1井”白垩纪嫩江组岩心样品(图1),埋深950~1300 m, 对其中41个烃源岩样品进行抽提分析, 并选取其中一些样品进行了有机碳同位素分析和分子碳同位素测定, 所涉及到的实验方法见下文。
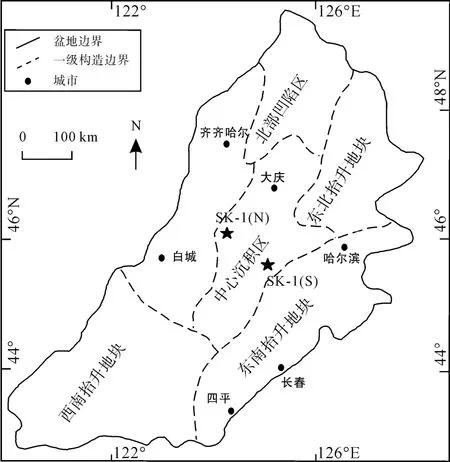
图1 松科1井采样位置图Fig.1 Location map of the SK-1 drilling well in the Songliao Basin
样品碎成粉末后, 使用二氯甲烷/甲醇(体积比为 9∶1)混合溶剂进行索氏抽提, 脱沥青后用色谱层析柱分离得到饱和烃、芳烃和非烃组分。饱和烃经过尿素络合后, 得到正构烷烃和异构烷烃, 然后使用同位素质谱仪对正构烷烃和异构烷烃进行单体碳、氢同位素测定。
(1) 气相色谱质谱联用仪(GC-MS)分析使用 HP 6890 PLatformⅡ质谱仪, 色谱柱为JW-DB-5型30 m ×0.25 mm × 0.25 μm硅熔毛细柱。升温程序: 色谱柱箱初始温度为80 ℃, 恒温2 min后以4 ℃/min的速率升至290 ℃, 并恒温20 min。样品采用无分流进样法, 进样室温度为 280 ℃, 氦气为载气, 流速为1.0 mL/min, 扫描范围为 50~600 amu, 检测方式为全扫, 离子源为电子轰击源(70 eV)。
(2) 热裂解分析仪为Leco公司生产的Rock-Eval 6 Standard型。热解炉升温程序: 初始温度 300 ℃,恒温1 min后以25 ℃/min的速率升温到650 ℃, 并恒温3 min; 氧化炉升温程序: 初始温度300 ℃, 恒温1 min后以20 ℃/min的速率升温到850 ℃, 并恒温5 min。
(3) 有机碳碳同位素分析。将去除碳酸盐岩的粉末样品用锡箔舟包好。使用与Finnigan DELTAplus XL质谱仪接口的CE EA1112元素分析仪进行全岩碳同位素分析。所有样品均测量 2次, 并穿插标样的测定, 一般7个样品以后进行一次标样测定。
(4) 单体碳同位素分析。GC-ir-MS使用英国GV公司的 Isoprime色谱-同位素质谱仪, 色谱柱与 GC分析一致, 仍为JW-DB-5型30 m × 0.25 mm × 0.25 μm硅熔毛细柱。无分流进样, 进样室温度为280 ℃, 氦气为载气。升温程序: 色谱柱箱初始温度为 80 ℃,恒温2 min后以20 ℃/min的速率升温至130 ℃, 然后以3 ℃/min的速率升温至290 ℃, 并恒温10 min。所用标准物质为Indiana STD, 每天至少做1次标样。每个样品分析2~3次, 其同位素测定误差为±0.5‰。
2 结果和讨论
2.1 基础地球化学参数
嫩一段和嫩二段样品tmax值多数在436 ℃左右,Ts/Tm比值在0.2左右, C31藿烷22S/(22S+22R)比值小于 0.5, 这些参数表明样品的成熟度较低, 处于未成熟至低成熟阶段, 它们在剖面上较小的变化幅度,说明各样品之间的成熟度相近。换句话说, 嫩江组源岩的生标参数和碳同位素组成在剖面上的变化基本不受成熟度的影响。
基础地球化学参数在剖面上的变化存在明显分段性(表 1和图 2), 根据有机碳含量(TOC)、氢指数(HI)和姥植比值(Pr/Ph)在剖面上的变化将嫩江组分为以下四个部分[8]。
Ⅰ段为嫩一段底部1116~1125 m, 是TOC和HI的高值段, Pr/Ph比值变化较大。正构烷烃碳同位素值在–34.57‰~ –30.7‰之间变化(图 3), 姥鲛烷和植烷碳同位素组成接近, 在–31.5‰左右, 甾烷类单体碳同位素组成变化较大, 在–32.53‰~ –27.92‰之间变化, 藿烷类单体碳同位素组成在–40.56‰~–25.87‰之间变化。
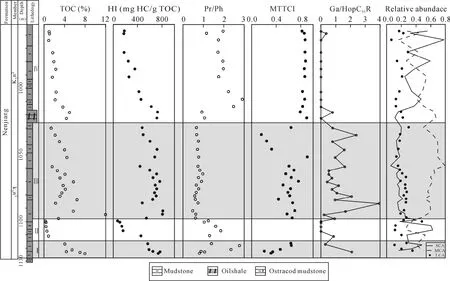
图2 TOC、HI、Pr/Ph、MTTCI、Ga/HopC31R以及SCA、MCA、LCA相对丰度在剖面上的变化Fig.2 The profile variation of TOC, HI, Pr/Ph, MTTCI, gammacerane index and relative abundance of SCA, MCA and LCA
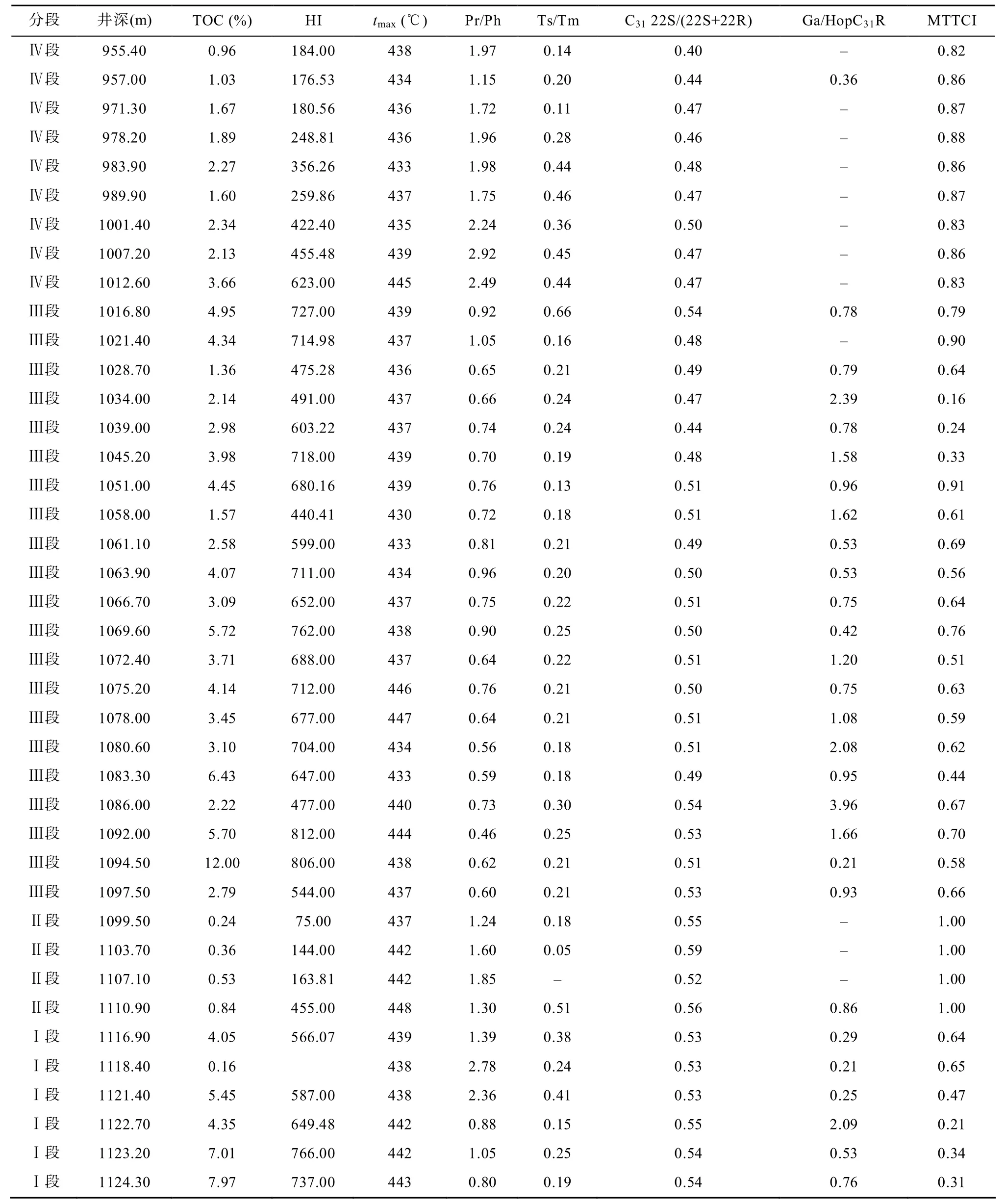
表1 TOC、热解参数以及生标参数Table1 The data of TOC, Rock-Eval analysis and biomarker parameters
Ⅱ段是嫩一段底部 1099~1116 m, TOC含量相对较低, Pr/Ph比值相对较高。正构烷烃碳同位素处于–33.98‰~ –29.18‰之间, 单个样品不同碳数正构烷烃之间的变化达到 4‰。但由于该段生物标志物含量较低, 未能检测其单体碳同位素值。
Ⅲ段则从1016~1099 m, 该段是TOC、HI的高值段, Pr/Ph比值较低且变化幅度小。正构烷烃碳同位素在–34.84‰~ –29.34‰之间变化, 姥鲛烷和植烷碳同位素组成接近, 姥鲛烷的平均值为–32.36‰,植烷的平均值为–32.06‰。5α-C27甾烷和 5α-C29甾烷碳同位素组成相似, 5α-C28甾烷碳同位素略低1‰左右, 平均值为–32.29‰; 图4显示甲基甾烷碳同位素组成随碳数增加呈现变重趋势, 4α-C28甲基甾烷和4α-C29甲基甾烷的碳同位素组成多数在–35‰~–30‰之间, 4α-C30甲基甾烷的碳同位素组成多在–30‰~ –20‰之间, 明显高于前两者。藿烷类化合物除伽马蜡烷具有较重的同位素外, 其他藿烷类化合物碳同位素组成变化范围较大, 多在–70‰~ –30‰之间。
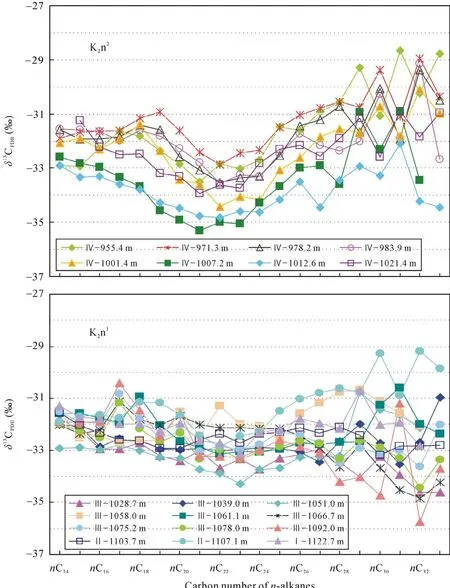
图3 嫩一段和嫩二段不同碳数正构烷烃的碳同位素组成分布图Fig.3 Carbon isotopic composition of individual n-alkanes in K2n1and K2n2
Ⅳ段为嫩二段950~1016 m, 该段为TOC和HI的低值段, 从下到上逐渐降低; Pr/Ph比值在该段则呈现明显的高值段。正构烷烃碳同位素在–35.32‰~–28.67‰之间变化, 该段单个样品内和样品之间的碳同位素组成变化均较大, 达到了7‰。5α-C27–29甾烷和 C28–29甲基甾烷的碳同位素组成较为接近, 多在–32‰左右, 而 C30甲基甾烷的碳同位素则明显偏高, 在–29‰~ –25‰之间。藿烷类碳同位素组成多在–45‰~ –32‰之间变化。从图4可以看出, Ⅳ段生标单烃同位素的变化幅度明显低于Ⅰ段和Ⅲ段, 尤其是藿烷类碳同位素组成的变化范围明显较小, 且其碳同位素组成在Ⅳ段也明显偏重。
由于Ⅱ段样品生标浓度过低未能做单体碳同位素分析, 而 I段也仅有两个样品有单体碳同位素数据, 因此下文中涉及生标单体碳同位素的讨论部分使用嫩一段来替代Ⅰ段和Ⅲ段, 而嫩二段代表Ⅳ段。
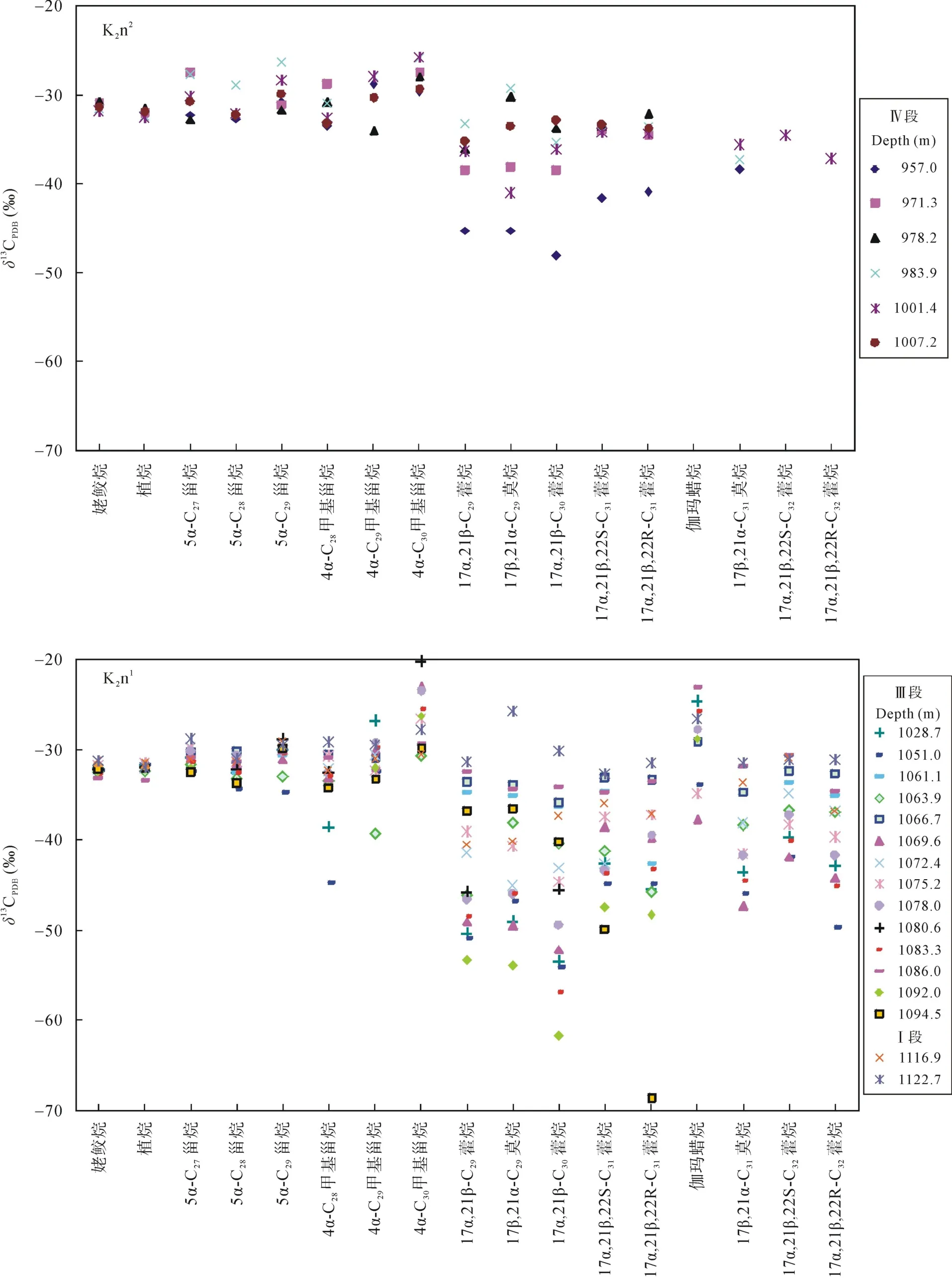
图4 各生标的碳同位素组成分布图Fig.4 Carbon isotopic composition of individual biomarkers
2.2 母质来源
2.2.1 正构烷烃
湖相沉积物中正构烷烃的来源较为广泛, 包括陆相高等植物、水生植物(挺水植物、浮游植物和沉水植物等)和低等菌藻类。通常认为短链正构烷烃(SCA)来源于低等菌藻类; 水生植物来源的正构烷烃主要集中以nC23和nC25为主峰的中链部分(MCA)[16–17]; 而长链部分(LCA)则以陆生高等植物来源为主。图2显示在Ⅰ、Ⅲ段以 MCA占主要优势, 表明了该段有机质主要以水生生物为主; 而在Ⅱ、Ⅳ段SCA呈绝对优势, Ⅳ段LCA相对丰度增加,奇偶优势明显, 认为Ⅳ段有高等植物的贡献或Botryococcaceae的输入, 但总体上还是以光合蓝细菌等低等菌藻类为主, 这与前人的研究结果一致[12]。另外, Fickenet al.通过对大量现代湖泊表层沉积物和现代植物的研究发现:Paq= (C23+ C25)/(C23+ C25+C29+ C31)可以指示湖相沉积中沉水/浮游水生植物与挺水植物/陆生植物的相对输入[16], 当Paq< 0.1时代表陆生植物输入为主;Paq在 0.1~0.4之间时以挺水植物为主;Paq在0.4~1时指示了沉水/浮游水生植物输入为主。嫩江组整个剖面的Paq指数在0.46~0.89之间变化, 其中嫩二段的平均值为 0.61, 嫩一段的平均值为 0.76, 表明嫩一段的有机质来源均以沉水/浮游水生生物输入为主, 但嫩二段的值明显低于嫩一段, 说明在嫩二段显示有少量陆源/挺水植物的贡献[8, 12]。
嫩江组有机质正构烷烃的碳同位素组成在–35.7‰~ –28.7‰之间变化(图 3), 变化幅度较大, 显示了各链长正构烷烃具有不同的母质生源。SCA的平均碳同位素值与姥鲛烷的碳同位素值相近, 均在–32‰左右, 这符合两者来自于相同生物体的碳同位素分布特征[18–19], 表明SCA来自于代表水体表层初级生产力的低等菌藻类, 如光合蓝细菌等。图 3显示嫩一段和嫩二段的13CMCA比相邻碳数的碳同位素组成明显偏轻, 其总体偏轻3‰左右, 最大差值可达5‰~6‰。在现代水体环境下, 如果初级生产者利用有机质降解产生的 CO2作为部分碳源, 由于水体和沉积物中的有机质本身富集12C, 会导致初级生产者合成的有机质异常富集12C[20–21]。因此,δ13CMCA比δ13CSCA相对富集12C, 可能是由于其母源生活在水体透光带下部, 相较于水体表层的初级生产者,它可以同时利用大气溶解的CO2和底层水体中有机质降解产生的 CO2进行光合作用, 从而导致了其有机质偏轻[22]。且水体下部接近化跃层的这一生态位有利于有机质的保存, 因而在其死亡后能迅速埋藏,减少氧化或细菌对其氧化降解, 这也许是饱和烃分布图上 MCA具有明显优势的原因之一。而在nC27之后 LCA碳同位素呈锯齿型分布[8], 有的以奇碳数偏重, 有的则以偶碳数偏重, 推测其受环境、母质来源和微生物降解等多重因素的影响, 具体的原因还需进一步的研究证实。
值得注意的是, 中链正构烷烃的碳同位素组成在嫩二段下部氧化环境下比嫩一段还原环境下更为偏轻, 推测其可能是由于嫩二段时期的水体分层刚被破坏, 有氧层下移, 使得需氧生物的生存空间扩大, 更多地利用了下部水体有机质降解产生的同位素值较轻的碳源,导致有机质碳同位素偏轻。
2.2.2 无环类异戊二烯
姥鲛烷和植烷均来自于光合藻类和蓝细菌产生的叶绿素植基侧链, 是水体中以光合作用为主的初级生产者的代表。此外, 姥鲛烷也可以来自维生素E[23–24], 植烷也可由产甲烷菌和嗜盐菌生成。因此,植烷的碳同位素组成可以验证有机质中是否存在产甲烷菌和嗜盐菌。嫩一段和嫩二段源岩中的姥鲛烷、植烷碳同位素组成均在–32‰左右, 表明其生物来源存在一致性。另外, 姥鲛烷相对于总有机质碳同位素(平均为–28.4‰)偏轻约 4‰~6‰, 符合类脂物与生物体总有机质之间的碳同位素分布关系[18–19]。因此, 本次研究的样品中姥鲛烷和植烷主要来自光合作用初级生产者或以初级生产者为生的异养生物[25]。
2.2.3 甾烷类
前人的研究结果表明: 在古老沉积物、烃源岩和原油中, 当甾类化合物与姥鲛烷和植烷均来自于初级生产者(例如藻类, 光合细菌等)的情况下, 甾类化合物的碳同位素值总是非常接近姥鲛烷和植烷的碳同位素值, 两者之间的差距很小, 并往往表现为姥鲛烷和植烷更加富集12C[26–27]。姥鲛烷和植烷相对于甾烷碳同位素值的偏轻可能与它们生物来源更加多样化有关, 例如蓝细菌等可能产生碳同位素值偏轻的姥鲛烷和植烷[26,28]。
在饱和烃组分中C27和C29甾烷具有相似的同位素值(图 4), 表明二者具有相似的藻类母源; 而在C28甾烷比 C27甾烷和 C29甾烷明显偏负, 尤其是在嫩二段偏负达到 2‰左右。由于藻类需要生活在氧含量较高的水体中, 所以产 C28甾烷的藻类必定生活在透光的含氧水体中, 而其较轻的δ13C值则显示其生活在细菌活动剧烈的水体中[29], 如化学自养菌的更上层水体, 这与前人认为产 C28甾烷可能生活于水体透光区域底层的结论是一致的[29]。而产 C27甾烷和 C29甾烷的藻类其碳同位素值明显偏重, 表明它们生活在水体透光区域的上层, 主要利用大气CO2作为碳源, 但是有机质降解产生的 CO2作为上述藻类的部分碳源的可能性依然存在。而中链正构烷烃与 C28甾烷具有相似的碳同位素值, 甚至更贫13C, 暗示了该母源藻类的生存环境与 C28甾烷相近或处于更低的水体透光的水域。
在分析样品中还检测出了一系列的 C28~C304-甲基甾烷, 高丰度的 4–甲基甾烷通常被认为来自活体甲藻体内的4α–甲基甾醇, 前人研究认为在淡水、微咸水和高盐湖相沉积环境中甲藻种类的不同导致了 4-甲基甾烷组成的差异, 且甲藻主要繁盛于淡水沉积环境中[23]。本样品中以C304-甲基甾烷含量最为丰富, C284-甲基甾烷含量次之。其同位素组成显示三者均来自于初级生产者的藻类, 其中 C284–甲基甾烷和 C294-甲基甾烷的碳同位素值在–31‰左右, 表明它们来自于上部透光带的藻类, 而其在1063~1051 m明显的负偏可能与水体上部短时间内大量淡水注入有关(未发表的数据)。相对于 C284-甲基甾烷和C294-甲基甾烷, C304-甲基甾烷明显偏重的碳同位素值则可能反映了水体盐度对其的影响, 尤其是在Ⅲ段, 其碳同位素值偏重 5‰左右。它与Ga/HopC31R之间良好的正相关性证实了这一猜测,在水体盐度越高时, C304-甲基甾烷就越富集13C (图5)。2.2.4 藿烷类
藿类化合物主要来自于原核细菌的细胞膜, 其作用类似于真核生物中的甾醇, 起固定和支撑作用[23]。可以产生藿类化合物的细菌包括蓝细菌、异养细菌、甲烷营养菌和化学自养菌等[30]。因此, 藿/甾比可以反映有机质来源中细菌和藻类的相对贡献。嫩二段源岩藿/甾比值较高, 且变化较大(在 0.8~4.0之间),指示了该段细菌对沉积有机质的强烈改造和甾类化合物的较低保存能力[31], 说明该段对有机质的保存相对较差, 环境相对氧化; 嫩一段源岩甾烷化合物的相对丰度有所增加(藿/甾比值平均为1.2), 但是藿烷类的丰度依然高于甾烷化合物。因此, 嫩一、二段高丰度的藿烷化合物表明源岩沉积时湖泊水体和沉积物中的细菌类生物相当繁盛, 体现了明显有别于海相沉积的陆相湖泊沉积特征[23]。
在嫩一段检出的藿烷均具有最为偏轻的碳同位素组成, 其碳同位素值处于–32‰~ –68.65‰范围(图 4)。藿烷类化合物碳同位素组成处于–34‰~ –45‰之间常被认为来自于湖水分层处微需氧的化学自养菌[26–27],由于利用了贫13C的 CO2作为碳源, 因此该类细菌产生的有机质相对于初级生产者其碳同位素值大为偏轻[32], 而碳同位素值更加偏轻的藿烷类化合物则被认为来自于甲烷营养菌[26–27]; 该类细菌在许多湖相源岩[26–27]和现代湖泊生态系统中均有报道[33]。在嫩一段下部的多个样品的δ13C31hopane明显偏轻, 偏轻至–68.65‰, 表明有甲烷营养菌的贡献, 而在嫩一段上部的多个样品中δ13C31hopane组成多大于–45‰,表明水体中以化学自养菌为主。嫩二段源岩的藿烷类化合物碳同位素值相对富13C, 表明嫩二段的藿烷化合物更多来自于化学自养菌, 而不是甲烷营养菌。
总的来说, 单体碳同位素组成显示在嫩一段时期, 有机质以水生生物来源为主、且水体中甲烷营养菌和化学自养菌发育; 而在嫩二段时期高等植物来源贡献有所增加, 但低等菌藻类输入占绝对优势,水生生物来源的丰度大为降低, 且水体中细菌相比嫩一段更为繁盛, 以化学自养菌为主。
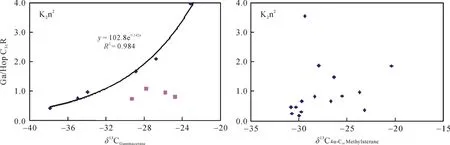
图 5 Ga/HopC31R 和 δ13CGa、δ13CC304-甲基甾烷的相关关系图Fig.5 Correlation plots of Ga/HopC31R vs. δ13CGa and Ga/HopC31R vs. δ13C4α,C30Methylsterane
2.3 沉积环境与生物作用
藿烷单体碳同位素显示嫩一段时期水体中甲烷营养菌和化学自养菌发育, 而嫩二段时期的藿烷化合物更多来自化学自养菌, 而不是甲烷营养菌, 这或许与嫩一、二段不同的水体环境有关。因为有机质在氧化环境中容易降解生成 CO2, 而在厌氧环境中则更多地厌氧降解有机质产生CH4[34]。图2显示嫩一段时期湖泊有稳定的水体分层, 尤其是在嫩一段下部的 C31hopane碳同位素极度偏轻段, 该时期湖泊水体分层最强烈, 存在间歇性的透光带缺氧, 即缺氧层上移、化跃层较浅的水体环境[8,12]。化跃层把有氧的水体与无氧水体分隔开, 上层主要由藻类和蓝细菌通过光合作用进行初级生产, 为有氧淡水环境; 下层无氧滞水层上部(包括化跃层)由厌氧细菌进行厌氧光合作用, 为缺氧半咸水环境; 而嫩二段时期湖泊水体分层被破坏, 化跃层界面较深, 湖泊呈微咸水氧化环境[9]。当嫩一段水体化跃层较浅时期, 有机质进行分解时消耗大量氧气形成 CO2,稳定的水体分层导致上层水体中的氧很难进入下部,使得下部水体呈缺氧状态, 从而导致分解产物在无氧状态下进一步分解为 CH4、H2、H2S等还原性气体, 这些气体在上升到表层的过程中部分溶解于水,分别被嗜甲烷细菌和其他厌氧细菌(如绿硫细菌等)所利用[35]。当嫩二段水体化跃层较深时, 湖泊水体呈氧化状态, 有机质降解生成 CO2, 水体分层的破坏使得上部水体中的氧进入水体下部, 从而导致更多的有机质被分解形成 CO2, 因而造成水体中的微生物以化学自养菌为主(图 6), 这与藿/甾比值所反映的一致。
伽马蜡烷指数(gammacerane/HopC31R)[23]在嫩一段时期处于0.21~3.96之间; 而在嫩二段的多数样品中缺失, 仅有的两个样品其伽马蜡烷指数只有0.36和0.78。说明了嫩二段源岩沉积时水体的分层状况很差或不存在, 而嫩一段源岩沉积时存在着稳定的水体分层。伽马蜡烷的生物前身物被认为是四膜虫醇的还原产物[23], 而四膜虫醇的主要来源似乎是分布于化跃层界面上噬菌的纤毛虫。嫩一段伽马蜡烷的碳同位素值变化较大, 在–37.86‰~ –23.93‰之间变化, 反映了水体分层界面细菌种类的多样性。δ13CGa与Ga/ HopC31R之间良好的正相关性, 相关系数达到 0.98, 说明水体盐度对δ13CGa有重要影响, 水体盐度越高时,δ13CGa越富集13C(图5)。通过公式计算, 偏离趋势线的 4个样品δ13CGa比同等盐度环境下的碳同位素偏重 6‰~10‰, 说明δ13CGa除了受水体盐度控制外, 还受其先体母质食物来源的影响。当纤毛虫捕食了碳同位素偏重的绿硫细菌(约–16‰)时, 相对应的其碳同位素值也会偏重[36]。已有的研究表明, 嫩一段时期丰富的芳基类异戊二烯化合物和 isorenieratane的检出指示了该时期存在间歇性的透光带缺氧, 显示该时期透光带存在绿硫细菌,化跃层较浅, 与嫩一段δ13CGa较重的时期相对应[8]。
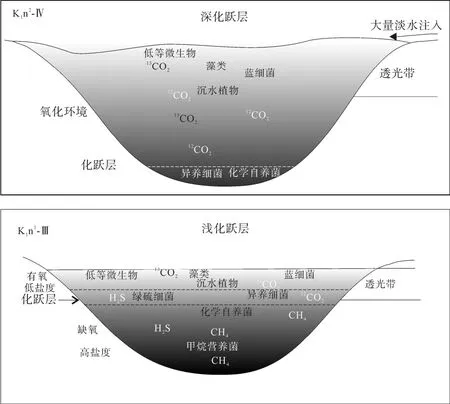
图6 松辽盆地不同化跃层深度的湖泊水体环境示意图Fig.6 A sketch illustrating the water environment of Songliao Basin at the two periods of different chemocline depths (without scale)
综上所述, 在嫩一段δ13CGa较重、δ13Chopane显著偏轻的层段与水体分层、间歇性透光带缺氧相对应,反映了该时期的化跃层界面较浅, 缺氧层上升到了透光带, 这种极端的水体环境有利于沉积有机质的保存, 这与该层段较高的TOC的HI值相对应; 而在嫩二段伽马蜡烷缺失、δ13Chopane较重时, 则反映了水体的化跃层界面较深, 环境相对较为氧化, 有机质保存条件变差, 导致了该段TOC和HI相对较低。由此可见, 水体化跃层界面的深浅不仅控制了湖泊沉积有机质的丰度, 还影响了水体中微生物的发育,在化跃层较浅的层段, 嗜甲烷菌、化学自养菌发育, 而在化跃层较深的层段, 水体中以化学自养菌为主。
3 总结和结论
嫩江组正构烷烃、藿烷类和甾烷类的单体碳同位素组成在剖面上的变化主要受母源输入和沉积环境的影响。通过对各生标化合物的组成分布以及单体碳同位素组成的分析, 我们初步恢复了古松辽湖泊水体生物的空间异构性(图6), 在上层氧化水体中主要以光合细菌和藻类为主, 在透光带下部的水体则以水生沉水生物为主, 底部微生物群落则以化能自养菌占优势; 而在嫩一段化跃层较浅时期, 水体微生物种类更为丰富, 在化跃层内存在异养细菌(如纤毛虫等)、绿硫细菌等厌氧微生物, 底部水体中则发育化能自养菌、甲烷营养菌等多种自养/异养细菌。
另外, C304-甲基甾烷和伽马蜡烷的碳同位素组成变化与水体盐度呈明显正相关关系, 水体盐度升高, 其碳同位素越重。除此之外,δ13CGa和δ13Chopane的组成还可反映化跃层界面的变化。当δ13Chopane偏轻且δ13CGa较重时, 说明化跃层界面较浅, 缺氧水体侵入到透光带, 水体中绿硫细菌、化能自养菌、甲烷营养菌等厌氧细菌发育; 而在δ13Chopane较重而伽马蜡烷缺失时, 反映了化跃层界面较深, 水体中发育化能自养菌。显然, 这些生标碳同位素组成在剖面上的变化可以用来表征沉积时期水体盐度变化、化跃层深浅以及水体微生物种类, 这对以后进一步细化水体环境特征和研究湖泊生物地球化学过程具有重要意义。
:
[1] Scott R W, Wan X, Wang C, Huang Q. Late Cretaceous chronostratigraphy (Turonian-Maastrichtian): SK1 core Songliao Basin, China [J]. Geosci Front, 2012, 3(4): 357–367.
[2] Bechtel A, Jia J, Strobl S A I, Sachsenhofer R F, Liu Z,Gratzer R, Püttmann W. Palaeoenvironmental conditions during deposition of the Upper Cretaceous oil shale sequences in the Songliao Basin (NE China): Implications from geochemical analysis [J]. Org Geochem, 2012, 46: 76–95.
[3] Hou D, Li M, Huang Q. Marine transgressional events in the gigantic freshwater lake Songliao: Paleontological and geochemical evidence [J]. Org Geochem, 2000, 31(7): 763–768.
[4] Xi D, Wan X, Feng Z, Li S, Feng Z, Jia J, Jing X. Discovery of Late Cretaceous foraminifera in the Songliao Basin: evidence from SK-1 and implications for identifying seawater incursions [J]. Chinese Sci Bull, 2011, 56(3): 253–256.
[5] Wang C S, Feng Z, Zhang L, Huang Y, Cao K, Wang P, Zhao B.Cretaceous paleogeography and paleoclimate and the setting of SKI borehole sites in Songliao Basin, northeast China [J]. Palaeogeogr Palaeoclimatol Palaeoecol, 2013, 385: 17–30.
[6] Chamberlain C P, Wan X, Graham SA, Carroll A R, Doebbert A C, Sageman B B, Blisniuk P, Kent-Corson M L, Wang Z,Wang C S. Stable isotopic evidence for climate and basin evolution of the Late Cretaceous Songliao basin, China [J].Palaeogeogr Palaeoclimatol Palaeoecol, 2013, 385: 106–124.
[7] 黄清华, 陈春瑞. 松辽盆地晚白垩世生物演化与古湖泊缺氧事件[J]. 微体古生物学报, 1998, 15(4): 417–425.Huang Qing-hua, Chen Chun-rui. The late Cretaceous bio-evolution and anoxic events in the ancient lake in the Songliao Basin [J]. Acta Micropalaeontol Sinica, 1998, 15(4):417–425 (in Chinese with English abstract).
[8] Song Z, Qin Y, Geroge S C, Wang L, Guo J, Feng Z. A biomarker study of depositional paleoenvironments and source inputs for the massive formation of Upper Cretaceous lacustrine source rocks in the Songliao Basin, China [J]. Palaeogeogr Palaeoclimatol Palaeoecol, 2013, 385: 137–151.
[9] Wang L, Song Z, Yin Q, George S C. Paleosalinity significance of occurrence and distribution of methyltrimethyltridecyl chromans in the Upper Cretaceous Nenjiang Formation, Songliao Basin, China [J]. Org Geochem, 2011, 42(11): 1411–1419.
[10] 万晓樵, 李罡, 陈丕基, 于涛, 叶得泉. 松辽盆地白垩纪青山口阶的同位素地层标志及其与海相 Cenomanian阶的对比[J]. 地质学报, 2005, 79(2): 150–156.Wan Xiao-qiao, Li Gang, Chen Pi-ji, Yu Tao, Ye De-quan.Isotope stratigraphy of the Cretaceous Qingshankou Formation in Songliao Basin and its correlation with marine Cenomanian stage [J]. Acta Geol Sinica, 2005, 79(2): 150–156 (in Chinese with English abstract).
[11] Zhang W, Li Y, Xu T, Cheng H, Zheng Y, Xiong P. Long–term variations of CO2trapped in different mechanisms in deep saline formations: A case study of the Songliao Basin, China [J].Int J Greenh Gas Contr, 2009, 3(2): 161–180.
[12] Bechtel A, Hámor-VidóM, Gratzer R, Sachsenhofer R F,Püttmann W. Facies evolution and stratigraphic correlation in the early Oligocene Tard Clay of Hungary as revealed by maceral, biomarker and stable isotope composition [J]. Mar Pet Geol, 2012, 35(1): 55–74.
[13] Sachse D, Billault I, Bowen G J, Chikaraishi Y, Dawson T E,Feakins S J, Freeman K H, Magill C R, McInerney F A, Van der Meer M T J. Molecular paleohydrology: Interpreting the hydrogen-isotopic composition of lipid biomarkers from photosynthesizing organisms [J]. Ann Rev Earth Planet Sci, 2012,40: 221–249.
[14] Luo G, Junium C K, Kump L R, Huang J, Li C, Feng Q, Shi X,Bai X, Xie S. Shallow stratification prevailed for 1700 to 1300 Ma ocean: Evidence from organic carbon isotopes in the North China Craton [J]. Earth Planet Sci Lett, 2014, 400: 219–232.
[15] Feng Z, Jia C, Xie X, Zhang S, Feng Z, Timothy A C. Tectonostratigraphic units and stratigraphic sequences of the nonmarine Songliao basin, northeast China [J]. Basin Res,2010, 22(1): 79–95.
[16] Ficken K J, Li B, Swain G, Eglinton D L. An n-alkane proxy for the sedimentary input of submerged/floating freshwater aquatic macrophytes [J]. Org Geochem, 2000, 31(7):745–749.
[17] Mead R, Xu Y, Chong J, Jaffé R. Sediment and soil organic matter source assessment as revealed by the molecular distribution and carbon isotopic composition of n-alkanes [J]. Org Geochem, 2005, 36(3): 363–370.
[18] Hayes J M. Factors controlling13C contents of sedimentary organic compounds: Principles and evidence [J]. Mar Geol,1993, 113(1): 111–125.
[19] Schouten S, Klein Breteler W, Blokker P, Schogt N, Rijpstra W I C, Grice K, Baas M, Sinninghe Damsté J S. Biosynthetic effects on the stable carbon isotopic compositions of algal lipids: Implications for deciphering the carbon isotopic biomarker record [J]. Geochim Cosmochim Acta, 1998, 62(8):1397–1406.
[20] Schouten S, van Kaam-Peters H M E, Rijpstra W I C, Schoell M, Sinninghe Damsté J S. Effects of an oceanic anoxic event on the stable carbon isotopic composition of early Toarcian carbon [J]. Am J Sci, 2000, 300(1): 1–22.
[21] Köster J, Rospondek M, Schouten S, Kotarba M, Zubrzycki A,Sinninghe Damsté J S. Biomarker geochemistry of a foreland basin:the Oligocene Menilite Formation in the Flysch Carpathians of Southeast Poland [J]. Org Geochem, 1998, 29(1): 649–669.
[22] Schouten S, Wakeham S G, Sinninghe Damsté J S. Evidence for anaerobic methane oxidation by archaea in euxinic waters of the Black Sea [J]. Org Geochem, 2001, 32(10): 1277–1281.
[23] Peters K E, Walters C C, Moldowan J M. The Biomarker Guide Vol.1: Biomarkers and Isotopes in the Environment and Human History [M]. 2nd ed. Oxford: Cambridge University Press, 2005: 148, 363.
[24] Sepúlveda J, Wendler J, Leider A, Kuss H J, Summons R E,Hinrichs K U. Molecular isotopic evidence of environmental and ecological changes across the Cenomanian–Turonian boundary in the Levant Platform of central Jordan [J]. Org Geochem, 2009, 40(5): 553–568.
[25] Grice K, Backhouse J, Alexander R, Marshall N, Logan G A. Correlating terrestrial signatures from biomarker distributions,δ13C,and palynology in fluvio-deltaic deposits from NW Australia (Triassic-Jurassic) [J]. Org geochem, 2005, 36(10): 1347–1358.
[26] Collister J W, Summons R E, Lichtfouse E, Hayes J M. An isotopic biogeochemical study of the Green River oil shale [J].Org Geochem, 1992, 19(1): 265–276.
[27] Freeman K H, Hayes J M, Trendel J M, Albrecht P. Evidence from carbon isotope measurements for diverse origins of sedimentary hydrocarbons [J]. Nature, 1990, 343(6255):254–256.
[28] van Kaam-Peters H M E, Schouten S, De Leeuw J W, Sinninghe Damsté J S. A molecular and carbon isotope biogeochemical study of biomarkers and kerogen pyrolysates of the Kimmeridge Clay Facies: Palaeoenvironmental implications[J]. Org Geochem, 1997, 27(7/8): 399–422.
[29] Zhang Y, Jiang A, Sun Y, Xie L, Chai P.. Stable carbon isotope compositions of isoprenoid chromans in Cenozoic saline lacustrine source rocks from the Western Qaidam Basin, NW China: Source implications [J]. Chinese Sci Bull, 2012, 57(9): 1013–1023.
[30] Sinninghe Damsté J S, Schouten S. Is there evidence for a substantial contribution of prokaryotic biomass to organic carbon in Phanerozoic carbonaceous sediments [J]. Org Geochem, 1997, 26(9): 517–530.
[31] Boreham C J, Summons R E, Roksandic Z, Dowling L M,Hutton A C. Chemical, molecular and isotopic differentiation of organic facies in the Tertiary lacustrine Duaringa oil shale deposit, Queensland, Australia [J]. Org Geochem, 1994, 21(6):685–712.
[32] Huang Y, Lockheart M J, Collister J W, Eglinton G. Molecular and isotopic biogeochemistry of the Miocene Clarkia Formation: hydrocarbons and alcohols [J]. Org Geochem,1995, 23(9): 785–801.
[33] Neunlist S, Rodier C, Llopiz P. Isotopic biogeochemistry of the lipids in recent sediments of Lake Bled (Slovenia) and Baldeggersee (Switzerland) [J]. Org Geochem, 2002, 33(10):1183–1195.
[34] Cabrera L, Cabrera M, Gorchs R, De Las Heras F X C.Lacustrine basin dynamics and organosulphur compound origin in a carbonate–rich lacustrine system (Late Oligocene Mequinenza Formation, SE Ebro Basin, NE Spain) [J]. Sediment Geol, 2002, 148(1): 289–317.
[35] 王曼, 季峻峰, 陈骏, 张传伦. 沉积物中细菌叶绿素的环境指示意义[J]. 高校地质学报, 2007. 13(1): 23–29.Wang Man, Ji Jun-feng, Chen Jun, Zhang Chuan-lun. Environmental implications of pigments from anoxygenic phototrophic bacteria in sediments [J]. Geol J Chian Univ, 2007,13(1): 23–29 (in Chinese with English abstract).
[36] DeNiro M J, Epstein S. Influence of diet on the distribution of carbon isotopes in animals [J]. Geochim Cosmochim Acta,1978, 42(5): 495–506.
