下丘脑乳头体核对哮喘大鼠呼吸运动的调控作用研究
2015-06-28陈晨刘保森董榕
陈晨,刘保森,董榕
下丘脑乳头体核对哮喘大鼠呼吸运动的调控作用研究
陈晨,刘保森,董榕
目的研究下丘脑后区结节乳头体核(TMN)组胺能神经元在哮喘发作中的作用。方法取72只健康雄性SD大鼠作为研究对象,其中64只通过腹腔注射卵蛋白(OA)致敏,雾化吸入OA溶液诱发哮喘发作,制作大鼠哮喘模型,余8只作为对照。在麻醉状态下通过静脉注射OA溶液诱发大鼠哮喘发作,用生物信号采集系统记录下丘脑后区结节乳头体核(TMN)电活动,并进行功能谱分析。利用中枢立体定位技术,分别对TMN进行电刺激与电损毁;通过中枢核团微量注射技术,在TMN内分别微量注射组胺H3受体激动剂R-α-Me-HA与拮抗剂THIO,检测膈肌放电频率及积分、每分通气量、呼气与吸气时程比、气道阻力和肺顺应性等肺功能指标。结果与正常对照大鼠比较,哮喘大鼠TMN放电组的α波,β1与β2波所占比例升高,δ波和θ波的比例降低,放电总功率升高。与对照大鼠比较,采用电刺激哮喘大鼠TMN以及在TMN内微量注射组胺H3受体拮抗剂时,大鼠膈肌肌电频率、呼气/吸气比和气道阻力均增加,膈肌肌电积分、每分通气量和肺顺应性减小。而采用电损毁哮喘大鼠TMN以及在TMN内微量注射组胺H3受体激动剂后,膈肌肌电频率、呼气/吸气比和气道阻力均减小,膈肌肌电积分、每分通气量和肺顺应性增加。结论下丘脑后区TMN核团活动可影响哮喘大鼠的呼吸活动。
哮喘;下丘脑区,侧;受体,组胺H3
近年来,由于空气污染加剧,呼吸系统疾病高发,哮喘患者也呈现出日益增多的趋势[1]。哮喘的本质是气道慢性炎症,组胺是在气道炎症的调节过程中释放数量最多的炎性介质[2],在哮喘的发病机制中占重要地位,而组胺同时又是脑内重要的神经递质[3-4],对呼吸、循环、内分泌等系统均具有重要的调控功能[5]。在成年哺乳动物脑内,分布于下丘脑后区的结节乳头体核(tuberomammillary nucleus,TMN)是已知的神经元组胺的唯一来源[6]。介导组胺作用的受体有4种亚型(H1、H2、H3、H4),其中组胺H3受体主要分布在中枢组胺能神经元密集的脑区,是热门的药物靶点[7]。本研究以哮喘大鼠为模型,研究中枢组胺能神经元所在部位TMN是否与哮喘发作有关,从而进一步揭示哮喘发病机制并为研发新的哮喘治疗药物提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 正常健康成年雄性SD大鼠72只,体重270~310g,在安静、温暖(18~25℃)、避强光的实验室预饲养1周后供实验使用。
1.1.2 主要试剂与仪器 灭活的百日咳杆菌沉淀原液(北京生物制品研究所),卵蛋白溶液、H3受体激动剂R-α甲基组胺(R-α-methylhistamine, R-α-Me-HA)及H3受体拮抗剂Thioperamide(美国Sigma公司),402型超声雾化器(上海四菱医疗器械厂),Powerlab ML856生物信号采集处理系统(澳大利亚ADInstruments) ,江湾Ⅰ型C脑立体定位仪(第二军医大学),微量注射机(浙江医科大学医学仪器厂)。
1.2 方法
1.2.1 哮喘模型大鼠的制备 抗原液配制:取卵蛋白粉末100mg、氢氧化铝干粉100mg,加入灭活的百日咳杆菌疫苗液1ml(含百日咳杆菌疫苗5×109个)中配成混悬液,用前现配。
实验第1天对大鼠行腹腔注射抗原液1ml致敏,第3天再次给予腹腔注射1ml予以强化,自第15天至第17天超声雾化吸入1%卵蛋白溶液(40ml,20min,颗粒直径≤5μm ),接通电源后待气雾从超声雾化器均匀流出到雾化箱内,将大鼠放入雾化箱,开始计时,直至大鼠出现烦躁不安、呼吸急促、点头呼吸、喘息、咳嗽等哮喘症状,20min后将大鼠取出。每天1次,每次均以哮喘症状出现作为指标,连续3d。
观测哮喘模型大鼠雾化吸入卵蛋白,诱发哮喘发作时的呼吸状态改变,以及静脉注射卵蛋白生理盐水溶液后呼吸频率、潮气量和每分通气量变化,确定哮喘模型制备是否成功。
1.2.2 实验分组 首先,为确定大鼠哮喘发作时下丘脑后区TMN核团脑电活动变化,设卵蛋白致敏模型组(asthma组)和生理盐水对照组(control组)。卵蛋白致敏模型组:参照1.2.1制备哮喘模型大鼠,麻醉后,进行手术(气管插管和脑立体定位),尾静脉注射卵蛋白生理盐水溶液30mg/kg。生理盐水对照组:实验第1天,取8只大鼠分别腹腔注射生理盐水1ml,第3天每只大鼠再次腹腔注射1ml生理盐水强化,自第15天至第17天超声雾化吸入1% 生理盐水。手术后尾静脉注射同卵蛋白致敏模型组等体积的生理盐水。
其次,探测电刺激与电损毁对哮喘大鼠的影响及TMN核团变化,实验设卵蛋白致敏模型组、生理盐水对照组、电刺激(Stimulation)组、电毁损(Lesion)组和假手术(Sham)组等5组(n=8)。其中,卵蛋白致敏模型组和生理盐水对照组处理同上;电刺激组:电刺激下丘脑后区TMN核团;电毁损组:电损毁下丘脑后区TMN核团;假手术组:电极插入下丘脑后区TMN核团,但不通电刺激或损毁。
最后,探测TMN内微量注射组胺H3受体激动剂和拮抗剂对哮喘大鼠的影响及TMN核团的变化,实验设卵蛋白致敏模型组、生理盐水对照组、TMN-R-α-Me-HA组、TMN-THIO组、TMN-ACFS组和TMN-sham组等6组(n=8)。其中,卵蛋白致敏模型组和生理盐水对照组处理同上;TMN-R-α-Me-HA组、TMN-THIO组和TMN-ACFS组:分别在下丘脑后区TMN核团内微量注射组胺H3受体激动剂R-α-Me-HA或注射组胺H3受体拮抗剂THIO或注射人工脑脊液;TMN-sham组:下丘脑后区TMN核团内只插管,不进行微量注射。
1.2.3 动物呼吸功能检测 本实验选择膈肌肌电(diaphragm electromyography,EMGdi)频率(frequency)、膈肌肌电积分(integral)、每分通气量(minute ventilation volume,MVV)、呼气时程(expiratory time,TE)、吸气时程(inspiratory time,TI)、气道阻力(airway resistance,Raw)和肺顺应性(dynamic pulmonary compliance,Cdyn)等作为哮喘大鼠肺功能变化的观测指标。
具体实验操作如下:大鼠用乌拉坦(1g/kg)麻醉后,取仰卧位固定四肢及头部,分离气管,作一倒“T”型切口,插入气管插管,连接呼吸流量换能器供测定呼吸流量。将食道作横向切口,插入头端有四个侧孔的注水导管,后连血压换能器供测定食道内压,以代替胸内压。
正中切开上腹部皮肤,分离出剑突及其下方的膈小肌,用双极铂金引导电极插入膈小肌内引导膈肌肌电活动。呼吸流量、食道内压和膈肌肌电3种信号经Powerlab生物信号采集处理系统,由计算机采样并进行分析处理,统计出呼吸频率、潮气量、每分通气量、气道阻力、肺顺应性与膈肌放电积分。采样频率10kHz,时间常数0.001。
1.2.4 中枢立体定位和核团微量注射 按照George Paxinos and Charles Watson图谱要求,控制大鼠体重于270~310g,腹腔注射乌拉坦(1g/kg)麻醉后,将动物固定在脑立体定位仪上。切牙低于耳间线3.3mm,在TMN内埋一内径为0.3mm的不锈钢管作为注射引导管,用牙托水泥和502胶固定。用外径0.2mm的不锈钢管作为注射管,注射管尖端露出0.5mm,以注射管尖端正好到达坐标点为准。用拉制的细聚氯乙烯管将注射管和微量注射机相连,实验时将注射管插入引导管中准备给药。用微量注射机恒速注射,注射后留管20min。
1.2.5 下丘脑后区TMN核团脑电活动的引导 按照George Paxinos and Charles Watson 图谱要求,控制大鼠体重于270~310g,乌拉坦(1g/kg)麻醉后,将动物固定于江湾Ⅰ型脑立体定位仪上,切牙低于耳间线3.3mm,TMN的坐标为:AP –4.2mm(前囟后),LR 1.5mm,H –8.1mm (颅骨下)。植入不锈钢电极(直径0.1mm,尖端裸露0.1mm)作为记录电极,参考电极(与记录电极性质相同的不锈钢电极)埋置于头皮下,接地电极插入下肢皮下,记录电极用牙托粉加502胶水固定。TMN核团脑电活动采用Powerlab生物信号采集系统记录。参数设置:增益4000;滤波100Hz;时间常数0.1s。实验结束后用美蓝法验证电极植入的部位。记录后对放电活动进行功率谱分析。功率谱分析指标预置为:频率0~100Hz,频率分辨率为0.195Hz。使用快速傅立叶方法计算总功率中δ、θ、α、β1、β25个频段的功率百分比,各频段的频率范围是:δ 1.17~3.91Hz,θ 3.91~8.20Hz,α 8.20~13.28Hz,β113.28~20.31Hz,β220.31~30.8Hz。
1.2.6 电刺激与电损毁下丘脑后区TMN核团脑电活动的引导 大鼠用25%乌拉坦(1g/kg)腹腔内注射麻醉,将动物固定在脑立体定位仪上,切牙低于耳间线3.3mm。将外径0.4mm、内径0.1mm、尖端裸露0.3mm的同心圆电极植入右侧乳头体核。电刺激的参数为单相方波,波宽0.2ms,强度0.4mA,持续1min;电损毁的参数为电流1mA,持续10s。Sham组只插电极,不通电刺激或损毁。实验结束后取脑,用10%甲醛固定4~7d后,用冰冻切片机进行冰冻切片,鉴定微量注射或电极位置,对照大鼠脑图谱,确定注射部位是否准确,定位不准者,数据不纳入统计。
1.3 统计学处理 采用SAS9.3对数据进行统计学分析所有数据均以表示,多组间比较采用方差分析,单因素比较时用One-Way ANOVA,两因素比较时用Two-Way ANOVA,进一步两两间比较采用SNK-q检验。P<0.05示差异有统计学意义。
2 结 果
2.1 大鼠哮喘模型的确立
2.1.1 雾化吸入卵蛋白后行为状态的变化 哮喘模型动物第15天至第17天雾化吸入1%卵蛋白生理盐水溶液,以激发哮喘发作,在雾化吸入后约5min,大鼠出现烦躁不安、抓搔面部、呼吸急促、点头呼吸、喘息、咳嗽等哮喘症状,15min左右达高峰,可持续30min。正常动物对照组于相同条件下雾化吸入生理盐水,进行假激发,大鼠行为状态无明显变化。
2.1.2 静脉注射卵蛋白后呼吸频率、潮气量和每分通气量变化 为确定哮喘发作后的肺功能变化,测定对照组静脉注射生理盐水假激发前后和哮喘模型动物静脉注射卵蛋白溶液前后的呼吸频率(frequency)、潮气量(tidal volume,VT)、每分通气量(minute ventilation volume,MVV)。
大鼠尾静脉注射卵蛋白后,呼吸频率增加,潮气量下降,每分通气量减少,呈浅快呼吸,可持续30min左右(表1)。
表1 哮喘激发前后呼吸频率、潮气量和每分通气量变化(±s,n=8)Tab.1 Changes of respiratory frequency(f),tidal volume(VT) and minute ventilation volume(MVV) before and after ovalbumin challenge (±s,n=8)
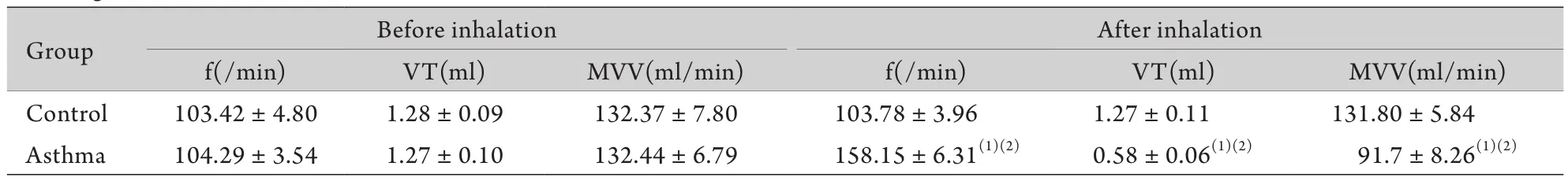
表1 哮喘激发前后呼吸频率、潮气量和每分通气量变化(±s,n=8)Tab.1 Changes of respiratory frequency(f),tidal volume(VT) and minute ventilation volume(MVV) before and after ovalbumin challenge (±s,n=8)
(1)P<0.01 compared with control group; (2)P<0.01 compared with before inhalation
Group Before inhalation After inhalation f(/min) VT(ml) MVV(ml/min) f(/min) VT(ml) MVV(ml/min) Control 103.42±4.80 1.28±0.09 132.37±7.80 103.78±3.96 1.27±0.11 131.80±5.84 Asthma 104.29±3.54 1.27±0.10 132.44±6.79 158.15±6.31(1)(2) 0.58±0.06(1)(2) 91.7±8.26(1)(2)
2.2 大鼠哮喘发作时下丘脑后区TMN核团脑电活动的变化 电活动的记录是在手术操作完成30min后进行,利用Powerlab生物信号采集系统记录TMN放电变化过程,并对放电图形进行功率谱分析。与control组比较,Asthma组δ、θ波所占百分比降低,而α、β1、β2波所占百分比均升高,差异均具有统计学意义(P<0.05),总功率明显增加(P<0.01,表2)。
2.3 电刺激与电损毁TMN以及TMN内注射组胺H3受体激动剂与拮抗剂对哮喘大鼠肺功能的影响 对哮喘模型大鼠下丘脑后区的TMN核团分别进行电刺激与电损毁,观察哮喘发作时呼吸功能的改变。结果显示,电刺激与电损毁的假手术与哮喘组之间各项指标均无明显差异。与哮喘组比较,电刺激组的膈肌肌电频率、呼气时程/吸气时程比均增加(P<0.05),气道阻力增加(P<0.01),膈肌肌电积分、每分通气量和肺顺应性均减小(P<0.01)。与哮喘组比较,电损毁组的膈肌肌电频率、呼气时程/吸气时程比和气道阻力均减小(P<0.01),膈肌肌电积分、每分通气量和肺顺应性均增加(P<0.01,表3)。
表2 哮喘大鼠TMN核团脑电的功率谱(±s,n=8)Tab. 2 EEG power spectra of TMN in asthmatic rats (±s,n=8)
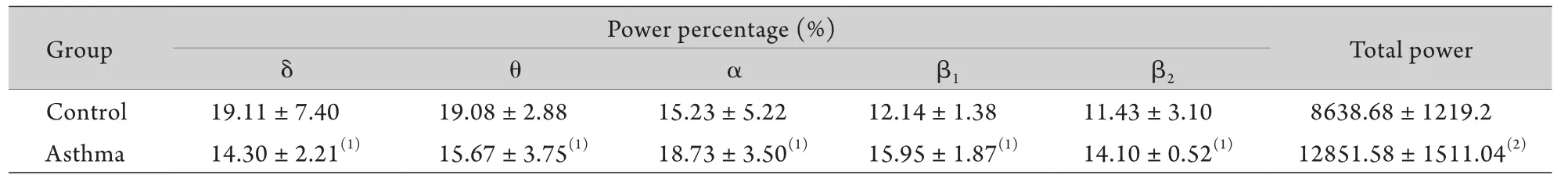
表2 哮喘大鼠TMN核团脑电的功率谱(±s,n=8)Tab. 2 EEG power spectra of TMN in asthmatic rats (±s,n=8)
(1)P<0.01,(2)P<0.05 compared with control group
?
表3 电刺激与电损毁TMN对哮喘大鼠肺功能的影响(±s,n=8)Tab.3 Effects on MVV,EMGdi frequency,EMGdi integral,TE/TI,Raw and Cdyn of TMN stimulation or lesion in asthmatic rats (±s,n=8)
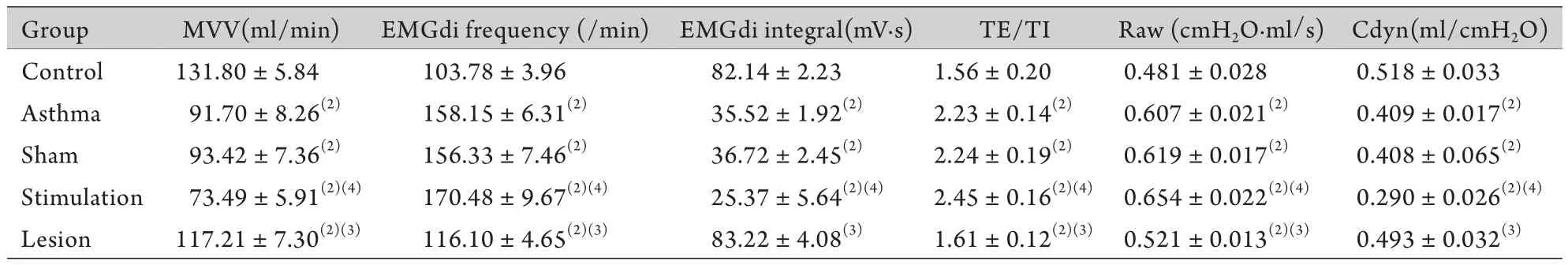
表3 电刺激与电损毁TMN对哮喘大鼠肺功能的影响(±s,n=8)Tab.3 Effects on MVV,EMGdi frequency,EMGdi integral,TE/TI,Raw and Cdyn of TMN stimulation or lesion in asthmatic rats (±s,n=8)
(1)P<0.01,(2)P<0.05 compared with control group; (3)P<0.01,(4)P<0.05 compared with asthma group; MVV. Minute ventilation volume; EMGdi frequency. Diaphragm electromyography frequency; EMGdi integral. Diaphragm electromyography integral; TE/TI. Expiratory time/ inspiratory time; Raw. Airway resistance; Cdyn. Dynamic pulmonary compliance
Group MVV(ml/min) EMGdi frequency (/min) EMGdi integral(mV·s) TE/TI Raw (cmH2O.ml/s) Cdyn(ml/cmH2O) Control 131.80±5.84 103.78±3.96 82.14±2.23 1.56±0.20 0.481±0.028 0.518±0.033 Asthma 91.70±8.26(2) 158.15±6.31(2) 35.52±1.92(2) 2.23±0.14(2) 0.607±0.021(2) 0.409±0.017(2)Sham 93.42±7.36(2) 156.33±7.46(2) 36.72±2.45(2) 2.24±0.19(2) 0.619±0.017(2) 0.408±0.065(2)Stimulation 73.49±5.91(2)(4) 170.48±9.67(2)(4) 25.37±5.64(2)(4) 2.45±0.16(2)(4) 0.654±0.022(2)(4) 0.290±0.026(2)(4)Lesion 117.21±7.30(2)(3) 116.10±4.65(2)(3) 83.22±4.08(3) 1.61±0.12(2)(3) 0.521±0.013(2)(3) 0.493±0.032(3)
2.4 TMN内注射组胺H3受体激动剂与拮抗剂对哮喘大鼠肺功能的影响 哮喘模型大鼠TMN内微量注射R-α-Me-HA与THIO,观察哮喘发作时呼吸功能的改变。结果显示,与哮喘组比较,TMN-THIO组的膈肌肌电频率、呼气时程/吸气时程比和气道阻力均增加(P<0.05),膈肌肌电积分、每分通气量和肺顺应性均减小(P<0.05)。与哮喘组比较,TMN-R-α-Me-HA组呼气时程/吸气时程比和气道阻力均减小(P<0.05),膈肌肌电频率减小(P<0.01),每分通气量和肺顺应性均增加(P<0.05),膈肌肌电积分增加(P<0.01)。假手术组及溶剂对照组(TMN-sham组)与哮喘组之间各项指标无统计学意义(表4)。
表4 TMN内注射组胺H3受体激动剂与拮抗剂对哮喘大鼠肺功能的影响(±s,n=8)Tab.4 Effects on MVV,EMGdi frequency,EMGdi integral,TE/TI,Raw and Cdyn of intra-TMN microinjection of histamine agonist or antagonist in asthmatic rats (±s,n=8)

表4 TMN内注射组胺H3受体激动剂与拮抗剂对哮喘大鼠肺功能的影响(±s,n=8)Tab.4 Effects on MVV,EMGdi frequency,EMGdi integral,TE/TI,Raw and Cdyn of intra-TMN microinjection of histamine agonist or antagonist in asthmatic rats (±s,n=8)
(1)P<0.01,(2)P<0.05 compared with control group; (3)P<0.01,(4)P<0.05 compared with asthma group
Group MVV(ml/min) EMGdi frequency(/min)EMGdi integral(mV·s) TE/TI Raw(cmH2O.ml/s)Cdyn(ml/cmH2O) Control 131.80±5.84 103.78±3.96 82.14±2.23 1.56±0.20 0.481±0.028 0.518±0.033 Asthma 91.70±8.26(2) 158.15±6.31(2) 35.52±1.92(2) 2.23±0.14(2) 0.607±0.021(2) 0.409±0.017(2)TMN-sham 93.89±7.27(2) 158.19±4.95(2) 35.85±2.07(2) 2.22±0.17(2) 0.604±0.027(2) 0.412±0.025(2)TMN-ACFS 94.86±7.54(2) 159.62±5.73(2) 36.03±1.88(2) 2.21±0.11(2) 0.615±0.025(2) 0.396±0.019(2)TMN-R-α-Me-HA 115.08±5.91(1)(4) 120.42±4.77(1)(4) 65.20±2.54(1)(4) 1.70±0.08(1)(4)0.538±0.023(1)(4) 0.513±0.014(1)(4)TMN-THIO 81.29±4.30(2)(4) 168.48±3.90(2)(4) 26.24±3.41(2)(4) 2.44±0.13(2)(4)0.656±0.032(2)(4) 0.308±0.035(2)(4)
3 讨 论
随着对哮喘发生机制研究的深入,有报道中枢神经系统也参与了哮喘的病理发生过程[8]。组胺是哮喘中的重要炎症介质[9],在哮喘发生发展过程的多个环节中都起作用[10]。组胺也存在于中枢神经系统中,作为中枢神经递质参与了大脑的许多生理及病理生理反应[11]。
本研究观察了中枢组胺能神经元胞体所在部位,即下丘脑后区TMN核团的放电活动,所记录到的脑电图(electroencephalogram,EEG)是该核团内大量神经元的兴奋性突触后电位(excitatory postsynaptic potential,EPSP)与抑制性突触后电位(inhibitorpostsynaptipotential,IPSP)的总和,该电活动属于场电位,反映的是中枢神经系统兴奋性的动态变化[12]。对记录到的EEG进行脑电功率谱分析,包括脑电功率和频率分配两个指标。脑电功率反映的是脑电波的总功率和主频率;而频谱分配反映各频段脑电波的功率在脑电总功率中所占百分比。实验结果显示,哮喘发作时,TMN的EEG表现为频率较高的α、β1、β2波所占百分比均升高,低频的δ、θ波所占百分比均降低,总功率增大。一般认为,脑电波由高振幅、低频率转化为低振幅、高频率时,称为去同步化,表示神经核团的兴奋过程增强。反之,由低振幅、高频率转化为高振幅、低频率时,称为同步化,表示神经核团的抑制过程加深。总功率亦是神经核团功能活动状态的反映。因此,本实验结果表明,在哮喘发作过程中,下丘脑后区TMN核团的兴奋性增强,而该区是组胺能神经元存在的主要部位,其发出的组胺能纤维可广泛地投射至其他脑区,与其他脑区内的神经元形成突触联系,从而对哮喘的发生发展过程起到调控作用。
哮喘主要是以气道高反应性和气流阻塞(气道阻力增加)为特点的慢性气道炎症[13]。急性发作时,因小气道痉挛导致通气功能障碍,气道阻力增加,气体吸入和交换减少,机体可出现浅快呼吸[14]。哮喘急性发作时的呼吸表现可能是在神经中枢整合驱动下发生的复杂调节过程的结果[15]。电生理实验的结果提示,大鼠哮喘发作时,下丘脑后区TMN的功能活动增强。本实验中,哮喘模型大鼠通过静脉注射卵蛋白诱发后,呈现出典型的哮喘急性发作期的呼吸变化过程。电损毁双侧下丘脑后区TMN核团后,哮喘大鼠呼吸功能得以明显改善;电刺激兴奋TMN核团后,哮喘大鼠呼吸状况则进一步恶化,提示下丘脑后区TMN核团的功能活动可影响哮喘动物的呼吸活动。组胺H3受体主要属于突触前自身受体[16],当该受体活化时,可负反馈地调控组胺能神经元合成与释放;大鼠哮喘发作时,在TMN内微量注射高选择性的组胺H3受体激动剂R-α-Me-HA,哮喘大鼠呼吸功能亦有明显好转;TMN内微量注射高选择性的H3受体拮抗剂THIO,哮喘症状加重,提示通过组胺H3受体可能引起TMN的组胺能神经元内组胺的合成与释放的改变,从而对哮喘动物的呼吸活动产生影响。这亦与电损毁及电刺激TMN核团所引起的哮喘大鼠呼吸活动的变化一致。
哮喘的外周发病机制已比较明确,近年来,在对哮喘积极进行遗传学研究的同时,越来越多的学者开始关注中枢神经系统在哮喘发作中的作用[17],通过神经内分泌免疫网络来全面理解哮喘的发病机制[18]。本研究对此进行了初步探索,电生理以及药物两个方面结果均提示下丘脑后区TMN的组胺能神经元对哮喘的发病具有调控作用。
[1]Seil S,Hamid A,Lena U. Translational value of animal models of asthma: Challenges and promises[J]. Eur J Pharmacol,2015,759: 272-277.
[2]Yan ZQ,Hong JK,Li DB,et al. Expression of histamine H4 receptor in nasal mucosa of rats with allergic rhinitis[J]. Med J Chin PLA,2010,35(7): 857-859. [燕志强,洪锦科,李得本,等. 组胺H4受体在变应性鼻炎大鼠鼻黏膜中的表达[J]. 解放军医学杂志,2010,35(7): 857-859.]
[3]Martin M,Kazutaka M. The metabolism of histamine in rat hypothalamus and cortex after reserpine treatment[J]. Neurochem Int,2015,85-86: 31-39.
[4]Blindow S,Preisser AM,Baur X,et al. Is the analysis of histamine and/or interleukin-4 release after isocyanate challenge useful in the identification of patients with IgE-mediated isocyanate asthma[J]? J Immunol Methods,2015,422: 35-50.
[5]Ji J,Dong R. Effect of histamine H3receptor in the hypothalamic paraventricular nucleion hypoth-alamic-pituitary-adrenal axis in rats with asthma[J]. Acta Univ Med Nanjing,2011,31(1): 40-43. [季吉,董榕. 下丘脑室旁核组胺H3受体对哮喘大鼠下丘脑垂体肾上腺轴功能的调控[J].南京医科大学学报(自然科学版),2011,31(1): 40-43.]
[6]Brown RE,Stevens DR,Haas HL. The physiology of brain histamine [J]. Prog Neurobiol,2001,63(6): 637-672.
[7]Jarskog LF,Lowy MT,Grove RA,et al. A Phase II study of a histamine H receptor antagonist GSK239512 for cognitive impairment in stable schizophrenia subjects on antipsychotic therapy[J]. Schizophr Res,2015,164(1-3):136-142.
[8]Passani MB,Blandina P. Histamine receptors in the CNS as targets for therapeutic intervention[J]. Trends Pharmacol Sci,2011,32(4): 242-249.
[9]Matsumoto K,Aizawa H,Fukuyama S,et al. Low-dose salbutamol suppresses airway responsiveness to histamine but not methacholine in subjects with asthma[J]. Respir Investig,2013,51(3): 158-165.
[10] Dong Rong,Zhang Min,Liu BS. The effect of central histamine H3rececptor on breathing activity of asthmatic guinea pigs[J]. Chin J Appl physiol,2006,22(1): 117-121.[董榕,张敏,刘保森.中枢组胺H3受体对哮喘豚鼠呼吸运动的影响[J].中国应用生理学杂志,2006,22(1): 117-121.]
[11] Hu CM,Dong R,Liu BS,et al. Effect of histamine H3receptors in nucleus tractus solitaries on c-Fos expression in the brain of rats with asthma onset[J]. J Southest Univ(Med Sci Edi),2005,24(6): 371-374. [胡春梅,董榕,刘保森,等.大鼠孤束核H3受体对哮喘发作时脑组织中Fos蛋白表达的影响[J]. 东南大学学报,2005,24(6): 371-374.]
[12] Shen HF,Zhang XH,Zhu XJ,et al. Effects of chronic ethanol exposure on the EEG and power spectra in rat nucleus accumben[J]. Chin J Neurosci,2002,18(1): 446-450.[沈红芬,张晓虎,朱学江,等. 慢性酒精刺激对大鼠伏核EEG及脑电功率谱的影响[J]. 中国神经科学杂志,2002,18(1): 446-450.]
[13] Dinh-Xuan AT,Annesi-Maesano I,Berger P,et al. Contribution of exhaled nitric oxide measurement in airway i nflammation assessment in asthma[J]. Rev Mal Respir,2015,32(2): 193-215.
[14] Hu H. Cough variant asthma: progress in diagnosis and treatment[J]. Med J Chin PLA,2014,39(5): 361-364. [胡红.咳嗽变异性哮喘的诊断及治疗进展[J]. 解放军医学杂志,2014,39(5): 361-364.]
[15] Liu NN,Dong R,Liang Y,et al. Study on the activities of amygdala in the modelsof asthma and its mechanisms[J]. Chinese Journal of Neuroanatomy,2008,24(3): 292-296.[刘伲娜,董榕,梁韵,等. 杏仁核参与大鼠哮喘发作及其机制探讨[J]. 神经解剖学杂志,2008,24(3): 292-296.]
[16] Ellenbroek BA,Ghiabi B. The other side of the histamine H3 receptor[J]. Trends Neurosci,2014,37(4): 191-199.
[17] Haxhiu MA,Rust CF,Brooks C,et al. CNS determinants of sleep-related worsening of airway functions: Implications for nocturnal asthma[J]. Respir Physiol Neurobiol,2006,151(1): 1-30.
[18] Harkness LM Ashton AW,Burgess JK. Asthma is not only an airway disease,but also a vascular disease[J]. Pharmacol Ther,2015,148: 17-33.
The role of hypothalamus tuberomammillary nucleus on the regulation of respiratory movement of rats with asthma
CHEN Chen,LIU Bao-sen,DONG Rong*
Experimental Center of Basic Medicine,Medical School of Southeast University,Nanjing 210009,China
*< class="emphasis_italic">Corresponding author,E-mail: dongrongshengli@163.com
,E-mail: dongrongshengli@163.com
ObjectiveTo explore the role of central histaminergic neurons in the tuberomammillary nucleus (TMN) of posterior hypothalamus on asthma.MethodsSeventy-two healthy male SD rats were served as study objects. Sixty-four rats were sensitized with ovalbumin (OA) solution intraperitoneally and challenged with OA aerosol inhalation to prepare asthma model. Asthma attack was evoked in asthmatic rats by OA solution injected intravenously,the electrical activities of TMN in posterior hypothalamus were recorded with biological signal collecting system and the power spectra were analyzed. TMN was lesioned or stimulated electrically by central stereo positioning technology. Histamine H3receptor agonist R-(α)-methylhistamine (RMHA) or antagonist thioperamide (THIO) was microinjected into TMN by central nuclear group microinjection technology,and the pulmonary function indexes were detected including diaphragm electromyography (EMGdi) frequency,EMGdi integral,minute ventilation volume (MVV),expiratory time/inspiratory time (TE/TI),airway resistance (Raw) and dynamic pulmonary compliance (Cdyn).ResultsCompared with control group,the percentage of α,β1and β2wave in the electrical activities of TMN of asthmatic rats increased significantly,while the percentage of δ and θ wave decreased and the total discharge power increased. Compared with the corresponding control group,electric lesion of TMN or TMN microinjected with histamine H3receptor antagonist increased EMGdi frequency,TE/TI,Raw,and decreased EMGdi integral,MVV and Cdyn. Compared with the corresponding control group,electric stimulation of TMN or TMN microinjected with histamine H3receptor agonist decreased EMGdi frequency,TE/TI,Raw,and increased EMGdi integral,MVV and Cdyn.ConclusionCentral histaminergic neurons in tuberomammillary nucleus of posterior hypothalamus are activated in asthmatic rats.
asthma; hypothalamic area,lateral; receptors,histamine H3
R562.25
A
0577-7402(2015)12-0981-06
10.11855/j.issn.0577-7402.2015.12.09
2015-07-01;
2015-10-27)
(责任编辑:沈宁)
陈晨,硕士研究生,助理工程师。主要从事哮喘机制方面的研究
210009 南京 东南大学医学院基础医学实验中心 (陈晨、刘保森、董榕)
董榕, E-mail:dongrongshengli@163.com
