听觉剥夺对成年雄性斑胸草雀鸣唱行为和LMAN核团的影响
2020-04-18刘钟泽孙颖郁张信文杨思远
刘钟泽,孙颖郁,张信文,杨思远
(1.热带岛屿生态学教育部重点实验室,海南师范大学 生命科学学院,海南 海口 571158;2.海南科技职业大学,海南 海口 571126;3.北京师范大学 生命科学学院,北京 100875)
自然界中许多动物可以通过声音进行交流,例如鲸,蝙蝠等[1],但这些发声行为并不是通过学习产生的。鸣禽是除了人类以外极少具有发声学习能力的动物,鸟类具有鸣叫(call)和鸣唱(sing)两种发声行为,其叫声中包含有丰富的生物学信息,被用来进行个体及种群之间的识别、求偶、觅食、报警、筑巢等活动,被称为鸟类的语言[2]。与人类的语言相似,鸣禽的鸣唱是一种依赖于听觉反馈的后天习得发声行为。幼鸟如果错过了学习鸣唱的特定时期,成年之后可能出现鸣唱障碍,成年雄鸟仍需听觉反馈维持其结晶化鸣唱。所以,鸣禽作为研究感觉与运动信息整合的模型,其鸣唱行为的学习过程和神经控制机制与人类具有相似性[3],研究鸣禽发声控制中枢可塑性对于揭示人类语言学习的神经机制具有重要意义。
斑胸草雀(Taeniopygia guttata)作为模式动物,被广泛用于习得发声行为的研究,其鸣唱系统是由脑中一系列不同水平、界限清楚且离散分布的特定核团构成的神经通路[4]。发声运动通路(Vocal Motor Pathway,VMP)由端脑的高级发声中枢(High Vocal Control Center,HVC)投射神经纤维下行经过古纹状体栎核(Robustus Archistriatalis,RA)最后投射到延髓,通过低位运动中枢舌下神经核鸣管支nXIIts核团支配鸣肌从而控制发声。发声学习通路(Anterior Forebrain Pathway,AFP)是从HVC投射神经纤维经过前脑X区(Area X)、丘脑背外侧核内侧部DLM(Medial portion of the dorsolateral nucleus of the anterior thalamus)、新纹状体前部巨细胞核外侧部(Lateral portion of the Magnocellular nucleus of the Anterior NeostriatumLMAN),最后至RA 形成的环路,主要参与鸣唱可塑性[5-9]。
LMAN核团是AFP通路的最后一个输出核团,很可能与鸣唱的学习和鸣曲可塑性有关[10]。幼年时期损毁LMAN核团会使鸣唱提前稳定(Crystallization),从而阻断鸣唱学习[11]。成年时期损毁LMAN核团短期内几乎不影响其鸣曲结构,但在致聋前损毁LMAN核团,可以有效阻止鸣唱的退化[12]。然而在成年致聋斑胸草雀的鸣唱退化过程中,致聋对LMAN的影响和LMAN核团的工作机制仍不完全清楚。因此,本实验旨在通过对成年雄性斑胸草雀进行听觉剥夺,检测鸣禽鸣唱行为以及脑内LMAN核团的变化,探究LMAN核团在鸣禽发声系统中的作用。
1 材料与方法
1.1 材料
1.1.1 实验动物
选择8只鸣唱较好的成年雄性斑胸草雀(>90 PHD)为实验动物,4只为对照组,4只为致聋组。实验动物的使用符合国家和学校动物伦理委员会规定并遵守国际惯例。整个实验过程中,所有的实验动物养育在同一环境,并保持致聋组手术后14 d内连续录音。
0.96%戊巴比妥钠,20%氨基甲酸乙酯,4%多聚甲醛(PFA),NaCl,0.2 mol/L 磷酸缓冲液(PB,pH 7.4),无水乙醇,二甲苯,0.1%焦油紫染液,Enpon812中性树胶等均购自北京化学试剂公司。
1.1.3 仪器
电子天平,Sartorius AL104;低温恒冷切片机,Leica CM1850;体视镜及冷光源,北京市科仪电光仪器厂XTT-AB;录音声卡,Focusrite Scarlett 2i4;恒流泵,保定兰格恒流原有限公司,BT50-1J;光学显微镜及摄像系统,Olympus CX31;倒置荧光显微镜,Zeiss ObserverZ1。
1.2 方法
1.2.1 听觉剥夺手术
实验动物断水断食1 h后,胸大肌注射戊巴比妥钠(0.5 g/kg)进行麻醉,剥离双侧耳蜗致聋,在显微镜下观察剥离的双侧耳蜗是否完整。对照组进行假手术,采用与致聋组相同的麻醉过程,也将表面皮肤剪开,但不将鼓膜捅破,也不将耳蜗拔除,进行假手术的目的是为了避免手术本身对实验结果的影响。术后确保手术鸟处在清洁和温暖的环境中,供给足够的食物和清水,对照组与致聋组手术后在同一环境连续养育14 d。
1.2.2 灌流与切片
致聋组与对照组手术后在同一环境连续养育14 d后,胸大肌注射氨基甲酸乙酯(2.5 g/kg)进行麻醉,使用恒流泵以22 rpm流速向左心室中泵入4%多聚甲醛溶液固定5 min,随后剪下头部,剥离全脑并将其置于4%多聚甲醛溶液中固定6 h,再转移到30%蔗糖溶液中4 ℃过夜至脑沉底。利用低温恒冷切片机冠状切片,片厚为10 μm,平行取6套(平行切取6片后舍弃6片,再平行切取6片),-20 ℃保存。
1.2.3 焦油紫染色
设计意图:通过讨论与交流,学生逐渐形成基于事实证据,分析生物规律,理解生命本质的科学思维。教师充分利用实验资料,在学生原有认知上挖掘深层知识,初步渗透科学探究的方法教育。
上述切片在0.1%焦油紫染液中孵育7 min后,在70%乙醇中浸泡3 min。接着用95%乙醇浸泡两次,每次1 min。然后用100%乙醇浸泡三次,每次1 min。最后用二甲苯处理两次,每次5 min,中性树胶封片。
1.2.4 NeuN免疫组织化学标记
将1.2.2节得到的切片在0.01 mol/L PBS漂洗3次,每次5 min。然后在3%正常羊血清(0.5%TritonX-100/PBS 稀释,ZLI-9021,Jackson)室温封闭30 min;最后用一抗小鼠抗NeuN 抗体(1∶400,MAB377,Millipore),4 ℃孵育过夜。次日将切片在室温中再孵育2 h;用0.01 mol/L PBS 漂洗3 次,每次5 min;然后用二抗Alexa fluor 488标记的山羊抗小鼠IgG抗体(1∶200,A11005,Invitrogen)在室温孵育2 h;最后用0.01 mol/L PBS漂洗5次,每次5 min;用抗荧光淬灭封片剂封片。
1.2.5 声谱分析
雄性斑胸草雀的鸣曲由重复出现的短语组成,每个短语包含多个按照一定顺序排列的音节。使用Sound Analysis Pro(SAP 2011)软件录制和分析斑胸草雀的鸣曲。手术前后,选取鸣曲中同一个短语作为检测对象,每只动物统计处死当天和手术前两天的鸣曲,每天统计30 个该重复短语,分析每个音节平均熵值(Mean Entropy)和熵值变异数(Entopy Variance)等参数。
1.2.6 核团面积和体积分析
采用Olympus显微镜观察经焦油紫染色的雄性斑胸草雀脑切片并采集LMAN核团图像。LMAN核团的边界在4倍物镜下清晰可见,用ImageJ 12.0软件统计核团面积。LMAN 核团体积用切片上LMAN 核团的平均面积与切片数的乘积表示[13],即V = S·N·h,其中,V为LMAN核团的体积(mm3);S为切片上LMAN核团的平均面积(mm2);h为一套切片上相邻脑片间的距离(120 μm);N为一套切片上含有LMAN核团的脑片总数。
1.2.7 核团神经元面密度分析
采用Zeiss 倒置荧光显微镜对经NeuN 免疫组织化学标记的雄性斑胸草雀脑切片进行拼图拍照,采集LMAN核团图像。LMAN核团内神经元在20倍物镜下清晰可见,用Adobe Photoshop软件对核团内神经元进行3个100 μm×100 μm视野的取样统计,获得NeuN免疫组织化学标记下LMAN核团神经元面密度的数据。
1.2.8 统计分析
应用SPSS 12.0(SPSS,Chicago,IL)和Graphpad prism 5.0(Graphpad Software,San Diego,CA)软件进行数据分析。用独立样本t检验分析致聋前后鸣唱音节参数、LMAN核团平均面积和体积以及神经元面密度的差异性。
2 结果与分析
2.1 听觉剥夺引起成年雄性斑胸草雀鸣唱行为的退化
声谱分析结果(见图1)显示,对照组动物手术前后音节结构保持不变(左列),而致聋组动物手术前后短语和音节结构发生显著变化(右列),鸣曲声谱结构发生了显著畸变和短语丢失。
2.2 听觉剥夺前后成年雄性斑胸草雀音节参数的变化
为了检测致聋对鸣唱行为的影响,本研究分析了致聋前后音节平均熵值和熵值变异数的变化,结果见图2。与对照组相比,致聋组手术后14 d 音节平均熵值与基线的百分比显著减小(P <0.05)(对照组为104.39±1.91%,致聋组为94.49±3.14%),熵值变异数与基线的百分比显著减小(P <0.05)(对照组为88.63±3.94%,致聋组为75.03±2.98%)。
2.3 听觉剥夺诱导成年雄性斑胸草雀LMAN核团平均面积和体积的变化

图1 对照组和致聋组实验鸟手术前后鸣曲声谱结构的变化Figure 1 Changes of the sonographic structure of song in control group and deafening group before and after surgery

图2 致聋前后熵值和熵值变异数的定量分析Figure 2 Quantitative analysis of entropy and entropy variance before and after deafness
焦油紫染色结果显示,LMAN核团染色较深,边界清晰,胞体清晰可见,多为梭形、多角形或椭圆形,如图3 所示。图4(A)可以看出,对照组LMAN 核团的平均面积为(0.0681±0.0012)mm2,致聋组LMAN 核团的平均面积为(0.0621±0.0011)mm2,显示致聋组切片上LMAN核团的平均面积有明显减小的趋势(与对照组相比),数据统计有显著性差异(P <0.05)。LMAN核团体积在致聋前后的变化如图4(B)所示,对照组LMAN核团体积为(0.0629±0.0011)mm3,致聋组LMAN核团体积为(0.0549±0.0014)mm3,表明致聋组LMAN核团的体积与对照组相比也存在明显减小的趋势,数据统计有显著性差异(P <0.05)。

图3 听觉剥夺对LMAN核团横截面积的影响Figure 3 Effects of auditory deprivation on the cross-sectional area of the LMAN nucleus
2.4 听觉剥夺诱导成年雄性斑胸草雀LMAN核团神经元面密度的变化

图4 致聋前后LMAN核团平均面积和体积的比较Figure 4 Comparison of the mean area and volume of LMAN nuclei before and after deafness
NeuN免疫组织化学标记结果显示,LMAN核团染色特异性较低,边界不清晰,因此使用Adobe Photoshop软件对LMAN 核团内细胞进行100 μm × 100 μm 3 个视野的取样统计,获得NeuN 免疫组织化学标记下LMAN核团内细胞面密度的数据,可以看到在100 μm×100 μm的取样统计视野中,LMAN核团内细胞的胞体清晰可见,便于统计,如图5所示。应用SPSS 12.0(SPSS,Chicago,IL)和Graphpad prism5.0(Graphpad Software,San Diego,CA)软件对LMAN 核团内细胞面密度进行数据分析,结果(见图6)显示,对照组LMAN 核团内的细胞面密度为(16.24±0.18)个/0.01 mm2,致聋组LMAN 核团内的细胞面密度为(12.18±0.16)个/0.01 mm2,致聋前后LMAN核团内的细胞面密度存在差异。与对照组相比,致聋组LMAN核团内的细胞面密度明显较小,数据统计具有显著性差异(P <0.05)。
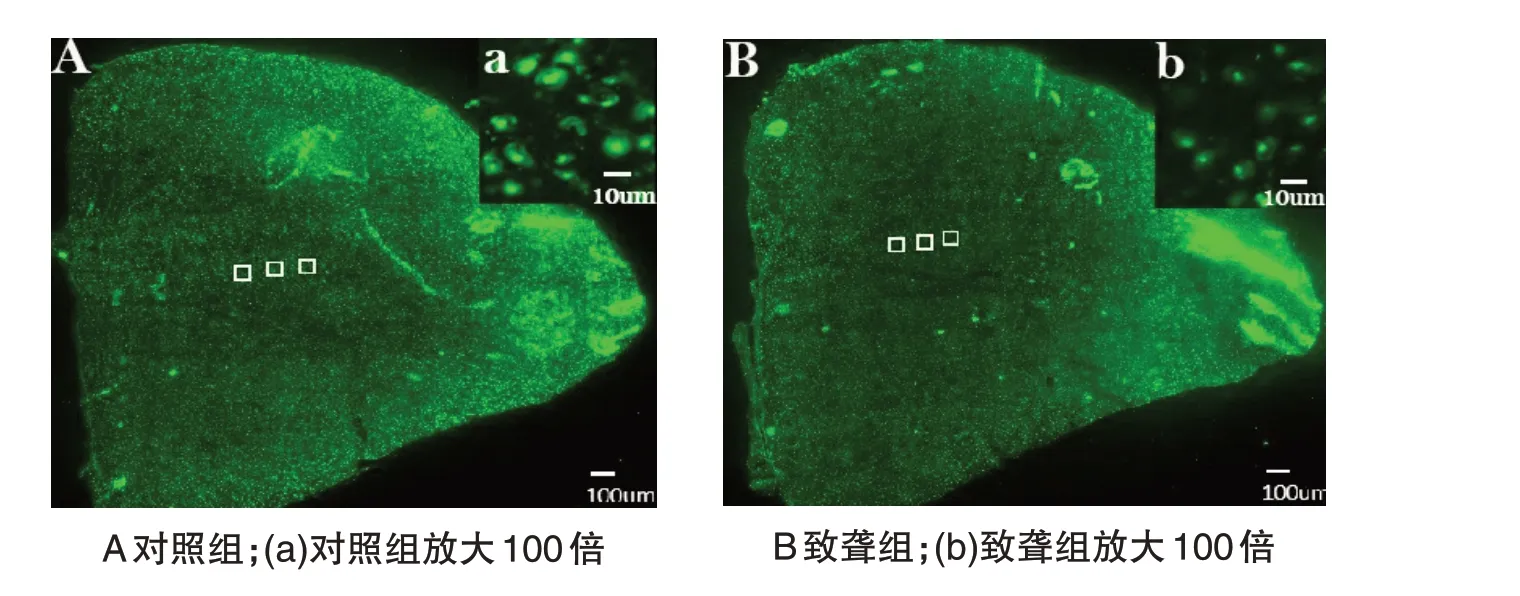
图5 听觉剥夺对LMAN核团内细胞面密度的影响Figure 5 Effects of auditory deprivation on the cellular surface density in LMAN nuclei
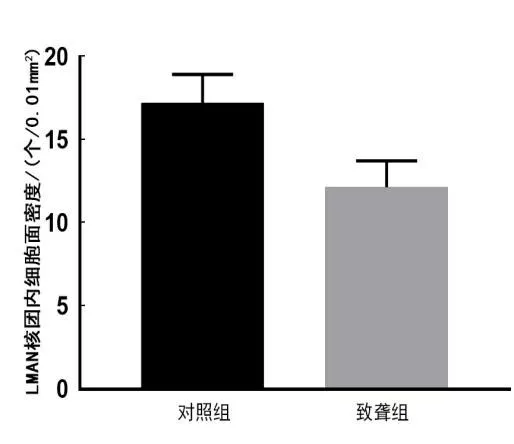
图6 致聋组与对照组LMAN核团内细胞面密度的比较Figure 6 Comparison of cellular surface density before and after deafness in LMAN nuclei
3 讨论
已有学者研究表明,幼年斑胸草雀在受到噪音等异常的听觉干扰时,鸣曲结构(syllable structure)或序列(syllable sequence)会发生明显的变化,但这些变化是可逆的,去除异常噪音反馈后鸣曲的音节结构或音节序列可恢复到正常水平[14],听觉反馈在鸣曲产生和学习过程发挥主要作用。本实验中,成年雄性斑胸草雀在听觉剥夺手术后14 d,鸣唱行为发生了显著的变化,音节参数方面主要表现为熵值和熵值变异数与基线的百分比明显减小。熵是热力学中表征物质状态的参量之一,因此熵值是衡量鸣曲结构混乱程度的重要音节参数。致聋14 d后熵值显著增大[8],说明听觉剥夺能够诱导成年雄性斑胸草雀的鸣曲趋向于更加混乱和不稳定,造成已结晶化的鸣曲结构出现一定程度的退化,表明即使是临界型鸣禽,成年后稳定的鸣曲也仍需要听觉反馈来维持,一旦失去听觉反馈,鸣禽就无法修正和匹配自身鸣曲,进而造成鸣唱行为的退化,导致致聋鸟变成为聋哑鸟,提示听觉反馈在维持鸣曲的复杂性中发挥重要的功能。
鸣禽鸣唱学习的神经基础是脑内的鸣唱控制系统,前人研究认为VMP通路在鸣禽学习过程中对鸣曲的稳定性具有重要作用[6,9]。本实验初步统计与分析致聋14 d后LMAN核团的平均面积和体积有明显减小的趋势,LMAN核团内的细胞面密度下降,说明了致聋导致的成年雄性斑胸草雀鸣唱行为的畸变,可能与致聋所导致其脑内发声学习通路中的输出核团LAMN核团的退化有一定的的关系,这些结果为了解致聋后聋哑变化可能的机理提供一定的基础资料,但其具体机制仍有待进一步研究和探讨。本实验样本量较小,后续实验需要增加动物样本量并进一步测定LMAN核团的超微结构变化以获得LMAN核团形态大小的确切变化。
