氯喹对过氧化氢诱导平滑肌细胞内质网应激途径凋亡的影响
2015-06-28李松岩郭敏王烟于洋刘师兵徐冶
李松岩,郭敏,王烟,于洋,刘师兵,徐冶
氯喹对过氧化氢诱导平滑肌细胞内质网应激途径凋亡的影响
李松岩,郭敏,王烟,于洋,刘师兵,徐冶
目的探讨氯喹对过氧化氢诱导平滑肌细胞(SMC)内质网应激途径凋亡的影响。方法体外培养主动脉SMC细胞,分别加入100、400和800μmol/L H2O2培养12h后,MTT法检测SMC细胞生存率。将细胞分为对照组、H2O2组、氯喹组、H2O2+氯喹组,培养12h后采用MTT法检测氯喹阻断自噬后SMC细胞的生存率,倒置相差显微镜观察H2O2对SMC细胞形态变化的影响,间接免疫荧光法检测自噬相关蛋白LC3和p62的表达,Western blotting检测Beclin-1、LC3、GRP78、CHOP、Caspase-3及Cleaved Caspase-3蛋白的表达。结果MTT检测结果显示,100、400、800μmol/L H2O2作用12h后,SMC细胞存活率明显降低,IC50为447.4μmol/L;氯喹阻断自噬后,SMC细胞存活率明显降低(P<0.05)。倒置相差显微镜观察结果显示,H2O2+氯喹组SMC收缩变圆,细胞密度明显下降。激光共聚焦显微镜观察显示,H2O2与氯喹联合作后,SMC细胞质中LC3和p62蛋白表达均明显增加,且有明显共定位现象。Western blotting检测结果表明,H2O2与氯喹联合作用后,SMC中内质网应激相关蛋白GRP78、CHOP和自噬相关蛋白Beclin-1、LC3Ⅱ/LC3Ⅰ的表达明显增加(P<0.05,P<0.01),凋亡执行分子Caspase-3的裂解形式蛋白表达水平明显升高(P<0.01)。结论氯喹对过氧化氢诱导SMC通过内质网应激途径的凋亡具有促进作用。
自噬;肌细胞,平滑肌;细胞凋亡;氯喹;过氧化氢
目前心血管疾病的发病率及死亡率居世界首位,其中动脉粥样硬化性心脏病每年致死人数超过1900万,而急性冠脉综合征(acute coronary syndromes,ACS)是其中导致死亡率最高的疾病之一[1-2]。ACS是由于斑块不稳定及血栓形成导致心肌缺血的临床综合征[3],因此稳定斑块可有效预防ACS的发生。研究证实,不稳定斑块的破裂及血栓形成可能与血管平滑肌细胞(VSMC)的大量凋亡有密切关系[4]。冯健等[5]研究发现,齐墩果酸可激活细胞内磷脂酰肌醇-3激酶/Akt信号通路,抑制过氧化氢(H2O2)诱导SMC细胞凋亡。邵丽娟等[6]发现,普罗布考可以通过降低细胞中凋亡信号调节激酶(ASK-1)蛋白、增加硫氧还蛋白(Trx-1)的表达来抑制H2O2诱导的平滑肌细胞(SMC)凋亡。郭峰等[7]发现,迷迭香酸可以升高细胞中Bcl-2/Bax蛋白比值,减少Fas、FasL蛋白表达,从而抑制H2O2诱导的SMC凋亡。由此可见,SMC可能是心血管疾病药物治疗的靶细胞之一。因此,加深对H2O2诱导SMC细胞凋亡的了解,才能有效避免不稳定斑块的破裂及血栓形成。
内质网是真核细胞中新生蛋白质折叠、组装和转运以及储存细胞内钙离子的场所,新生的蛋白质在分子伴侣的协助下进行折叠,只有正确折叠的蛋白质才可以被转运至高尔基体,未折叠或错误折叠的蛋白质仍留在内质网内,通过内质网相关降解机制逆移至细胞质,并被蛋白酶体降解[8]。葡萄糖和能量的缺乏、病毒感染、钙离子缺乏及胆固醇聚集等都可能干扰内质网功能,导致内质网应激(endoplasmic reticulum stress,ERS),早期或轻微的ERS可通过一系列的反应使机体恢复稳态,避免细胞凋亡,而过于严重或时间较长的ERS则会导致细胞凋亡[9]。近年来,心血管疾病中ERS诱导的细胞凋亡成为研究的重点[10]。本研究观察了自噬阻断剂氯喹(CQ)对过氧化氢诱导SMC细胞内质网应激及凋亡的影响,旨在为治疗ACS找到新的切入点。
1 材料与方法
1.1 材料 β-actin抗体、Beclin-1抗体、CHOP抗体、GRP78抗体、Caspase-3抗体和Activated-Caspase-3抗体均购自美国Santa Cruz公司;新生胎牛血清、DMEM培养基购自Gibco公司;HRP标记山羊抗小鼠IgG抗体、HRP标记山羊抗兔IgG抗体购自长春德尔塔公司;LC3兔多克隆抗体购自美国Epotomics公司;PVDF膜购自Milipore公司;甘氨酸、甲叉双丙烯酰胺、Hoechst33342荧光染料等购自北京鼎国公司;氯喹、四甲基偶氮唑蓝[3-(4,5-dimethy-2-thiazoly)-2,5-diphenyl-2-tetrazoliumbromide,MTT]购自美国Sigma公司。
1.2 实验仪器 恒温二氧化碳细胞培养箱(日本SANYO公司),电子分析天平(瑞士梅特勒托利多公司),超净工作台(北京东联哈尔公司),高速台式冷冻离心机(德国Hermle公司),倒置光学显微镜(日本Leica公司),水浴锅(上海精宏实验设备有限公司),脱色摇床(北京六一医学仪器厂),超声细胞粉碎仪(宁波新芝生物科技有限公司),高温高压蒸汽灭菌锅(上海博讯实业有限公司),数码凝胶成像系统(上海天能科技有限公司),Model-680型酶标仪、蛋白电泳仪、蛋白转印仪(美国Bio-Rad公司)。
1.3 细胞培养 主动脉SMC细胞株购自中科院上海细胞库,冻存保存。细胞加入含20%新生胎牛血清的DMEM培养液,青霉素和链霉素浓度均为100U/ml,在37℃、5%CO2、饱和湿度培养箱中培养。用0.25%胰蛋白酶消化传代。隔2d传代1次。取生长状态良好且处于对数生长期的细胞进行实验。
1.4 MTT法检测SMC的细胞存活率 取对数生长期SMC,以5×104/ml密度接种于96孔板,培养12h。实验组按H2O2浓度分为100、400、800μmol/L组,同时设单加培养液的空白对照组和不加药物作用的阴性对照组,每组设3~5个复孔。培养12h后,每孔加入MTT 20μl,作用4h,吸弃培养液,每孔加入DMSO 150μl,震荡10min,用Model-680型酶标仪(美国Bio-Rad公司)在490nm波长处测定光密度(A)值,重复测量3次,取平均值。细胞存活率= (A实验组-A空白组)/(A对照组-A空白组)×100%。
1.5 CQ阻断后SMC细胞的存活率 采用MTT法进行检测。取对数生长期SMC,以5×104/ml密度接种于96孔板,培养12h。将细胞分为对照组、20μmol/L CQ组、400μmol/L H2O2组、400μmol/L H2O2+20μmol/L CQ组,同时设单加培养液的空白对照组和不加药物作用的阴性对照组,每组设3~5个复孔。培养12h后,每孔加入MTT 20μl,作用4h,吸去培养液,每孔加入DMSO 150μl,震荡10min,用Model-680型酶标仪(美国Bio-Rad公司) 在490nm波长处测定A值,重复测量3次,取平均值。细胞存活率=(A实验组-A空白组)/(A对照组-A空白组)× 100%。
1.6 光镜下观察细胞形态 取对数生长期细胞,以1×108/L密度接种于24孔板中,每孔500μl,置于37℃、5%CO2培养箱中培养过夜。待细胞生长至80%融合时,分为20μmol/L CQ组、400μmol/L H2O2组、20μmol/L CQ+400μmol/L H2O2组,同时设置未加CQ和H2O2的阴性对照组。将各组细胞置于倒置相差显微镜下观察细胞收缩、细胞密度情况。
1.7 间接免疫荧光法检测蛋白表达 取高压消毒后无菌盖玻片(10mm×10mm)置于24孔板中,将SMC细胞以1×105/ml密度接种(每孔500μl)过夜,次日细胞生长至80%融合时将其分为对照组、20μmol/L CQ组、400μmol/L H2O2组、20μmol/L CQ+400μmol/L H2O2组,培养8h后弃培养基,加入200μl 4%多聚甲醛固定液作用10min,吸去固定液,经0.1% Triton PBS作用5min,0.01mol/L PBS洗涤,非免疫山羊血清封闭30min,加入预混的LC3抗体(1:250)、p62抗体(1:200)4℃过夜,0.01mol/L PBS洗涤,加入1:1000稀释的荧光二抗作用30min,0.01mol/L PBS洗涤,抗荧光淬灭剂封固。应用激光共聚焦显微镜观察。
1.8 Western blotting检测蛋白表达 取生长状态良好且呈对数生长的SMC,分为对照组、CQ组、H2O2组、CQ+H2O2组,加入药物作用相应时间后,弃培养液,胰酶消化,离心收集细胞,每瓶加入150μl蛋白裂解液RIPA,混匀,采用超声细胞粉碎仪破碎细胞2次,每次3~5s,4℃放置30min,蛋白裂解液充分裂解细胞后,高速台式冷冻离心机离心收集上清液。Bradford法行蛋白定量。SDSPAGE电泳结束后,将蛋白转移到PVDF膜上,5%脱脂奶粉封闭1.5h,PBST洗3次,加入1% BSA稀释的Beclin-1抗体(1:1000)、LC3抗体(1:500)、GRP78抗体(1:500)、CHOP抗体(1:1000)、Caspase-3抗体(1:500)、Activated-Caspase-3抗体(1:1000)、β-actin抗体(1:1000),4℃过夜。次日PBST洗3次,加入1:1000稀释的HRP标记二抗,室温摇床孵育1.5h;PBST洗5次,ECL显色。以β-actin作为内参照,结果采用Quantity One软件进行分析处理。
1.9 统计学处理 采用SPSS 11.5软件进行统计分析。所有数据均以表示,实验均重复3次,多组间比较采用单因素方差分析或重复测量方差分析,进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 MTT法检测SMC细胞存活率 采用不同浓度H2O2作用主动脉SMC细胞12h后,MTT检测结果显示,H2O2对SMC细胞的生长抑制作用呈现剂量依赖性(图1),其IC50为447.4μmol/L。
2.2 CQ对SMC细胞存活率的影响 主动脉SMC细胞经400μmol/L H2O2作用8h后,MTT检测结果显示,采用20μmol/L CQ阻断自噬后,SMC细胞存活率明显降低(图2)。
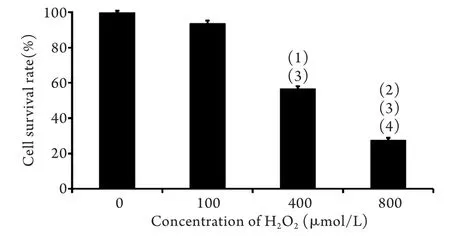
图1 MTT法检测SMC细胞生存率Fig.1 Survival rate of SMCs (MTT)(1)P<0.05,(2)P<0.01 compared with 0μmol/L H2O2; (3)P<0.01 compared with 100μmol/L H2O2; (4)P<0.01 compared with 400μmol/L H2O2
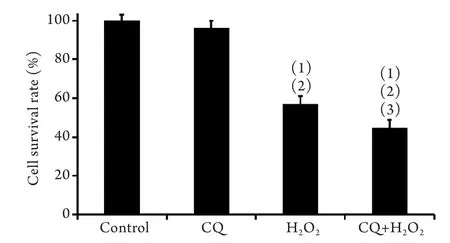
图2 MTT法检测CQ对SMC细胞生存率的影响Fig.2 Survival rate of SMCs (MTT)(1)P<0.05 compared with control group; (2)P<0.01 compared with CQ group,(3)P<0.05 compared with H2O2group
2.3 倒置显微镜观察SMC细胞的生长 采用400μmol/L H2O2作用SMC细胞8h后,倒置显微镜观察显示,与单独H2O2组相比,CQ+H2O2组细胞收缩变圆,细胞密度明显下降(图3)。
2.4 间接免疫荧光法检测自噬标志蛋白P62和LC3的共定位 激光共聚焦显微镜观察结果显示,与阴性对照组相比,20μmol/L CQ作用SMC 8h后可见LC3(FITC标记)与P62(Rodamini标记)蛋白散在分布;400μmol/L H2O2作用SMC 8h后可见LC3(FITC标记)与P62(Rodamini标记)蛋白均呈散在分布,且荧光强度增加的同时呈现点状聚集;CQ+H2O2组可见荧光强度明显增强且有明显共定位(图4)。
2.5 Western blotting检测相关蛋白的表达 Western blotting检测结果显示,与阴性对照组相比,400μmol/L H2O2作用SMC细胞8h后,Beclin-1、LC3Ⅱ/Ⅰ、GRP78、CHOP蛋白表达明显增高(P<0.05或P<0.01),CQ与H2O2联合应用组Beclin-1、LC3Ⅱ/Ⅰ、GRP78、CHOP蛋白表达明显增强,且Caspase-3活化剪切片段表达明显增高(P<0.05或P<0.01,图5)。

图3 光镜观察CQ阻断自噬后H2O2对SMC细胞生长抑制的影响Fig.3 H2O2-induced growth inhibition of SMCs after interrupting autophagy by CQ (×250) A. Control; B. 20μmol/L CQ for 8h; C. 400μmol/L H2O2for 8h; D. 20μmol/L CQ and 400μmol/L H2O2for 8h
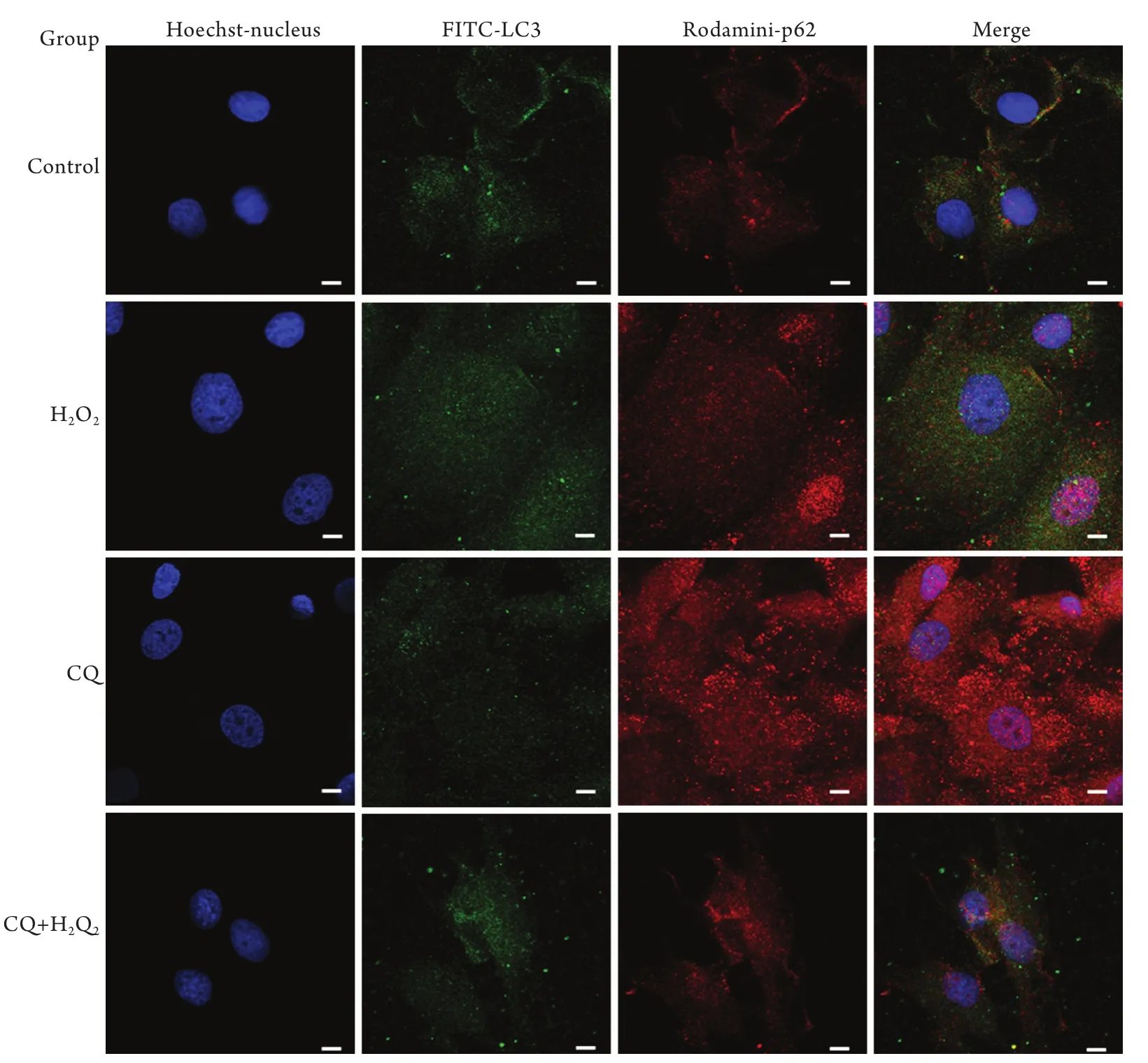
图4 共聚焦显微镜观察CQ对H2O2诱导SMC细胞LC3和p62蛋白共定位的影响(LSC显微镜×1800)Fig.4 Effect of CQ on H2O2-induced p62 and LC3 protein co-localization in SMCs (LSC microscopy ×1800)
3 讨 论
本研究结果表明,H2O2作用后SMC细胞存活率明显下降,细胞收缩变圆,细胞密度下降,CQ 与H2O2联合作用后,SMC细胞存活率进一步降低。
细胞凋亡也称为细胞程序性死亡,诱导凋亡的途径包括死亡受体途径和线粒体途径,目前,内质网应激(endoplasmic reticulum stress,ERS)引起的细胞凋亡逐渐被认识。研究证实,ERS在许多系统疾病如神经变性疾病、糖尿病、肾脏疾病及肿瘤的生长转移中扮演了重要的角色[11-13]。近年来,ERS在心血管疾病中诱导细胞凋亡成为了研究的重点。Kim等[14]报道,在心力衰竭、心肌缺血、心肌肥厚及动脉粥样硬化发生中都有ERS的参与。Lim 等[15]报道,ERS与A型清道夫受体共同作用促进巨噬细胞的凋亡和动脉粥样硬化斑块的形成。Werstuck等[16]研究发现,在培养的主动脉内皮细胞及SMC,同型半胱氨酸诱导的ERS中,与胆固醇和甘油三酯生物合成和摄取的相关基因表达增加,导致细胞内胆固醇聚集。
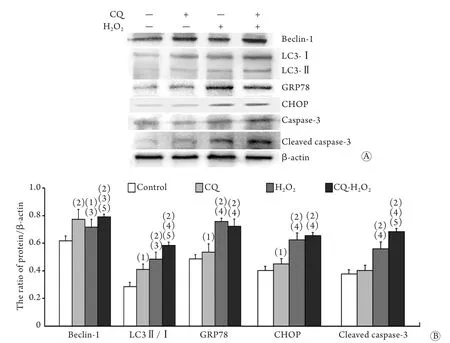
图5 Western blotting法检测CQ与H2O2作用后SMC中相关蛋白的表达(±s,n=3)Fig.5 Effects of CQ and H2O2on the protein expressions in SMCs (Western blotting,±s,n=3)A. Western blotting; B. The relative value; (1)P<0.05,(2)P<0.01 compared with control group; (3)P<0.05,(4)P<0.01 compared with CQ group; (5)P<0.05 compared with CQ+H2O2group
血管平滑肌自噬可抑制血管平滑肌的增殖,在延缓动脉硬化病情的发展中发挥重要作用[15]。本课题组前期实验证实,H2O2可以诱导SMC自噬,并可诱导SMC通过ESR途径发生凋亡。H2O2可以引起SMC氧化应激的发生,而氧化应激可通过不同的信号通路诱导凋亡和自噬的发生[16]。自噬是哺乳动物中高度保守的清除、降解和回收利用细胞内生物大分子及受损细胞器的重要代谢通路,对维持细胞稳态有重要作用[17]。本研究通过共聚焦显微镜观察到,与对照组相比,CQ组、H2O2组、CQ+H2O2组LC3和P62蛋白荧光强度明显增强,并且CQ+H2O2组LC3和P62蛋白有明显共定位现象。而Western blotting结果表明,与对照组相比,H2O2组SMC细胞Beclin-1和LC3Ⅱ蛋白表达增强,表明SMC中自噬被活化。GRP78是内质网应激反应中的重要调节蛋白,其表达水平反映内质网应激的强弱[18]。与对照组相比,GRP78蛋白表达增强,说明SMC中存在ESR。当ESR变得更加严重时,将促进细胞凋亡的发生,这一转化的决定性因子是CHOP[19]。当细胞受到刺激产生ESR时,内质网外膜上的procaspase-12发生剪切,使之活化为caspase-12并释放入细胞质,caspase-12激活caspase-9,活化的caspase-9裂解caspase-3致使细胞凋亡。Western blotting结果显示,CQ+H2O2组CHOP蛋白与cleaved caspase-3蛋白表达最强,表明CQ可能通过阻断自噬,导致细胞ESR增强,从而使SMC凋亡。
综上所述,H2O2能诱导SMC自噬和ESR的产生,CQ阻断自噬后,使ESR增强,从而导致细胞凋亡。血管平滑肌的凋亡可导致AS斑块帽的破裂,促进AS进程,而自噬可以抑制AS斑块的发展[20]。但是,是否可以通过控制自噬的发生和发展来控制AS斑块的发展,最终达到治疗动脉硬化的目的,还需进一步研究证实。
[1]Xu YL. Atheoscleorsis - A chronic inflammatory process[J]. China J Arterioscler,2001,9(2): 93-95.[徐也鲁. 动脉粥样硬化——一种慢性炎症过程[J]. 中国动脉硬化杂志,2001,9(2): 93-95.]
[2]Yang CB,Sun ZJ,Qiu HJ. Clinical analysis of the diagnosis and treatment acute coronary syndrome in 200 oases[J]. J Logist Univ PAPF (Med Sci),2014,23(3): 224-226. [杨朝斌,孙中吉,仇海军. 急性冠脉综合征急诊救治200例临床分析[J]. 武警后勤学院学报(医学版),2014,23(3): 224-226.]
[3]He F,Yin YH,Li ZF,et al. Comparison of clinical features between male and female patients with acute coronary syndrome:a retrospective report of 480 cases[J]. Med J Chin PLA,2014,39(6): 489-493. [何菲,殷跃辉,李芝峰,等. 不同性别急性冠脉综合征患者的临床特征分析:480例回顾性研究[J]. 解放军医学杂志,2014,39(6): 489-493.]
[4]Wei DH,Jia XY,Liu YH,et al. Cathepsin L stimulates autophagy and inhibits apoptosis of ox-LDL-induced endothelial cells: potential role in atherosclerosis[J]. Int J Mol Med,2013,31(2): 400-406.
[5]Feng J,He GX. Effect of oleanolic acid on hydrogen peroxide induced apoptosis of vascular smooth muscle cells[J]. Chin J Geriatr Heart Brain Vessel Dis,2012,17(1): 66-68.[冯健,何国祥. 齐墩果酸对过氧化氢诱导血管平滑肌凋亡的影响[J].中华老年心脑血管病杂志,2012,17(1): 66-68.]
[6]Shao LJ,Sheng L,Hu YJ,et al. Inhibition of probucol on the apoptosis of vascular smooth muscle cell induced by hydrogen peroxide[J]. Chin Pharmacol Bull,2009,25(7): 935-938.[邵丽娟,盛林,胡雅洁,等. 普罗布考抑制过氧化氢诱导血管平滑肌细胞的凋亡[J]. 中国药理学通报,2009,25(7): 935-938.]
[7]Guo F,Zhu BY. Inhibition of rosmarinicacid on the apoptosis of vascular smooth muscle cells induced by hydrogen peroxide[J]. Chin Pharmacol Bull,2007,23(3): 365-370.[郭峰,朱炳阳. 迷迭香酸抗过氧化氢诱导血管平滑肌细胞凋亡作用的研究[J]. 中国药理学通报,2007,23(3): 365-370.]
[8]Kijanska M,Peter M. Atg1 kinase regulates early and late steps during autophagy[J]. Autophagy,2013,9(2): 249-251.
[9]Takahashi Y,Meyerkord CL,Hori T,et al. Bif-1 regulates Atg9 trafficking by mediating the fission of Golgi membranes during autophagy[J]. Autophagy,2011,7(1): 61-73.
[10] Jaber N,Zong WX. Class Ⅲ PI3K Vps34: essential roles inautophagy,endocytosis,andheart and liver function[J]. Ann N Y Acad Sci,2013,1280: 48-51.
[11] Shaid S,Brandts CH,Serve H,et al. Ubiquitination and selective autophagy[J]. Cell Death Differ,2013,20(1): 21-30.
[12] Wang YD,Hong Q,Lu Y,et al. Role of endoplasmic reticulum stress-induced apoptosis of renal tubular epithelial cells in rhabdomyolysis-associated acute kidney injury[J]. Med J Chin PLA,2015,40(3): 194-199. [王远大,洪权,吕杨,等. 内质网应激途径诱导肾小管上皮细胞凋亡在横纹肌溶解肾损伤过程中的作用[J]. 解放军医学杂志,2015,40(3): 194-199.]
[13] Yang Z,Klionsky DJ. Eaten alive: a history of macroautophagy[J]. Nature Cell Biol,2010,12(9): 814-822.
[14] Kim AJ,Shi Y,Austin RC,et al. Valproate protects cells from ER stress-induced lipid accumulation and apoptosis by inhibiting glycogen synthase kinase-3[J]. J Cell Sci,2005,118(Pt 1): 89-99.
[15] Lim WS,Timmins JM,Seimon TA,et al. Signal transducer and activator of transcription-1 is critical for apoptosis in macrophages subjected to endoplasmic reticulum stressin vitroand in advanced atherosclerotic lesionsin vivo[J]. Circulation,2008,19(117): 940-951.
[16] Werstuck GH,Lentz SR,Dayal S,et al. Homocysteine-induced endoplasmic reticulum stress causes dysregulation of the cholesterol and triglyceride biosynthetic pathways[J]. J Clin Invest,2001,107(10): 1263-1273.
[17] Zhang PP. The effects of autophagy on proliferation of vascular smooth muscle cells[D]. Zhengzhou University,2011.[张佩佩.自噬对血管平滑肌细胞增殖的影响[D]. 郑州大学,2011.]
[18] Jin S,White E. Role of autophagy in cancer: management of metabolic stress[J]. Autophagy,2007,3(1): 28-31.
[19] Bjørkøy G,Lamark T,Pankiv S,et al. Monitoring autophagic degradation of p62/SQSTM1[J]. Methods Enzymol,2009,452: 181-197.
[20] Razani B,Feng C,Coleman T,et al. Autophagy links inflammasomes to atherosclerotic progression[J]. Cell Metab,2012,15(4): 534-544.
Effect of chloroquine on hydrogen peroxide-induced apoptosis of smooth muscle cellsviaendoplasmic reticulum stress pathway
LI Song-yan1,GUO Min2,WANG Yan1,YU Yang1,LIU Shi-bing1,XU Ye1*1Medical Research Laboratory,Jilin Medical College,Jilin,Jilin Province 132013,China
2Department of Vasculocardiology,Affiliated Hospital of Jilin Medical College,Jilin,Jilin Province 132013,China
*< class="emphasis_italic">Corresponding author,E-mail: xuye_9707@163.com
,E-mail: xuye_9707@163.com
This work was supported by the Youth Scientific Research Project of Health Department of Jilin Province (2013Q015),and the "Twelfth Five-Year Plan" Science and Technology Research Projects of Education Department of Jilin Province (2013316)
ObjectiveTo investigate the effect of chloroquine (CQ) on hydrogen peroxide-induced apoptosis of smooth muscle cells (SMCs)viaendoplasmic reticulum (ER) stress pathway.MethodsThe SMCs were culturedin vitro. They were incubated respectively with 100,400 and 800μmol/L of H2O2for 12h. Cell survival rate was determined with MTT assay. To observe the time course of autophagy induced by cisplatin treatment,four experimental groups were set up,namely control group,H2O2group,CQ group and H2O2+CQ group. Cell survival rate after autophagy interruption was determined by MTT assay. Inverted phase contrast microscopy was used to observe the effects of H2O2on morphological changes in SMCs'. The expressions of autophagy related protein p62 and LC3 were detected by indirect immunofluorescence. The expressions of beclin-1,LC3,GRP78,CHOP,caspase-3 and cleaved caspase-3 were assayed by Western blotting.ResultsAfter treatment with 100-800μmol/L of H2O2for 12h,the proliferation of SMCs was markedly inhibited,the IC50value was 447.4μmol/L. The survival rate of SMCs was lowered obviously after autophagy interruption by CQ (P<0.05). It was found by inverted microscopy that the SMCs in H2O2+CQ group shrank and became rounded,and the cell density decreased significantly. It was found by laser scanning confocal microscopy that the expressions increased obviously of LC3 and p62 proteins in SMCs of H2O2+CQ group,and an obvious phenomenon of co-localization was observed. Western blotting demonstrated that the expressions of both ERs related proteins GRP78,CHOP and autophagy related proteins Beclin-1,LC3Ⅱ/LC3 I increased obviously (P<0.05,P<0.01) in H2O2+CQ group,and the expression of lytic form apoptotic molecule of caspase-3 protein was significantly increased (P<0.01).ConclusionChloroquine could induce apoptosis of smoothcellsviaER stress pathway induced by hydrogen peroxide.
autophagy; myocytes,smooth muscle; apoptosis; chloroquine; hydrogen peroxide
R361.3;R285.5
A
0577-7402(2015)12-0960-06
10.11855/j.issn.0577-7402.2015.12.05
2015-05-19;
2015-08-12)
(责任编辑:张小利)
吉林省卫生青年科研课题(2013Q015);吉林省教育厅“十二五”科学技术研究课题(2013361)
李松岩,助理实验师,硕士研究生。主要从事兽医学的预防工作
132013 吉林省吉林市 吉林医药学院医学科研实验室(李松岩、王烟、于洋、刘师兵、徐冶);132013 吉林省吉林市吉林医药学院附属医院心血管内科(郭敏)
徐冶,E-mail:xuye_9707@163.com
