乌司他丁对脓毒症晚期大鼠Treg和Th17细胞的调节作用
2015-06-28聂文龙王晓丹张玉想
聂文龙,王晓丹,张玉想
乌司他丁对脓毒症晚期大鼠Treg和Th17细胞的调节作用
聂文龙,王晓丹,张玉想
目的观察乌司他丁对晚期脓毒症大鼠脾脏CD4+CD25+调节性T细胞(Treg)和辅助性T细胞17(Th17)以及Treg/Th17比值的影响,探讨乌司他丁注射液的免疫调理作用。方法24只Wistar大鼠随机分为假手术组(Sham组)、生理盐水治疗组(NS组)和乌司他丁治疗组(UTI组),每组8只;采用盲肠结扎穿孔(CLP)法建立脓毒症模型。于术后24h摘取大鼠脾脏,采用流式细胞术检测脾脏Th17和CD4+CD25+Treg细胞比例,计算Treg/Th17比值,RT-PCR检测脾脏中叉头状转录因子3(Foxp3)、维甲酸相关性孤核受体γt(RORγt)mRNA的表达水平,观察乌司他丁注射液的干预效果。结果NS组CD4+CD25+Treg、Th17细胞比例明显高于Sham组(P<0.01),而UTI组CD4+CD25+Treg、Th17细胞比例明显低于NS组(P<0.01)。Sham组与NS组之间Treg/Th17比值差异无统计学意义(P>0.05),UTI组Treg/Th17比值低于NS组(P<0.01)。NS组Foxp3和RORγt mRNA表达水平明显高于UTI组和Sham组(P<0.01),而后两组间比较差异无统计学意义(P>0.05)。结论脓毒症晚期大鼠同时存在着过度炎症反应和免疫抑制状态。乌司他丁注射液能有效减轻晚期脓毒症大鼠过度的炎症反应和免疫抑制。
脓毒症;T淋巴细胞,辅助诱导;T淋巴细胞,调节性
脓毒症的重要致病机制是机体对病原微生物所作出的不恰当的免疫反应,其发生并非仅仅与病原体及其所分泌的毒素导致的直接损害有关,机体的免疫状态变化也起着至关重要的作用[1]。辅助性T细胞1(Th1)和辅助性T细胞2(Th2)是传统的T淋巴细胞亚群,通过细胞因子产生拮抗作用,调节免疫应答。Th1和Th2的平衡状态直接影响着机体的免疫功能,并与疾病的预后密切相关。近年来发现了另外两类新的辅助性T细胞亚群,即辅助性T细胞17(Th17)和CD4+CD25+调节性T细胞(Treg)[2-3]。Th17和Treg细胞都来源于初始T细胞,两者的功能和分化过程相互联系相互制约,在维持机体免疫平衡方面发挥重要作用,是对Th1/Th2免疫平衡理论的重要补充。Treg细胞可以影响Th1/Th2/Th17细胞的极化,并导致淋巴细胞功能抑制[4],其免疫抑制作用越来越受到重视。Th17细胞分泌的特征性的细胞因子白介素17(IL-17)对保持黏膜的完整性以及黏膜对病原微生物的抵抗力有重要作用[5]。
乌司他丁作为一种从尿液中提取的糖蛋白,对胰蛋白酶、纤溶酶、巯基酶等多种酶具有抑制作用,同时还可调节多种致炎/抗炎细胞因子的表达,如降低肿瘤坏死因子-α(TNF-α)和IL-6的分泌水平[6-7],但对晚期脓毒症中Treg和Th17这两种重要的CD4+T细胞的调节作用研究尚少。本研究采用盲肠结扎穿孔(cecal ligation and puncture,CLP)法复制大鼠脓毒症模型,观察乌司他丁对晚期脓毒症大鼠Treg和Th17细胞的调节作用。
1 材料与方法
1.1 实验动物及分组 雄性清洁级Wistar大鼠24只,体重280~300g(购自军事医学科学院实验动物中心),适应性饲养1~2周,实验前常规禁食12h。随机分为假手术组(Sham组)、生理盐水治疗组(NS 组)、乌司他丁治疗组(UTI组),每组8只,以术后24h为观察时间点。
1.2 主要试剂及仪器 红细胞裂解液、细胞刺激剂、细胞染色缓冲液、细胞破膜固定液、细胞破膜缓冲液、藻红蛋白(PE)标记抗大鼠叉头翼状螺旋转录因子3(Foxp3)单克隆抗体,PE标记大鼠免疫球蛋白G2ak同型对照剂、PE标记抗大鼠白介素-17A(IL-17A)单克隆抗体、别藻蓝蛋白(APC)标记抗大鼠CD25单克隆抗体、异硫氰酸荧光素(FITC)标记抗大鼠CD4单克隆抗体均购自美国eBioscience公司。RNA提取试剂(Trizol)、ND-1000核酸定量检测仪、反转录酶试剂盒、SYBR荧光实时PCR试剂盒购自日本TOYOBO公司。注射用乌司他丁(10万U/支)购自广东天普生化医药股份有限公司(批号H19990134)。
1.3 方法
1.3.1 大鼠脓毒症模型制作及标本制备 采用氯胺酮注射液+速眠新Ⅱ注射液按2:1混合肌内注射麻醉大鼠,CLP法复制脓毒症模型。消毒、铺无菌巾,沿腹正中线开1~2cm切口,找到盲肠后在距离其根部1cm处结扎。以18号穿刺针贯穿2次盲肠,并留置2条宽0.5cm的橡皮片贯通盲肠,防止针孔闭合。缝合腹壁切口,术毕立即皮下注射生理盐水10ml补充术中丢失液体和抗休克。Sham组只暴露盲肠后缝合,并以生理盐水复苏。UTI组在术后0.5、8、16h由腹腔注射乌司他丁注射液(10万U/kg),NS组经腹腔给予等体积生理盐水,时相点与UTI组一致。术后24h处死动物,即刻分离出脾组织。取一半脾脏立即放入液氮中保存,另一半放入PBS中以备流式细胞实验。
1.3.2 流式细胞仪检测Th17细胞 在200目尼龙网上研磨脾脏组织,收集研磨后的细胞,300×g离心5min;加入5ml红细胞裂解液裂解5min,300×g离心5min,弃上清;加入5ml PBS混匀,300×g离心5min,弃上清,加入RPMI 1640培养基重复洗涤细胞,重悬计数,将1×106个细胞在37℃、5%CO2孵箱中培养,加入丙二醇甲醚醋酸酯(PMA)、离子霉素(Ionomysin)以及布雷菲德菌素A(BFA)阻断剂,刺激培养6h;收集每孔刺激好的细胞到流式上样管中,加入2ml细胞染色缓冲液,300×g离心5min,弃上清;将管底细胞重悬于100μl细胞染色缓冲液中,加入细胞表面染色抗体CD4-FITC,混匀后常温避光反应20min;加入2ml细胞染色缓冲液,300×g离心5min,弃上清;加入0.5ml细胞破膜固定液,常温避光放置30min,300×g离心5min,弃上清;加入2ml染色缓冲液,300×g离心5min,弃上清;加入2ml 1×细胞破膜缓冲液,300×g离心5min,弃上清;将试管底部细胞重悬在100μl 1×细胞破膜缓冲液中,加入适量的胞内细胞因子荧光标记抗体IL-17A,混合均匀后,常温避光反应30min;加入2ml 1×破膜缓冲液,300×g离心5min,弃上清;加入0.5ml染色缓冲液重悬细胞,待上机分析检测Th17占淋巴细胞比例。
1.3.3 流式细胞仪检测Treg细胞 直接取计数好的细胞1×106个(约100μl细胞悬液)至流式管底部;加入CD4-FITC/CD25-APC表面荧光标记抗体,混匀后常温避光反应20min;加入2ml细胞染色缓冲液,300×g离心5min,弃上清;加入0.5ml Foxp3固定缓冲液,4℃避光放置20min,300×g离心5min,弃上清;加入2ml细胞染色缓冲液,300×g离心5min,弃上清;加入2ml 1×Foxp3破膜缓冲液,300×g离心5min,弃上清;将试管底部细胞重悬在100μl 1×Foxp3破膜缓冲液中,加入合适量Foxp3 PE抗体,混合均匀后,常温避光反应30min;加入2ml 1×Foxp3破膜缓冲液,300×g离心5min,弃上清;加入0.5ml细胞染色缓冲液重悬细胞后上机分析Treg占淋巴细胞比例。
1.3.4 实时荧光定量PCR(real-time Q-PCR)检测脾脏Foxp3、维甲酸相关性孤核受体γt(RORγt) mRNA表达 无菌分离约100mg脾组织后匀浆,采用Trizol提取脾脏组织总RNA,采用ReverTra Ace qPCR RT Kit进行反转录,操作步骤及方法均参照使用说明书。各目的基因mRNA序列由美国Invitrogen公司合成提供,引物序列见表1。采用SYBR Green Realtime PCR Kit反应试剂盒进行Q-PCR反应,95℃变性15s,60℃退火60s,60℃延伸60s,共40个循环。
1.4 统计学处理 采用SPSS 16.0软件进行统计分析。计量资料以表示,多组间比较采用单因素方差分析(One-way ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
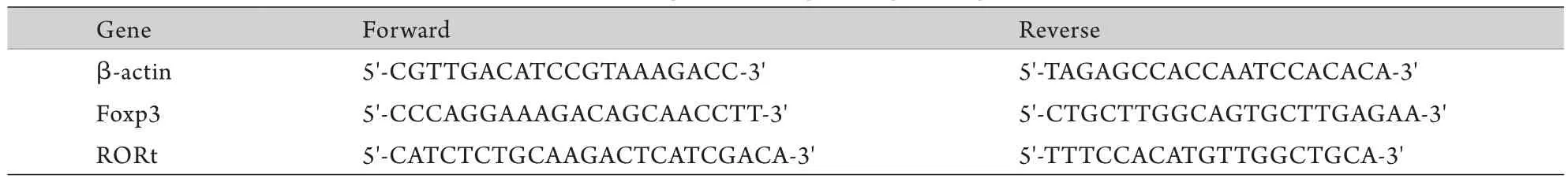
表1 PCR引物序列Tab.1 Sequences of specific primer pairs
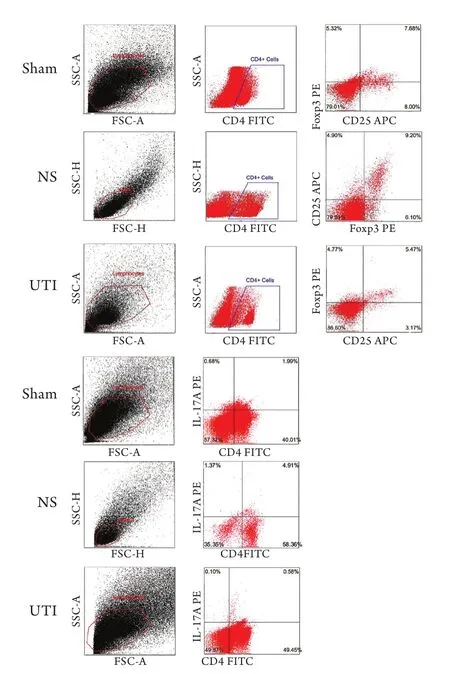
图1 各组脓毒症大鼠脾脏内Treg(A)和Th17(B)细胞流式细胞检测结果Fig.1 Treg (A) and Th17 (B) cells in spleen of sepsis rats (Flow cytometry)
2 结 果
2.1 各组大鼠大体形态观察 Sham组动物苏醒后活动情况如常。NS组大鼠术后苏醒延迟,10h左右出现精神萎靡、竖毛、呼吸急促、鼻孔血性分泌物增多,剖腹可见有浑浊脓血性渗出液,部分盲肠末端发黑坏死,有恶臭味。UTI组大鼠术后表现较NS组轻。
2.2 各组大鼠脾脏中Treg和Th17细胞比例及Treg/ Th17比值比较 与Sham组比较,NS组Treg、Th17细胞占淋巴细胞的比例明显升高(P<0.01),UTI组Treg、Th17细胞占淋巴细胞的比例与NS组比较明显下降(P<0.01)。NS组Treg/Th17比值与Sham组比较无明显差异(P>0.05),UTI组Treg/Th17比值与其他两组比较明显降低(P<0.05,表2,图1)。
表2 CLP术后大鼠脾脏Treg、Th17比例及Treg/Th17比值比较(%,±s,n=8)Tab.2 Expression of Treg, Th17 and Treg/Th17 in spleen of sepsis rats after CLP (%,±s,n=8)
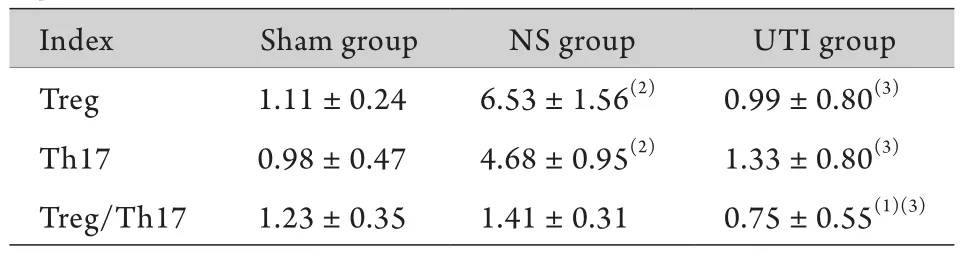
表2 CLP术后大鼠脾脏Treg、Th17比例及Treg/Th17比值比较(%,±s,n=8)Tab.2 Expression of Treg, Th17 and Treg/Th17 in spleen of sepsis rats after CLP (%,±s,n=8)
(1)P<0.05, (2)P<0.01 compared with sham group, (3)P<0.01 compared with NS group
Index Sham group NS group UTI group Treg 1.11±0.24 6.53±1.56(2) 0.99±0.80(3)Th17 0.98±0.47 4.68±0.95(2) 1.33±0.80(3)Treg/Th17 1.23±0.35 1.41±0.31 0.75±0.55(1)(3)
2.3 脾脏Foxp3、RORγt mRNA表达变化及乌司他丁干预的影响 RT-PCR检测结果显示,NS组Foxp3 mRNA表达水平最高(P<0.01),而UTI组Foxp3 mRNA表达与Sham组比较差异无统计学意义(P>0.05)。NS组RORγt mRNA表达明显高于Sham组和UTI组(P<0.01),而后两组比较差异无统计学意义(P>0.05,表3)。
表3 CLP术后大鼠脾脏Foxp3、RORγt mRNA表达水平比较(±s,n=8)Tab.3 Expression of Foxp3 and RORγt mRNA in spleen of sepsis rats after CLP (±s,n=8)
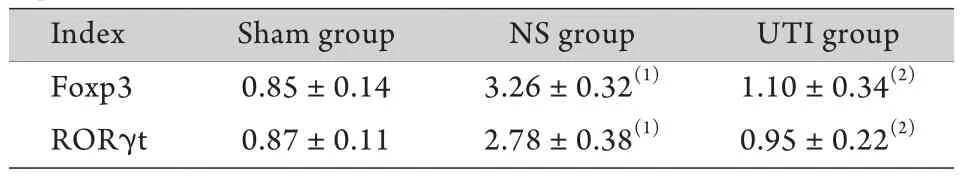
表3 CLP术后大鼠脾脏Foxp3、RORγt mRNA表达水平比较(±s,n=8)Tab.3 Expression of Foxp3 and RORγt mRNA in spleen of sepsis rats after CLP (±s,n=8)
(1)P<0.01 compared with sham group, (2)P<0.01 compared with NS group
Index Sham group NS group UTI group Foxp3 0.85±0.14 3.26±0.32(1) 1.10±0.34(2)RORγt 0.87±0.11 2.78±0.38(1) 0.95±0.22(2)
3 讨 论
脓毒症常继发于各种重度创伤、严重烧伤、大手术,尽管积极的抗生素治疗和充分的液体复苏在一定程度上改善了其预后,但其死亡率仍然在30%左右[8]。在脓毒症早期,感染激活了机体的免疫系统,导致强烈的促炎反应以及随后代偿性的抗炎反应,后期则不可避免地导致免疫功能紊乱。导致脓毒症后期难以控制的感染的病原微生物常常是机会性致病菌,这实际上是机体免疫功能崩溃的反映,仅仅寄希望于单一使用抗生素是难以控制感染的。因此,对脓毒症所导致的免疫紊乱的研究尤为重要。
Th17细胞是以分泌IL-17为特征的T细胞,可分泌多种重要的细胞因子,如IL-17和IL-21[6]。Th17细胞是最早参与抗感染免疫的效应性T细胞,可以有效地招募中性粒细胞并且使其激活而发挥作用[9],在抵御致病细菌感染(尤其是与大量病原体直接接触的肠道、呼吸道黏膜感染)中发挥着重要作用。因此,Th17细胞占淋巴细胞的比例及其功能在很大程度上决定了机体清除病原体的能力。然而随着病情的进展,Th17细胞比例和IL-17分泌水平的增高也可能意味着更为严重的病情和更高的死亡率[10-11]。Treg细胞作为一种具备负向免疫调节能力的CD4+T细胞亚群,其特异性转录因子为Foxp3。Treg细胞的免疫抑制功能也在很大程度上依赖于Foxp3持续的高表达[12]。在脓毒症患者外周血中,Treg细胞的表达情况与APACHEⅡ评分和血乳酸水平呈正相关[10],Treg细胞表达增强能够抑制效应性CD4+和CD8+细胞的活化及增殖,而CD4+和CD8+细胞数量和功能的下降可能意味着不良的预后结果[13]。
近年有研究表明,免疫调节细胞Treg、Th17主要通过接触机制及释放炎症介质分别起到抗炎及促炎作用,其作用互相依赖、互相抑制,维持平衡状态。本实验以24h为实验终点,使大鼠处于低血糖、低胰岛素、低血流动力学循环的状态,同时存在明显的高乳酸分泌,以此复制晚期脓毒症模型[14]。目前的理论认为脓毒症发生后机体立即启动了促炎与抗炎的双重机制,但是在病程的初期以过度的炎症反应为特点,随后免疫抑制又成为更为棘手且具有代表性的问题[1,15]。本研究结果显示,NS组大鼠的Treg细胞和Th17细胞比例均高于Sham组,而Treg/Th17比值在NS组和Sham组无明显差异,说明处于脓毒症晚期的实验动物在免疫功能受到严重抑制的同时,也并存着强烈的炎症反应,两者交织存在。分析其原因,我们发现NS组脾脏中RORγt 的mRNA含量增加,表明Th17细胞的生成增加,抗感染免疫反应及清除病原体的能力增强,机体在发生亢进的炎症反应的同时也出现了不可避免的严重的抗炎反应。NS组Foxp3 mRNA表达水平明显高于Sham组,表明脓毒症时机体内Treg细胞的生成明显增加。Treg细胞的增多会使淋巴细胞增殖下降,是患者最终陷入免疫麻痹的一个重要机制。同时,异常增加的Treg细胞可以通过细胞接触机制和释放细胞因子作用于效应T细胞,同时也使Th1细胞向Th2细胞漂移,最终使机体陷入严重的免疫抑制状态。
UTI可以起到清除氧自由基及抑制炎症介质过度释放的作用[16],并且可以提高淋巴细胞的功能,改善机体的免疫状态[17]。UTI组脾脏中的Foxp3 mRNA和Treg细胞比例相较于NS组均下降,说明UTI可以使Treg细胞生成量以及占淋巴细胞比例均降低,体内的免疫衰竭状态得以有效缓解。而UTI 组RORγt mRNA表达水平和Th17细胞比例均较NS组降低,也说明该组中Th17细胞生成量下降。但是,仅仅Th17细胞比例下降并不能说明实验动物此时所处的确切的免疫状态[10,18],Teg/Th17比值下降与Th17细胞比例下降的双重现象反映出乌司他丁使机体处于促炎反应占优势的状态,既有利于病原微生物的清除,又可减轻过度的炎症反应对机体的损伤[18]。上述结果表明,乌司他丁在缓解免疫抑制状态的同时可抑制过度的炎症反应,具有双相调节作用。
[1]Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach[J]. Lancet Infect Dis, 2013, 13(3): 260-268.
[2]Damsker JM, Hansen AM, Caspi RR. Th1 and Th17 cells:adversaries and collaborators[J]. Ann N Y Acad Sci, 2010, 1183(1): 211-221.
[3]Lee YK, Mukasa R, Hatton RD,et al. Developmental plasticity of Th17 and Treg cells[J]. Curr Opin Immunol, 2009, 21(3): 274-280.
[4]Venet F, Chung CS, Kherouf H,et al. Increased circulating regulatory T cells(CD4+CD25+CD127–) contribute to lymphocyte anergy in septic shock patients[J]. Intensive Care Med, 2009, 35(4): 678-686.
[5]Rendon JL, Choudhry MA. Th17 cells: critical mediators of host responses to burn injury and sepsis[J]. J Leukoc Biol, 2012, 92(3): 529-538.
[6]Huang N, Wang F, Wang Y,et al. Ulinastatin improves survival of septic mice by suppressing inflammatory response and lymphocyte apoptosis[J]. J Surg Res, 2013, 182(2): 296-302.
[7]Zhang RX, Yang Q, Wang SW. Clinical efficacy of different doses of Ulinastatin for the treatment of patients with septic shock[J]. J Clin Res, 2012, 29(2): 238-243.[张汝新, 杨青, 王斯闻. 不同剂量乌司他丁治疗感染性休克的临床研究[J]. 医学临床研究, 2012, 29(2): 238-243.]
[8]Boomer JS, Green JM, Hotchkiss RS. The changing immune system in sepsis is individualized immuno-modulatory therapy the answer[J]? Virulence, 2014, 5(1): 45-56.
[9]Miyazaki Y, Hamano S, Wang S,et al. IL-17 is necessary for host protection against acute-phase trypanosoma infection cruzi[J]. J Immunol, 2010, 185(2): 1150-1157.
[10] Shao M, Liu B, Wang JQ,et al. Effect of Xuebijing injection on T helper 17 and CD4+CD25+regulatory T cells in patients with sepsis[J]. Chin Crit Care Med, 2011, 23(7): 219-223. [邵敏, 刘宝, 王锦权, 等. 脓毒症患者辅助性T细胞17和CD4+CD25+调节性T细胞表达及血必净注射液的干预作用[J]. 中国危重症急救医学, 2011, 23(7): 219-223.]
[11] Flierl MA, Rittirsch D, Gao H,et al. Adverse functions of IL-17A in experimental sepsis[J]. FASEB J, 2008, 22(7): 2198-2205.
[12] Vent-Schmidt J, Han JM, MacDonald KG,et al. The Role of FOXP3 in regulating immune responses[J]. Int Rev Immunol, 2014, 33(2): 110-128.
[13] Wu HP, Chung K, Lin CY,et al. Associations of T helper 1, 2, 17 and regulatory T lymphocytes with mortality in severe sepsis[J]. Inflamm Res, 2013, 62(8): 751-763.
[14] William JH, Mashkoor C, Martin GS,et al. Cecal ligation and puncture[J]. Shock, 2005, 24(Suppl): 52-57.
[15] Krishna MS, Mazen S. Sepsis induced immunosuppression: implications for secondary infections and complications[J]. Indian J Crit Care Med, 2013, 17(3): 162-169.
[16] Luo RJ, Meng FS, Li W,et al. Immunoregulatory effects of ulinastatin combined with thymic peptide α1 on septic patients[J]. Med J Chin PLA, 2010, 35(9): 1110-1112.[罗锐军,孟繁甦, 李薇, 等. 乌司他丁联合胸腺肽α1对脓毒症患者的免疫调理作用观察[J]. 解放军医学杂志, 2010, 35(9): 1110-1112.]
[17] Ma JF, Zhang J, Chen L,et al. Role of Th17 cells in pathogenesis of sepsis[J]. J Chin PLA Postgrad Med Sch, 2010, 31(7): 718-720.[马劲夫, 张纪, 陈力, 等. Th17细胞在脓毒症中的作用机制研究[J]. 军医进修学院学报, 2010, 31(7): 718-720.]
[18] Wu TJ, Zhang LN, Kang CC. The effect of ulinastatin on disbalance of inflammation and immunestatus in patients with severe sepsis[J]. Chin Crit Care Med, 2013, 25(4): 219-223.[吴铁军, 张丽娜, 亢翠翠. 乌司他丁对严重脓毒症患者炎症免疫的失衡的调理作用[J]. 中华危重病急救医学, 2013, 25(4): 219-223.]
Regulatory effect of ulinastatin on Treg and Th17 cells of rats in late stage of sepsis
NIE Wen-long1, WANG Xiao-dan1, ZHANG Yu-xiang2*1Hebei North University, Zhangjiakou, Hebei 075000, China
2Department of ICU, 309 Hospital of PLA, Beijing 100091, China
*< class="emphasis_italic">Corresponding author, E-mail: 15810550308@163.com
, E-mail: 15810550308@163.com
This work was supported by the Research Funding of Tianpu (UF201320)
ObjectiveTo investigate the expression levels of helper T cells 17 (Th17), regulatory T cells CD4+CD25+(Treg) and Treg/Th17 in spleen of rats in late stage of sepsis, and to explore the significance and evaluate the regulatory effects of ulinastatin injection on their expression.MethodsTwenty-four Wistar rats were randomly divided into the sham group (n=8), normal saline (NS) group (n=8) and ulinastatin (UTI) group (n=8). The sepsis model was reproduced by cecum ligation and puncture (CLP). The spleens of the rats were harvested 24h after the operation. The expression levels of Th17 and CD4+CD25+Treg in spleen tissue were detected by flow cytometry, and Treg/Th17 was calculated after the examination. Expression levels of forkhead transcription factor p3 (Foxp3) and retinoid-related orphan nuclear receptor γt (RORγt) mRNA in spleen tissue were quantified by RT-PCR. The effects of ulinastatin on the animals were evaluated.ResultsThe expression levels of CD4+CD25+Treg and Th17 cells were significantly higher in NS group than in sham group and UTI group (P<0.01). No statistical difference was found in the ratio of Treg/Th17 between sham group and NS group (P>0.05), but the ratio of Treg/Th17 was lower in UTI group than in NS group (P<0.01). The expression levels of Foxp3 and the RORγt mRNA were obvious higher in NS group than in both sham and UTI groups (P<0.01). The expression levels of Foxp3 and the RORγt mRNA showed no statistical difference between sham group and UTI group (P>0.05).ConclusionExcessive inflammatory response and immune suppression status simultaneously exist in the rats with late stage sepsis, and ulinastatin may effectively relieve the excessive inflammatory response and immune suppression status.
sepsis; T-lymphocytes, helper-inducer; T-lymphocytes, regulatory
R631
A
0577-7402(2015)11-0892-05
10.11855/j.issn.0577-7402.2015.11.07
2015-04-18;
2015-07-19)
(责任编辑:熊晓然)
天普研究基金(UF201320)
聂文龙,硕士研究生。主要从事脓毒症免疫功能紊乱机制方面的研究
075000 河北张家口 河北北方学院(聂文龙、王晓丹);100091 北京 解放军309医院重症医学科(张玉想)
张玉想,E-mail: 15810550308@163.com
