多硫醚混合硫化剂的组成分析及热分解行为
2015-06-28徐海升许世业周安宁
徐海升,许世业,周安宁
(1. 西安石油大学 化学化工学院,陕西 西安710065;2. 西安科技大学 化学与化工学院,陕西 西安 710054)
多硫醚混合硫化剂的组成分析及热分解行为
徐海升1,2,许世业1,周安宁2
(1. 西安石油大学 化学化工学院,陕西 西安710065;2. 西安科技大学 化学与化工学院,陕西 西安 710054)
以溴乙烷、硫磺和硫化钠为原料,在相转移催化剂存在下合成多硫醚混合硫化剂。对产物进行了组成分析、热分解行为研究和机理探讨。结果表明,合成产物主要为目标化合物二乙基二硫醚、二乙基三硫醚和二乙基四硫醚,三者含量占总质量分数的97.8%,反应单程收率85.3%,产物硫质量分数达63.86%,且具有较宽的分解温度范围(50~235℃)和较大的吸热效应,无需分离即可直接应用于加氢催化剂的预硫化处理,应用前景广阔。
多硫醚;合成;组成分析;热分解;混合硫化剂
金属活性组分为硫化态的加氢催化剂较其氧化态活性更高、选择性和稳定性更好、使用寿命更长,因此,在反应前必须对加氢催化剂进行预硫化处理[1-2]。有机硫化剂因具有毒性相对较低、分解温度范围较宽、油溶性好等显著优点,既可应用于器内预硫化,也可广泛适用于器外预硫化,已成为当今主要的硫化剂[3-6]。
多硫醚是一类通式为 R—Sx—R1的有机硫化物,x介于2~20之间,R 和 R1为烷基、烷芳基、芳基或芳烷基官能团,两者可以相同也可以不同,可以是饱和的或不饱和的烃类,也可以是直链的、支链的或环烷烃类[7-8]。多硫醚因硫含量高,一直以来被用来作为硫化剂[9-10]。最具代表性的是二甲基硫醚(DMS)、二甲基二硫醚(DMDS)和二叔丁基硫醚(DBPS)[11-13]。但是,此类硫化剂在制备、运输过程中,或在单独使用时,都存在着一些缺点和不足[14-15];混和硫化剂的使用,不但可以解决催化剂在预硫化时集中放热的问题,而且还提高了持硫量,可有效降低预硫化成本[16]。
采用溴乙烷、硫化钠和硫磺为原料,在相转移催化剂四丁基溴化铵(TBAB)的作用下,一次性合成出二乙基二硫醚(DEDS)、二乙基三硫醚(DES3)和二乙基四硫醚(DES4)的混合物[17], 对合成所得产物进行了组成分析、热分解行为研究和机理探讨。
1 实验部分
1.1 试剂
硫磺,工业品,取自长庆石化公司;溴乙烷,分析纯,天津大茂化学试剂厂产品;硫化钠、四丁基溴化铵,分析纯,天津福晨化学试剂厂产品;石油醚,色谱纯,辽宁嘉诚精细化学品公司产品;蒸馏水。
1.2 实验方法
1.2.1 硫含量的测定
采用上海石油仪器厂管式炉定硫测定仪以高温燃烧-中和滴定法测定合成产物的硫含量。试样在高温空气中燃烧,生成的SO2气体经H2O2水溶液氧化、吸收成硫酸。以甲基红与次甲基蓝为混合指示剂,用NaOH标准溶液滴定至终点。
1.2.2 合成产物组成分析
将合成产物常压蒸馏,切割120~300℃馏分,用石油醚稀释,样品体积分数约为2%。采用美国Thermo Fisher 公司ITQ 1100气相色谱-离子阱质谱联用仪(GC-MS)对样品进行定性定量分析。色谱部分:TG-SQC型石英毛细管色谱柱(30 m×0.25 mm×0.25 μm);进样口温度280℃,进样量0.4 μL,不分流进样;色谱柱初温60℃,保持1 min,以20℃/min 升温至300℃,保持6 min;载气(高纯He)恒定流速20 mL/min。质谱部分:EI 电离方式,电子能量70 eV;采集方式,Full Scan;相对分子质量扫描范围50~400;离子源温度250℃;传输线温度 280℃;溶剂延迟5.0 min;配备标准质谱图库 NIST 11 版。总离子流峰面积归一化法定量。
1.2.3 合成产物热分析
采用美国TA 公司Q600型同步热分析仪(DSC-TGA)分析合成产物的热性质。分别在N2气氛和H2气氛下进行,固定流速30 mL/min;从室温开始以10℃/min升温至400℃。
1.3 混合硫化剂的合成
按比例称取一定量的硫化钠、硫磺和蒸馏水,于250 mL烧瓶内混合,置于磁力加热搅拌器的水浴锅中,通过数字仪表控温,在一定温度下反应30 min。反应结束后冷却至室温,分离出未反应的硫磺。再按照特定比例加入溴乙烷和TBAB,常温下反应2 h。移入分液漏斗中静置分液,下层淡黄色透亮有机层即为多硫醚混合物,产物单程收率为85.3%(以C2H5Br计),硫含量(质量分数)63.86%,闪点83.6℃。
2 结果与讨论
2.1 多硫醚合成条件的讨论
硫化钠、硫磺和溴乙烷制取多硫醚的合成路线如图1所示。
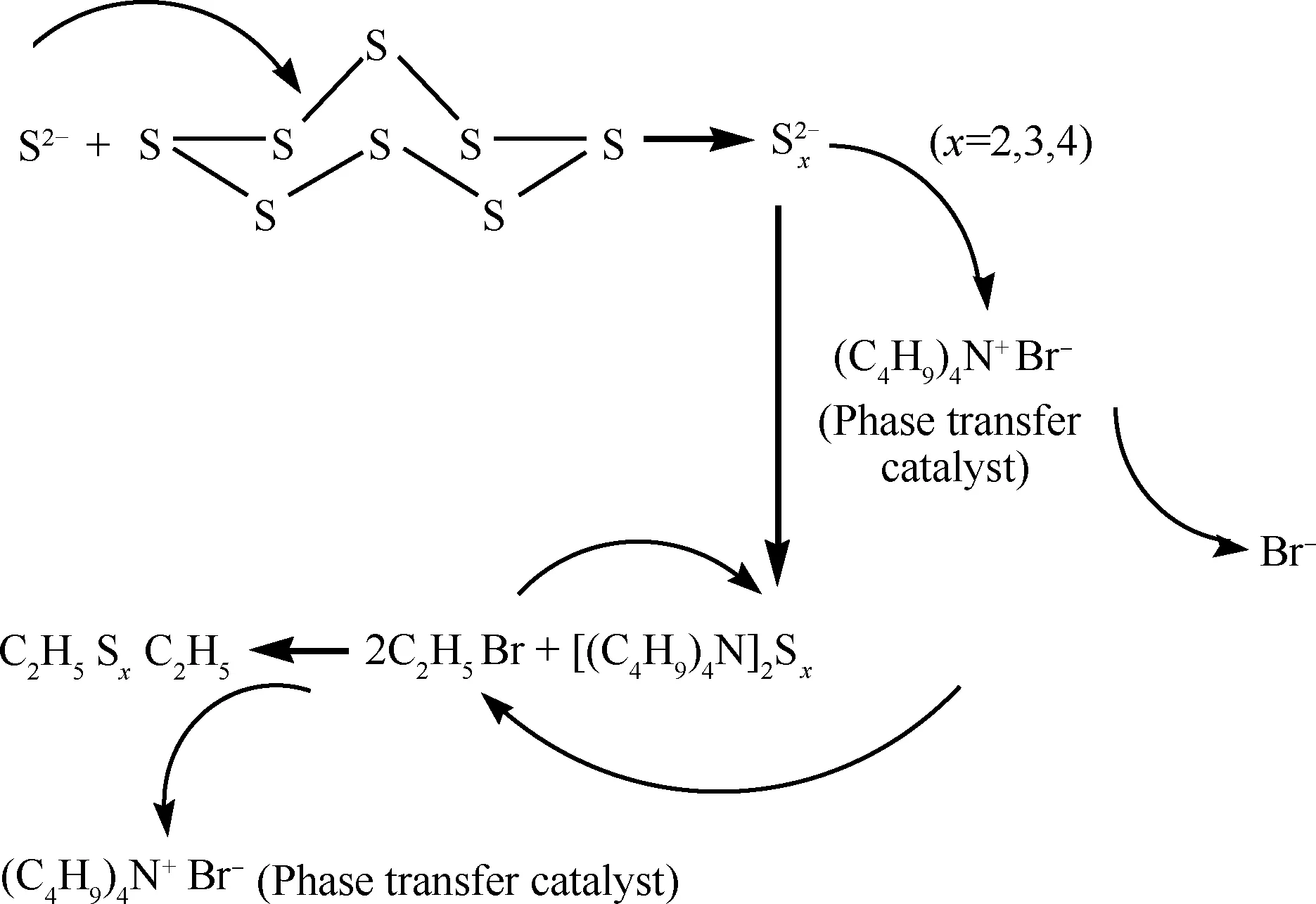
图1 硫化钠、硫磺和溴乙烷制取多硫醚的合成路线
从图1可见,首先,硫磺在受热和硫化钠存在的条件下溶解,S8分子缓慢开环后分解成多硫原子游离基,在与硫化钠解离的S2-反应过程中,多硫原子游离基进一步分裂生成Sx2-(x=2,3,4),然后相转移催化剂TBAB将Sx2-转移到有机相,最后Sx2-与溴乙烷直接产生交联作用得到目的产物二乙基多硫醚。因为硫分子在常温下主要以八角绉环结构存在,故此反应的关键步骤是S8分子的开环。分别以反应温度、反应时间、硫磺与硫化钠摩尔比、溴乙烷用量、TBAB用量为变量进行了正交实验,结果表明,合成产物的硫质量分数最低为50.53%,最高为63.86%,说明产物中的DEDS、DES3和DES4之间的比例是变化的,且硫磺与硫化钠摩比对混合产物硫质量分数影响最大,证明硫磺和硫化钠的反应是关键步骤。后续均以硫质量分数为63.86%的产物为例进行分析。
2.2 多硫醚产物GC-MS定性结果
由硫化钠与硫磺合成得到的多硫醚产物GC-MS分析得到的总离子流色谱示于图2。对图2中tR分别为3.67、5.47和7.28 min 的3个主要色谱峰进行质谱扫描,其质谱图示于图3。
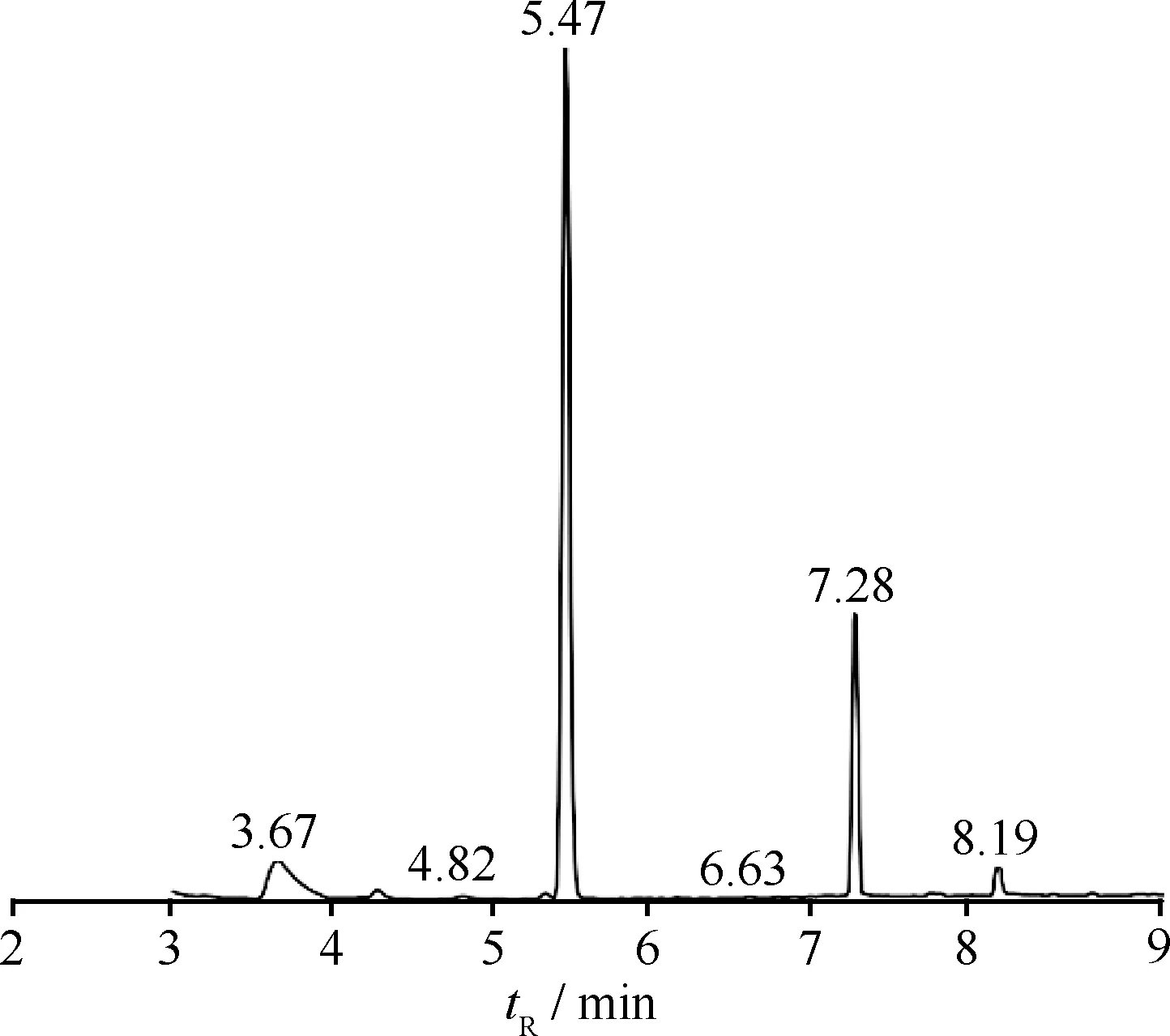
图2 多硫醚产物GC-MS分析的总离子流色谱
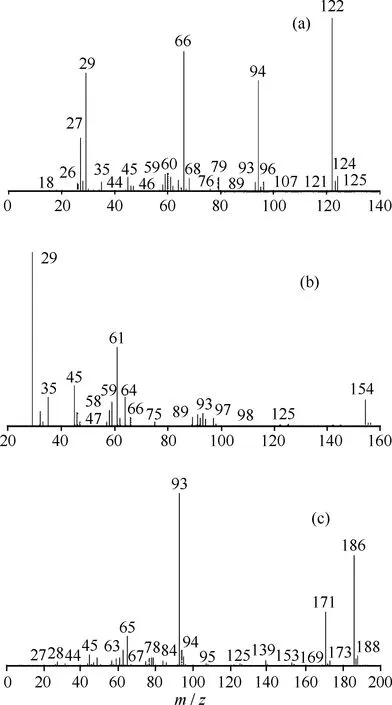
图3 多硫醚产物GC-MS分析的质谱图
由图2可以看出,在设定的检测条件下,各组分都能得到充分的气化,响应值都得到了有效的优化。用NIST谱库对图2中各个峰的质谱进行检索,可以直接得到3.67、5.47 min的色谱峰分别对应为二乙基二硫醚和二乙基三硫醚,检索的匹配度、可能性都非常高。标准谱库检索不能直接得到7.28 min峰的归属,经查阅谱图,其分子离子峰(M)和(M+1)、(M+2)的相对丰度列于表1。

表1 多硫醚产物tR=7.28 min组分的MS分析数据
根据合成原料和合成反应机理,tR=7.28 min的色谱峰对应的产物应为C、H、S组成的有机硫化物。结合C、H、S元素同位素的丰度值和7.28 min峰的M+2的相对丰度,可以推测其对应的化合物可能含有4个S原子;扣除4个S原子对M+1峰的丰度的贡献后,M+1峰还有7.6-(4×0.80)=4.4的相对丰度,可以推断其含有4个C原子。根据反应原理,生成物应是C4H10S4,在NIST谱图检索中排除了HSC2H4S2C2H4SH,该色谱峰应该是C2H5S4C2H5,即二乙基四硫醚。其中心裂解得到C2H5SS+,m/z为93,即质谱图中的基峰,M+1 和M+2相对丰度的实际值与理论值非常接近(见表1),可以确定,tR=7.28 min色谱峰归属于C2H5S4C2H5。至此,鉴定出多硫醚产物3个主要峰及其对应的物质结构,其面积分数之和达97.8%,说明合成的产物纯度较高,副反应较少。详细结果列于表2。
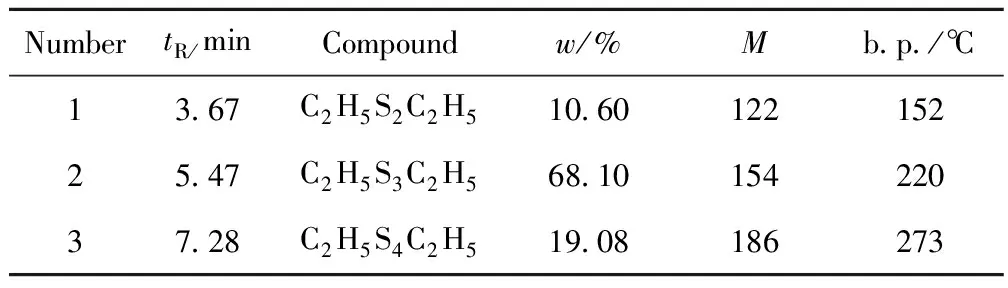
表2 多硫醚产物的GC-MS分析结果
2.3 多硫醚产物的热分解行为
加氢催化剂的预硫化处理是指,硫化剂在H2存在条件下热分解产生的H2S将金属活性组分由氧化态转变为硫化态,从而提高催化剂的加氢活性和稳定性。为了避免加氢过程中催化剂床层飞温现象,选择硫化剂的关键是硫化剂的分解温度。合成的多硫醚混合硫化剂分别在N2和H2氛围中的TG-DTG曲线示于图4,相应的数据列于表3,DSC曲线示于图5。
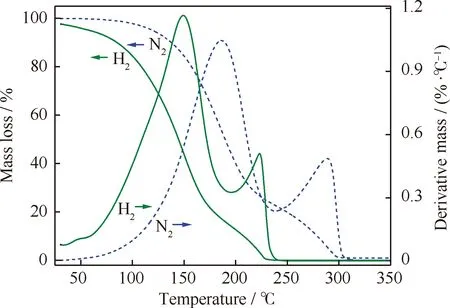
图4 合成的多硫醚产物的TG-DTG曲线
表3 多硫醚产物的TG-DTG数据
Table 3 TG-DTG data of polysulfoether products
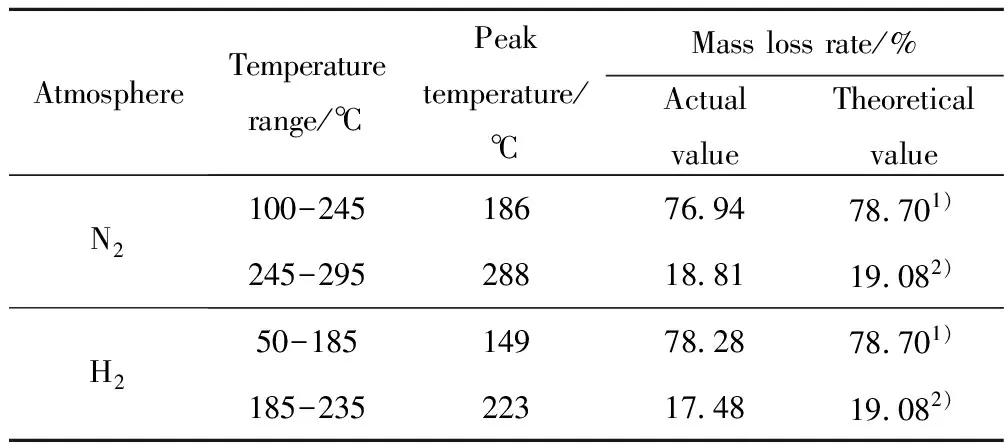
AtmosphereTemperaturerange/℃Peaktemperature/℃Masslossrate/%ActualvalueTheoreticalvalueN2100-24518676 9478 701)245-29528818 8119 082)H250-18514978 2878 701)185-23522317 4819 082)
1) DEDS+DES3; 2) DES4
由图4可知,多硫醚产物在N2和H2氛围中的热分解具有基本相似的规律。开始时缓慢失重,到达一定温度时失重快速,然后失重速率放缓,随后再次快速失重至分解完全。期间均出现2个非常明显的失重峰。由于合成产物是DEDS、DES3和DES4的混合物,3者的摩尔比约为1∶5.1∶1.2(见表2),故有可能第1个大的失重峰掩盖了DEDS的单独分解,应归因于DEDS和DES3的共同热分解,第2个稍小一点的失重峰则属于DES4的热分解。而两种气氛的不同之处在于,通H2时产物的热分解温度更低一些,在不到50℃时就开始与H2发生化学反应,且失重峰更为尖锐,失重速率更大,至235℃基本分解完全;N2氛围中产物从100℃开始缓慢分解失重,经历2次失重后至295℃全部分解。由表3可知,2种气氛中的多硫醚产物的实际失重率与理论失重率基本吻合,与3组分的含量多少相一致。
在加氢反应中,如果预硫化过程的温度过高,极易引起结焦或金属氧化物(如MoO3)被氢还原而破坏催化剂层,故为确保催化剂的活性,硫化剂必须具有较低的分解温度。本研究中合成的多硫醚混合硫化剂在H2氛围中具有较宽的分解温度范围(50~235℃),优于目前应用广泛且评价良好的DMDS(200 ~250℃),可有效避免加氢催化剂预硫化处理时集中放热现象的发生。
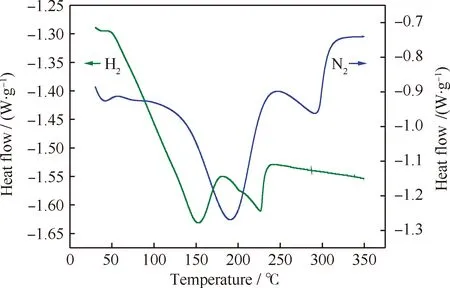
图5 多硫醚产物的DSC曲线
由图5可知,在N2和H2氛围中,多硫醚产物在失重温度范围分别对应出现了2个吸热峰,50℃之前出现的小吸热峰应为溶剂挥发所致。在N2氛围中,其DSC曲线下降趋势稍缓,出现2个吸热峰,说明DEDS、DES3和DES4发生了化学键的断裂;第1个吸热峰的热效应明显大于第2个,与前述3组分的含量保持一致。在H2氛围中,其DSC曲线下降趋势较N2氛围中更为陡峭,吸热效应更大,且2个吸热峰的峰值基本相当,说明多硫醚产物与H2发生了相似的化学反应,生成的气体快速释放,从而造成DSC曲线急剧下降。多硫醚在通H2制H2S过程中具有较大的吸热效应,可以抵消后续催化剂硫化过程放出的部分热量,有利于实现加氢催化剂预硫化过程的缓和放热。
2.4 合成的多硫醚产物的热分解机理
多硫醚的热分解常伴随着气体产物如H2S和烯烃,其化学键断裂过程中往往优先形成相对稳定的含硫自由基,导致—S—S—键合强度降低[18-20]。因此,结合TG、DTG和DSC曲线可初步推断,多硫醚混合硫化剂在N2氛围中的热分解机理如式(1)~(4)所示。

(1)
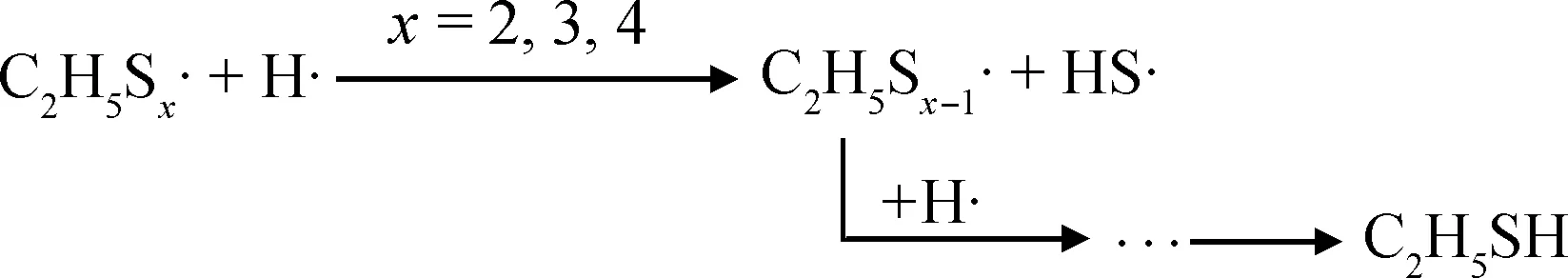
(2)
(3)
(4)
多硫醚混合硫化剂在H2氛围中的热分解相对简单,两者直接发生化学反应生成H2S,但反应不是一步完成,而是分步进行,其反应机理应如式(5)~(6)所示。
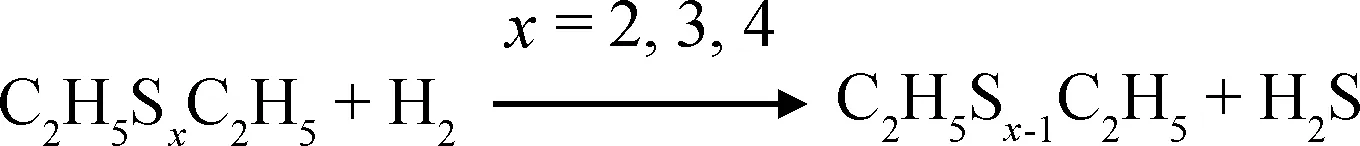
(5)
(6)
3 结 论
(1) 采用相对环保的原料,在温和的条件下,以较短的时间合成出多硫醚混合硫化剂,合成产物闪点为83.6℃,硫质量分数达63.86%,单程收率85.3%,且无需分离即可直接应用于加氢催化剂的预硫化处理。
(2) 合成的多硫醚混合物主要含有目标化合物二乙基二硫醚、二乙基三硫醚和二乙基四硫醚,三者含量占总质量分数的97.8%。
(3) 多硫醚混合硫化剂具有较宽的分解温度范围(50 ~235℃)和较大的吸热效应,有利于实现加氢催化剂预硫化过程的缓和放热,避免集中放热造成的飞温现象发生。
(4) 探讨了多硫醚混合硫化剂在N2和H2氛围中的热分解机理。
[1] BATAILLE F, JEAN L L, MICHAUD P, et al. Alkyldibenzothiophenes hydrodesulfurization-promoter effect, reactivity, and reaction mechanism[J]. Journal of Catalysis, 2000, 191(2): 409-422.
[2] SONG C S. An overview of new approaches to deep desulfurization for ultra-clean gasoline, diesel fuel and jet fuel[J]. Catalysis Today, 2003, 86(1-4): 211-263.
[3] YU S Z, GAO X D, CHEN R L. Presulfurization method of hydrogenation catalyst: US, 6365542[P]. 2002-04-02.
[4] TEXIER S, BERHAULT G, PÉROT G, et al. Activation of alumina-supported hydrotreating catalysts by organosulfides: Comparison with H2S and effect of different solvents[J]. Journal of Catalysis, 2004, 223(2): 404-418.
[5] SAMUEL T, GUY P, GILLES B, et al. Activation of alumina-supported hydrotreating catalysts by organosulfides or H2S: Effect of the H2S partial pressure used during the activation process[J]. Applied Catalysis, A: General, 2005, 293: 105-109.
[6] GAO Y L, FANG X C, CHENG Z M. A comparative study on the exsitu and insitu presulfurization of hydrotreating catalysts[J].Catal Today, 2010, 158(3-4): 496-503.
[7] CARROLL G T, LINDSTROM M J, TUSZYNSKI W J. Polyalkyleneoxyamine catalysts for dialkyl disulfides and/or polysulfides used in dissolving sulfur: EP, 0289950[P]. 1992-12-09.
[8] CASTRO W, WELLER D E, CHEENKACHORN K, et al. The effect of chemical structure of basefluids on antiwear effectiveness of additives[J].Tribology International, 2005, 38(3): 321-326.
[9] BERREBI G. Process of presulfurizing catalysts for hydrocarbons treatment: EP, 0130850[P]. 1987-06-16.
[10] HERVE T, GEORGES B. Process for presulfurizing a hydrogen treatment catalyst: US, 4719195[P]. 1988-01-12.
[11] EMMANUEL A. Method for pre-sulphurization of catalysts: US, 6288006[P]. 2001-09-11.
[12] ROBERTS C D, WILKES M F. Catalyst sulfiding agents[J]. Hydrocarbon Engineering, 2004, 7(9): 29-30.
[13] PAN M H. First application of novel sulfiding agent SZ54 in domestic hydrofining unit[J]. China Petroleum Processing and Petrochemical Technologhy, 2006,(4): 23-28.
[14] HAGER R B, DZIERZA E J, BUCHHOLZ B. Process for the manufacture of dialkyl disulfides and polysulfides: EP, 0342454 [P]. 1993-03-24.
[15] QIANA E W, YAMADAA S, LEEA J, et al. Synthesis of polysulfides using diisobutylene, sulfur, and hydrogen sulfide over solid base catalysts[J].Applied Catalysis, A: General, 2003, 253(1): 15-27.
[16] PIERRE D, NILANJAN B. Process for presulfurizing hydrotreatment catalysts: US, 5922638[P]. 1999-07-13.
[17] SONAVANE S U, CHIDAMBARAM M, ALMOG J, et al. Rapid and efficient synthesis of symmetrical alkyl disulfides under phase transfer conditions[J].Tetrahedron Letters, 2007, 48(34): 6048-6050.
[18] BLOOMFIELD G. F. The reaction of sulfur and sulfur compounds with olefinic substances IV The thermal decomposition of organic polysulfides, and its contribution to the sulfur olefin-reaction[J]. Rubber Chemistry & Technology, 1949, 22(2): 348-355.
[19] KORCHEVIN N A, RUSSAVSKAYA N V, YAKIMOVA G A, et al. New ways of synthesis of 1,2-dithiole-3-thione[J]. Russian Journal of General Chemistry, 2004, 74(11): 1754-1756.
[20] YI H L, ZENG X Q, CAO Y, et al. XANES analysis of tribo-chemical and thermal films generating from some organic polysulfides[J].Chinese Science Bulletin, 2006, 51(22): 2710-2716.
Composition Analysis and Thermal Decomposition Behavior of Polysulfoethers Mixed Sulfiding Agent
XU Haisheng1,2,XU Shiye1,ZHOU Anning2
(1.CollegeofChemistryandChemicalEngineering,Xi’anShiyouUniversity,Xi’an710065,China;2.SchoolofChemistryandChemicalEngineering,Xi’anUniversityofScienceandTechnology,Xi’an710054,China)
The mixed sulfiding agent of polysulfoethers was synthesized by using bromoethane, elemental sulfur and sodium sulfide as raw materials in the presence of phase transfer catalyst. The composition of the mixture of polysulfoethers was analyzed, and its thermal decomposition behavior and mechanism were studied. The results showed that the synthesized mixture contained mainly the target compounds of diethyl disulfide, diethyl trisulfide and diethyl tetrasulfide, and their mass fraction accounted for 97.8%, with the single yield of 85.3% and the product sulfur mass fraction of 63.86%. The synthesized mixed sulfiding agent had a wide range of decomposition temperature(50-235℃) and larger endothermic effect, which can be applied directly to the presulfurization of hydrogenation catalyst without separation, so a broad application prospects may be expected.
polysulfoether; synthesis; composition analysis; thermal decomposition; mixed sulfiding agent
2014-04-03
西安石油大学博士科研启动项目(2011 BS 015)资助
徐海升,男,副教授,博士,从事石油工业催化剂研究;E-mail:xhs74@xsyu.edu.cn
1001-8719(2015)03-0740-05
O 622.7; TQ 218
A
10.3969/j.issn.1001-8719.2015.03.019
