碘甲烷热裂解制低碳烯烃体系热力学分析
2015-06-28曹建新
李 婷, 曹建新, 刘 飞
(1.贵州大学 化学与化工学院,贵州 贵阳 550025;2.贵州大学 贵州省绿色化工与清洁能源技术重点实验室,贵州 贵阳 550025;3.贵州大学 贵州省矿产资源高效利用与绿色化工技术特色重点实验室,贵州 贵阳 550025)
碘甲烷热裂解制低碳烯烃体系热力学分析
李 婷1,2, 曹建新1,2, 刘 飞1,3
(1.贵州大学 化学与化工学院,贵州 贵阳 550025;2.贵州大学 贵州省绿色化工与清洁能源技术重点实验室,贵州 贵阳 550025;3.贵州大学 贵州省矿产资源高效利用与绿色化工技术特色重点实验室,贵州 贵阳 550025)
对碘甲烷热裂解制低碳烯烃反应过程进行了热力学分析,计算体系各独立反应在一定温度范围内的反应焓变、Gibbs自由能和热力学平衡常数Kp,讨论了不同反应温度、压力下体系主要产物的平衡组成。结果表明,碘甲烷制乙烯为吸热反应,制丙烯及副反应均为放热反应;低温易生成丙烯主产物和烷烃、芳烃等副产物,高温有利于乙烯的生成;碘甲烷热裂解制低碳烯烃反应适宜在常压下进行。
碘甲烷;热裂解;低碳烯烃;热力学;平衡组成
低碳烯烃(乙烯、丙烯等)作为化学工业重要基本有机化工原料,在现代石油和化学工业中起着举足轻重的作用。随着我国国民经济整体水平的不断提高,特别是现代化学工业的迅猛发展,对低碳烯烃需求日渐攀升,供需矛盾日益突出。通常,采用石油中的石脑油馏分经水蒸气热裂解工艺生产低碳烯烃,生产过程能耗大,同时石油资源短缺成为制约低碳烯烃生产的重要因素。因此,世界各国竞相开发非石油路线制低碳烯烃技术。
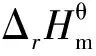
1 碘甲烷热裂解制低碳烯烃体系和Kp值的计算
1.1 体系独立反应的确定
卤代烃法碘甲烷热裂解反应除了生成低碳烯烃(C2~C4)的主反应外,还伴随着聚合、烷基化、异构化、积炭等一系列副反应,形成一个复杂的反应体系。固体酸多孔分子筛ZSM-5、SAPO-34等因具有择形功能而被广泛用作制取低碳烯烃反应的催化剂。在合适的催化反应条件下,分子筛的筛分选择性和笼效应选择性[11]可有效抑制聚烯烃、侧链烷烃等大分子副产物的生成。
实际的碘甲烷热裂解制取低碳烯烃反应受很多因素影响[12],其中一些因素很难定量,计算起来比较复杂。通常,生成低碳烯烃的反应需在较高温度和常压下进行,各组分的逸度和压力相差不大,均可按理想气体处理。结合气相色谱分析结果,碘甲烷热裂解制低碳烯烃体系中存在的组分有CH3I、C2H4、C3H6、C4H8、HI、H2、CH4、C2H6、C3H8、C4H10、C6H6、C6H12、C7H8和C8H10。采用原子矩阵法计算独立反应数,碘甲烷热裂解制低碳烯烃体系的原子矩阵如式(1)所示。对式(1)进行线性初等变换,得到式(2)所示的矩阵。
(1)
(2)
由式(2)可知,该反应体系矩阵的秩为3,而组分数为17,因此该反应体系的独立反应数为14。根据最大线性无关列向量组对应的组分为该复杂反应体系的独立组分[13],取CH3I、C2H4和H2为化学上的独立组分,可得碘甲烷热裂解制低碳烯烃体系包含的独立反应方程式,结果列于表1。由表1可知,丙烯和乙烯的生成量在一定程度上相互制约,而乙烯的生成量又受众多副产物组分的约束。为提高乙烯产量,需要考虑限制丁烯、烷烃和芳香烃的生成。

表1 碘甲烷热裂解制低碳烯烃体系中的独立反应
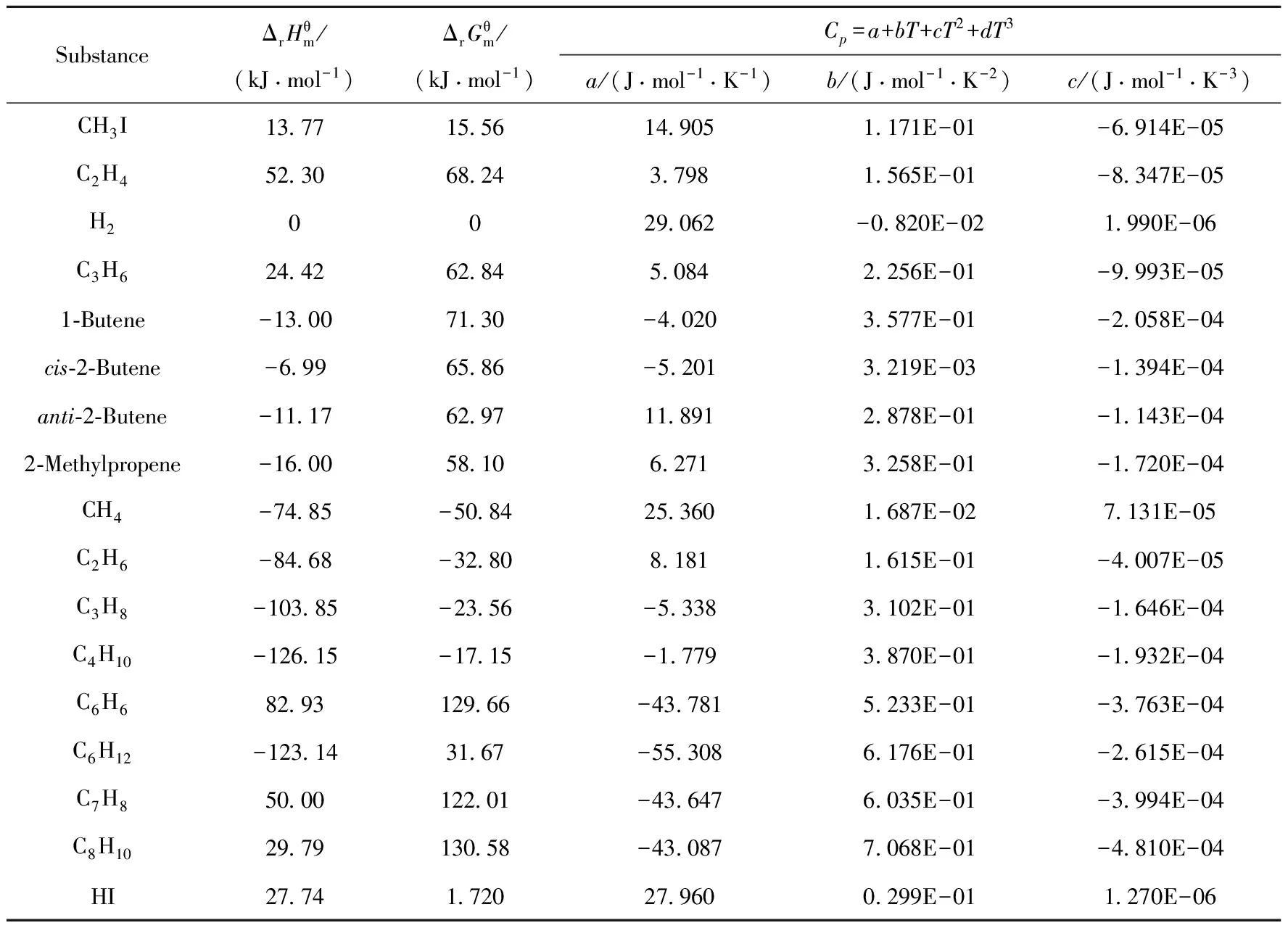
表2 碘甲烷热裂解制低碳烯烃相关热力学数据
1.2 相关物质的热力学数据及计算方法
各物质的标准热力学参数列于表1[14]。根据Kirchhoff定律I,通过定压摩尔热容变化值对温度的积分可求得任一温度下的标准摩尔反应焓,如式(4)、(5)所示。
(3)
(4)
(5)
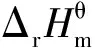
(6)
ΔcT3/6-ΔdT4/12-IRT
(7)
(8)
根据热力学第二定律,在一定温度和压力下,达到化学平衡时体系的总Gibbs自由能达最小值,如式(9)所示;并以原子守恒方程式(10)和组成非负的式(11)为限制条件,计算不同温度T、压力p下碘甲烷热裂解制低碳烯烃体系主要产物的平衡组成。
(9)
(10)
ni≥0(i=1,2,…,N)
(11)
式(9)~(11)中,G为体系总Gibbs自由能,Gi为体系中各组分的Gibbs自由能,kJ/mol;ni为组分i的摩尔分数;bk为体系第k个元素的原子数总和,aik为组分i分子式中第k个元素的原子数。

另外,在所考察的温度范围内,R7~R10均为自发反应,且放热量大,热力学平衡常数随温度升高而降低,表明较低的反应温度体系更易生成烷烃副产物;乙烯可自发反应转化为苯、甲苯和二甲苯(R11~R14),且均为放热反应;乙烯转化为环己烷反应在温度高于673 K时不能自发进行;在相同温度下,特别是在较低温度时,生成烷烃、芳香烃副反应R7~R14的热力学平衡常数比主反应R1、R2大得多,表明体系易生成大量烷烃、芳香烃副产物。可见,在以碘甲烷为原料制取目标产物低碳烯烃时,应筛选适宜催化剂和优化反应条件,以达到促进主反应和抑制副反应的目的。

表3 不同温度下碘甲烷热裂解制低碳烯烃反应中各独立反应的

续表3
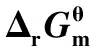
表4 不同温度下碘甲烷热裂解制低碳烯烃反应中各独立反应的
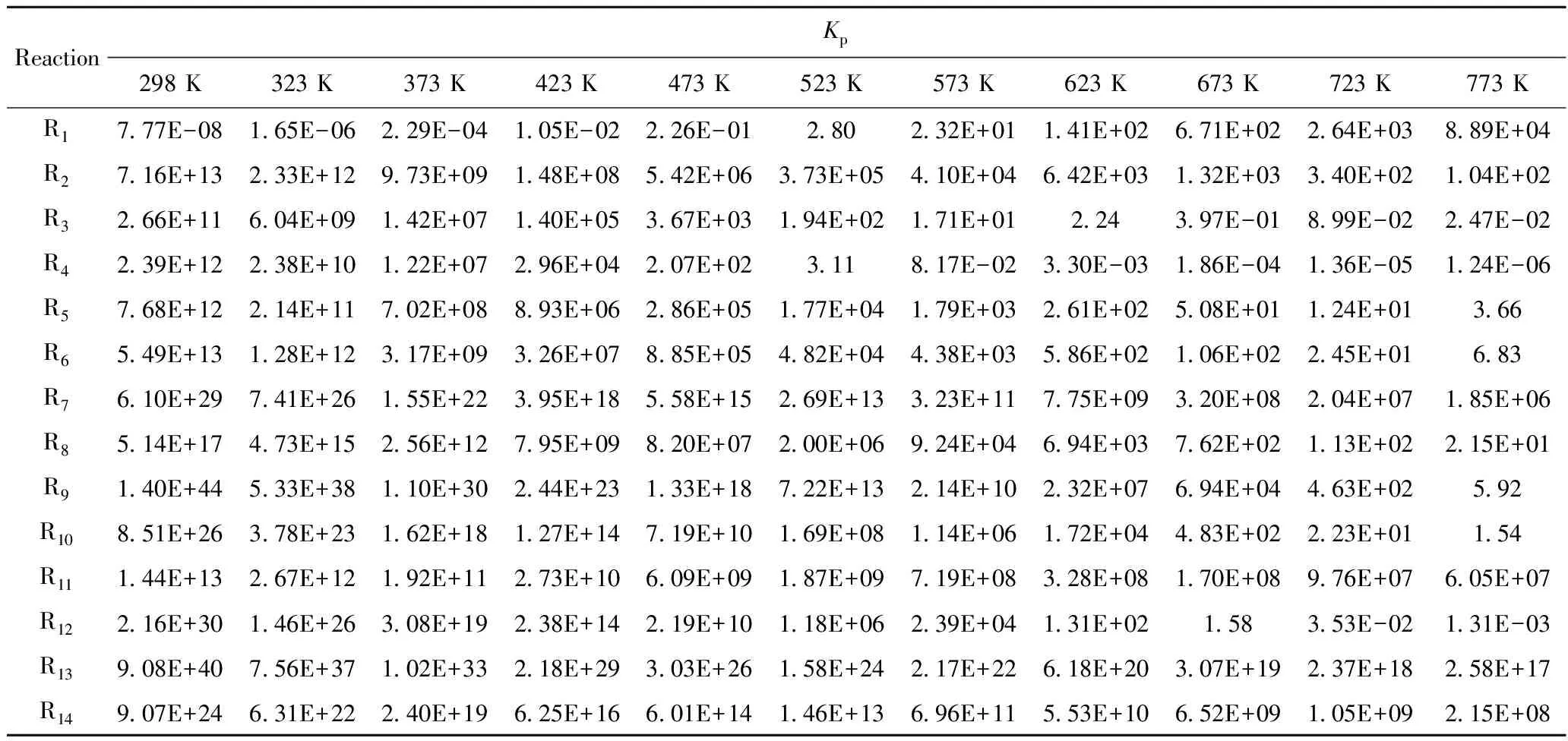
表5 不同温度下碘甲烷热裂解制低碳烯烃反应中各独立反应的Kp
2 反应温度和压力对碘甲烷热裂解制低碳烯烃体系平衡组成影响
2.1 反应温度的影响
反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图1所示。温度对平衡体系中乙烯、丙烯和丁烯的组成影响较大。低温易生成丁烯,而高温易生成乙烯,丙烯的摩尔分数呈先增加后减少趋势,于800 K时达到最大值10.25%;温度低于600 K时,乙烯摩尔分数较低且随温度升高增长较慢,温度高于600 K时,则随温度升高而剧烈增加;温度高于810 K时,丙烯的摩尔分数少于乙烯;温度低于715 K时,丁烯的摩尔分数高于乙烯和丙烯,于485 K时达到最大值16.9%。反应温度对碘甲烷热裂解制低碳烯烃平衡体系中丙烯与乙烯摩尔比(n(C3H6)/n(C2H4))的影响列于表6。由表6可知,低温时,体系中的n(C3H6)/n(C2H4)远大于1,温度升高至789 K时,n(C3H6)/n(C2H4)趋近于1,继续升高温度,则n(C3H6)/n(C2H4)将远低于1。

图1 反应温度对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响
反应温度对碘甲烷热裂解制低碳烯烃平衡体系中1-丁烯及其同分异构体组成的影响如图2所示。在所考察温度范围内,体系中共存有1-丁烯、顺-2-丁烯、反-2-丁烯和2-甲基丙烯。随着温度的升高,各种丁烯的摩尔分数均先增加后减少,其中2-甲基丙烯的摩尔分数最高,在温度为340 K时达11.97%,其次为反-2-丁烯、正-2-丁烯和1-丁烯。
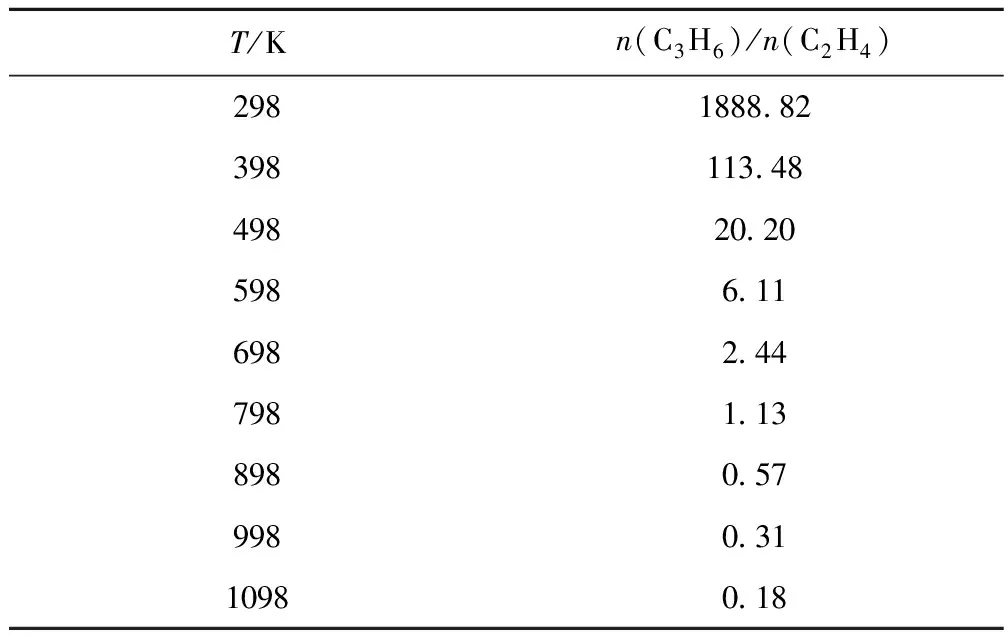
表6 反应温度对碘甲烷热裂解制低碳烯烃平衡体系中n(C3H6)/n(C2H4)的影响
p=0.1 MPa

图2 反应温度对碘甲烷热裂解制低碳烯烃平衡体系中1-丁烯及其同分异构体组成的影响
反应温度对碘甲烷热裂解制低碳烯烃平衡体系中碘甲烷和碘化氢组成的影响如图3所示。碘甲烷热裂解制低碳烯烃体系中存在大量碘化氢,在温度低于600 K时,其摩尔分数随温度的升高增加较快,随后略有降低,稳定在68%左右;平衡体系中碘甲烷的摩尔分数随着温度升高而降低,1098 K时低于1%,表明高温可促进碘甲烷的转化。碘甲烷制低碳烯烃工艺中,原料碘甲烷发生消去反应R1,生成大量碘化氢,碘化氢易溶于水,将气体产物通过水溶液可制得一定浓度氢碘酸,作为制备碘甲烷的原料,可循环使用。
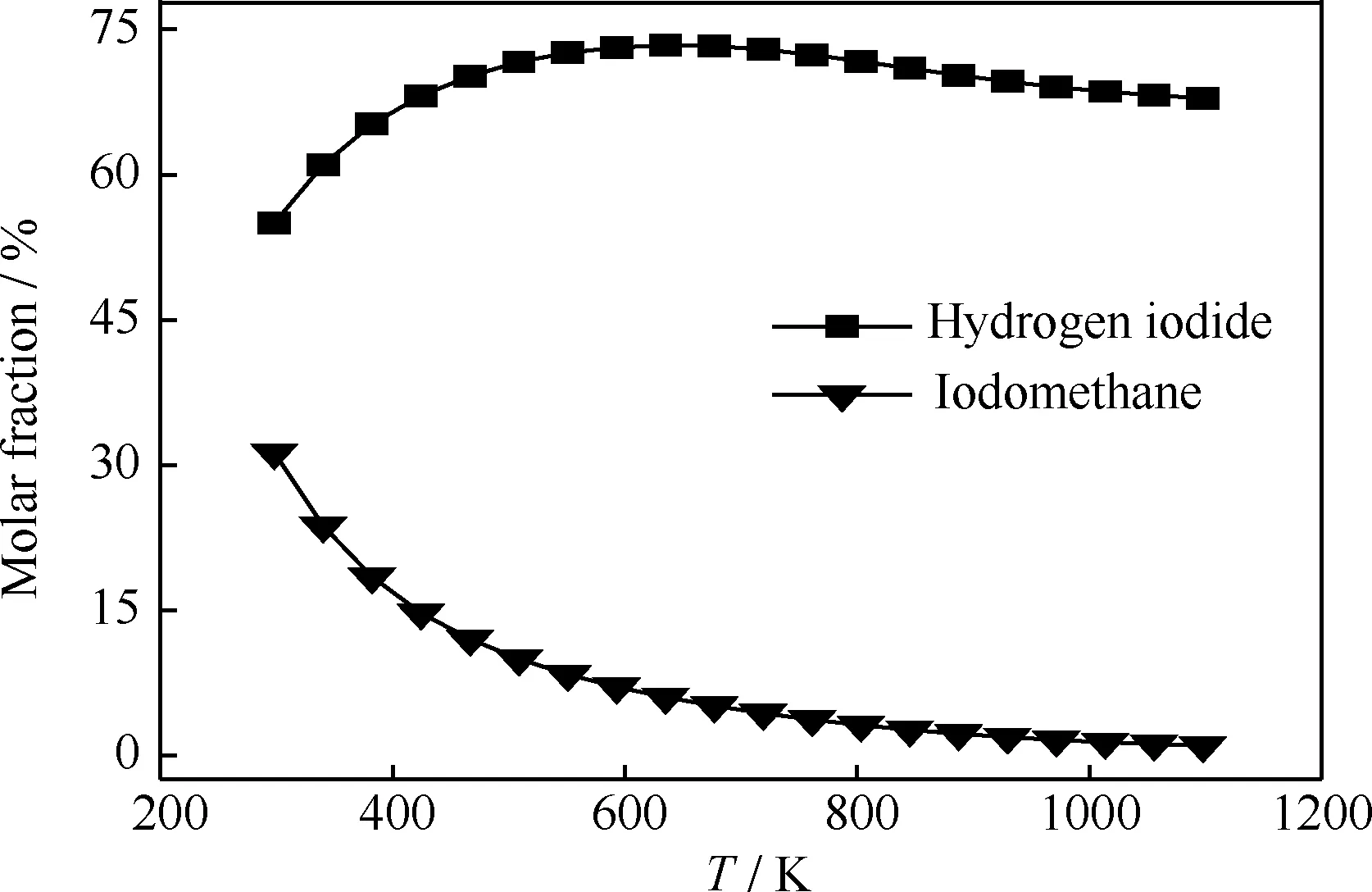
图3 反应温度对碘甲烷热裂解制低碳烯烃平衡体系中碘甲烷和碘化氢组成的影响
2.2 反应压力的影响
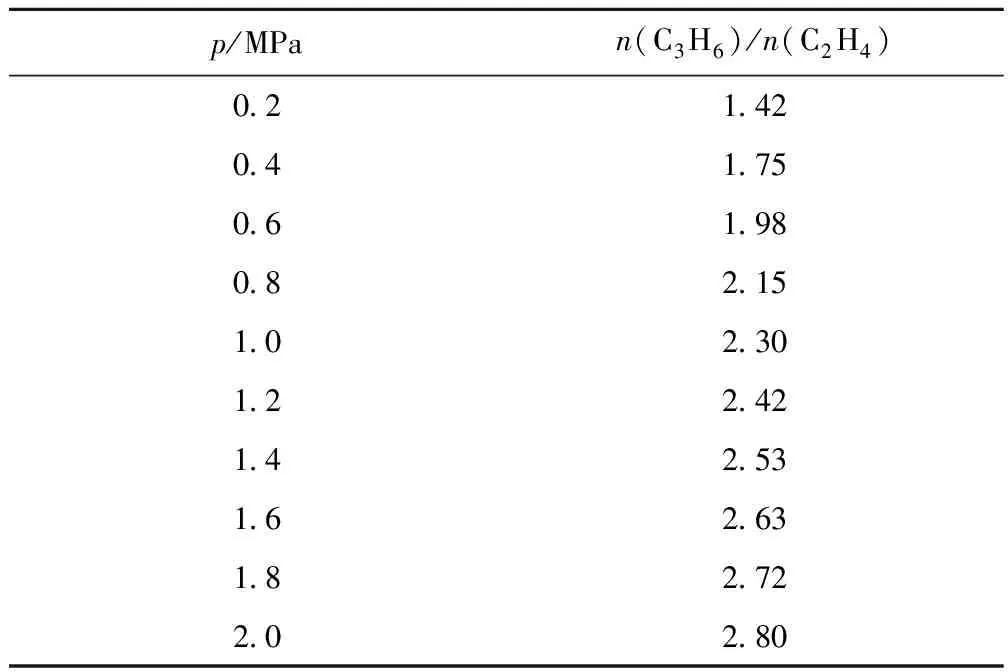
反应压力对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响如图4所示。从图4可知,反应压力对该平衡体系中低碳烯烃的组成影响较大。在所考察压力范围内,随着压力增大,丁烯的摩尔分数逐渐增加,2.0 MPa时达10.65%;乙烯和丙烯的摩尔分数随压力增大而降低,丙烯摩尔分数减低缓慢,乙烯摩尔分数受压力影响较大,2.0 MPa时仅为2.75%。反应压力对该平衡体系中丙烯与乙烯摩尔比(n(C3H6)/n(C2H4))的影响列于表7。从表7可见,在各种压力下n(C3H6)/n(C2H4)始终大于1,且随着压力逐渐增大,n(C3H6)/n(C2H4)逐渐增大。

图4 反应压力对碘甲烷热裂解制低碳烯烃平衡体系中乙烯、丙烯和丁烯组成的影响
表7 反应压力对碘甲烷热裂解制低碳烯烃平衡体系中n(C3H6)/n(C2H4)的影响
Table 7 The effect of reaction pressure onn(C3H6)/n(C2H4) in the equilibrium system of methyl iodide thermal cracking to light olefins
p/MPan(C3H6)/n(C2H4)0 21 420 41 750 61 980 82 151 02 301 22 421 42 531 62 631 82 722 02 80
T=800 K
反应压力对碘甲烷热裂解制低碳烯烃平衡体系中1-丁烯、顺-2-丁烯、反-2-丁烯和2-甲基丙烯组成的影响如图5所示。随着压力增加,1-丁烯及其同分异构体含量均缓慢增加;2-甲基丙烯含量最多,其次为反-2-丁烯,顺-2-丁烯和1-丁烯的摩尔分数随反应压力变化的曲线重合。

图5 反应压力对碘甲烷热裂解制低碳烯烃平衡体系中1-丁烯及其同分异构体组成的影响
反应压力对碘甲烷热裂解制低碳烯烃平衡体系中碘甲烷和碘化氢组成的影响如图6所示。从图6可见,该平衡体系中,碘甲烷的摩尔分数随压力增大而增大,常压时为3.17%,压力增至2.0 MPa时为7.75%;反应压力对碘化氢的摩尔分数基本没影响,在所考察温度范围内,碘化氢摩尔分数处于71%~72%之间。可见, 增大反应体系压力不利于碘甲烷的转化。
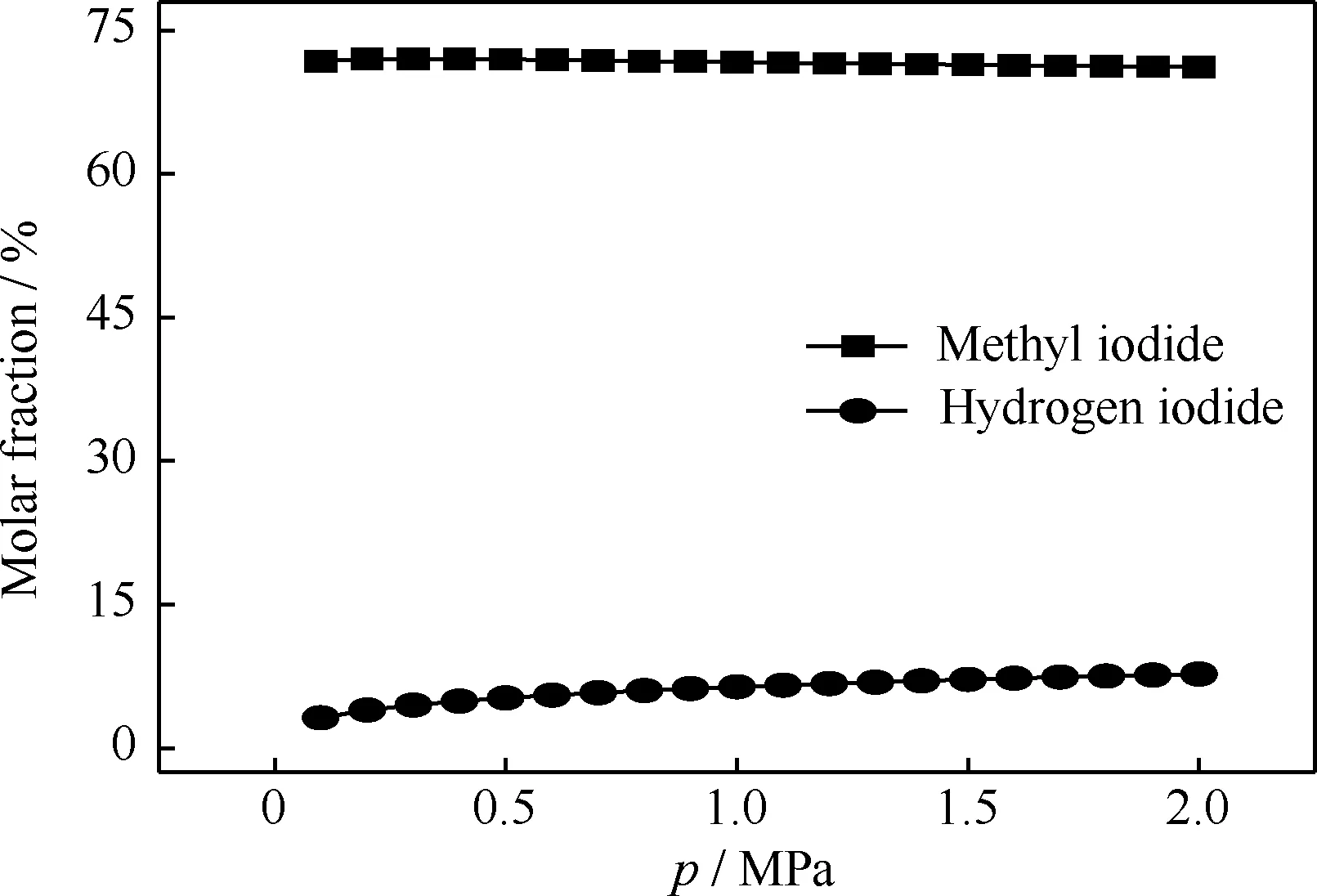
图6 反应压力对碘甲烷热裂解制低碳烯烃平衡体系中碘甲烷和碘化氢组成的影响
3 结 论
(1) 在所考察的反应温度范围内,碘甲烷热裂解生成乙烯的目标反应为吸热反应,温度高于523 K时才可自发反应,而生成丙烯和丁烯的目标反应为放热反应。
(2) 碘甲烷热裂解制低碳烯烃平衡体系中,乙烯和丙烯的含量在一定程度上相互制约。低温时丙烯的摩尔分数远高于乙烯;随着反应温度的升高,乙烯的摩尔分数将高于丙烯。因此在一定催化剂活性范围内,可通过调控反应温度控制碘甲烷热裂解产物中乙烯和丙烯的相对含量。
(3) 在较低反应温度下碘甲烷热裂解制低碳烯时,副反应的热力学平衡常数比主反应大得多,易生成大量烷烃、芳香烃等副产物,应筛选适宜催化剂和优化反应条件,以达到促进主反应和抑制副反应的目的。
(4) 碘甲烷热裂解制低碳烯平衡体系中,乙烯和丙烯主产物随反应压力增大而减少,同时原料碘甲烷的转化率降低。碘甲烷热裂解制低碳烯烃反应更适宜于在常压下进行。
[1] IZADBAKHSH A, FARHADI F, KHORASHEH F, et al. Effect of SAPO-34’s composition on its physico-chemical properties and deactivation in MTO process[J]. Applied Catalysis A, 2009, 364(1-2): 48-56.
[2] 张同旺, 武雪峰, 侯拴弟, 等. 催化剂积炭对甲醇制低碳烯烃效果的影响[J]. 石油学报(石油加工), 2011, 27(6): 891-896. (ZHANG Tongwang, WU Xuefeng, HOU Shuandi, et al. The effect of coke deposition of catalyst on the reaction of methanol to olefins[J]. Acta Petrolei Sinica (Petroleum Processing Section), 2011, 27(6): 891-896.)
[3] KAARSHOLM M, JOENSEN F, NERLOV J, et al. Phosphorous modified ZSM-5: Deactivation and product distribution for MTO[J]. Chemical Engineering Science, 2007, 62(18-20): 5527-5532.
[4] SVELLE S, ARAVINTHAN S, BJØRGEN M, et al. The methyl halide to hydrocarbon reaction over H-SAPO-34[J]. Journal of Catalysis, 2006, 241(2): 243-254.
[5] ZHANG D Z, LIUZ M, SUB L, et al. Methyl halide to olefins and gasoline over zeolites and SAPO catalysts: A new route of MTO and MTG[J]. Chinese Journal of Catalysis, 2012, 33(1): 11-21.
[6] NILSENM H, SVELLE S, ARAVINTHAN S, et al. The conversion of chloromethane to light olefins over SAPO-34: The influence of dichloromethane addition[J]. Applied Catalysis A: General, 2009, 367(1-2):23-31.
[7] 张洪敏. 溴甲烷催化脱HBr制高碳烃的研究[D]. 长沙: 湖南大学, 2008.
[8] TAO L, CHEN L, YIN S F, et al. Catalytic conversion of CH3Br to aromatics over PbO-modified HZSM-5[J]. Applied Catalysis A: General, 2009, 367(1-2): 99-107.
[9] 杨锋, 吴瑛, 周小平, 等. 甲醇制烯烃的新路线研究[J]. 天然气化工(C1化学与化工), 2007, 32(6): 28-30. (YANG Feng, WU Ying, ZHOU Xiaoping, et al. A novel route for methanol to olefins[J]. Natural Gas Chemical Industry, 2007, 32(6): 28-30.)
[10] LIU F, LI T, YE P L, et al. Influence of parameters on catalytic performance over different modified ZSM-5 zeolites for the IMTO process[C]//3rd International conference on Engineering Materials, Energy, Management and Control, Advanced Materials Research, 2013, 648: 143-146.
[11] HEREIJGERSB P C, BLEKEN F, NILSENM H, et al. Product shape selectivity dominates the methanol-to-olefins (MTO) reaction over H-SAPO-34 catalysts[J]. Journal of Catalysis, 2009, 264(1): 77-87.
[12] WEI Y X, ZHANG D Z, CHANGF X, et al. Direct observation of induction period of MTO process with consecutive pulse reaction system[J]. Catalysis Communications, 2007, 8(12): 2248-2252.
[13] 陈博, 朱建华, 岳长涛. 利用原子系数矩阵法确定复杂反应体系独立反应的方法探讨与改进[J]. 化学反应工程与工艺, 2012, 28(1): 57-64.(CHEN Bo, ZHU Jianhua, YUE Changtao. The improvement on method of determining the independent reactions for complex reacting system via atomic coefficient matrix method[J].Chemical Reaction Engineering and Technology, 2012, 28(1): 57-64.)
[14] 时钧, 汪家鼎, 余国琮, 等. 化学工程手册[M]. 北京: 化学工业出版社, 1996.
Thermodynamic Analysis of Methyl Iodide Pyrolysis to Light Olefins
LI Ting1,2, CAO Jianxin1,2, LIU Fei1,3
(1.SchoolofChemistryandChemicalEngineering,GuizhouUniversity,Guiyang550025,China;2.GuizhouKeyLaboratoryforGreenChemicalandCleanEnergyTechnology,GuizhouUniversity,Guiyang550025,China;3.GuizhouKeyLaboratoryforEfficientUtilizationofMineralandGreenChemicalTechnology,GuizhouUniversity,Guiyang550025,China)
Thermodynamic analysis of methyl iodide pyrolysis to light olefins was worked out in detail. A series of data, such as the enthalpy changes, the Gibbs free energy changes and equilibrium constants of each independent reaction in methyl iodide pyrolysis, were calculated in a certain temperature range. As the basis of calculation, the equilibrium compositions of reaction system at different temperatures and pressures were discussed as well. Results showed that the reaction of methyl iodide converting to ethylene was endothermic reaction, and the reaction to propene and the side reactions were exothermic reactions. Propene, alkanes and aromatic hydrocarbons were formed easier in methyl iodide pyrolysis at low temperature, but higher temperature was favor to the formation of ethylene. With the increase of reaction pressure, the content of light olefins and conversion of methyl iodide decreased.
methyl iodide; pyrolysis; light olefins; thermodynamic; equilibrium composition
2014-03-24
贵州省科技攻关项目(黔科合GY字[2012]3057)、贵州省教育厅自然科学招标项目(黔教合KY字(2012)046)、贵阳市科技支撑计划项目(筑科合同[2012101]2-6号)、贵州省高层次人才特助项目(TZJF-2011-36号)和贵州大学研究生创新基金项目(研理工2014052)资助第一作者: 李婷,女,硕士研究生,从事工业催化的研究工作
刘飞,男,教授,博士,从事工业催化的研究工作;E-mail:ce.feiliu@gzu.edu.cn
1001-8719(2015)03-0745-08
TQ013.1
A
10.3969/j.issn.1001-8719.2015.03.020
