自发性癫痫大鼠脑内神经肽Y受体Y2R和Y5R的表达及分布
2015-06-15徐晓雪郭凤王千慧杨军赵久晗张朝东蔡际群
徐晓雪 郭凤 王千慧 杨军 赵久晗 张朝东 蔡际群
自发性癫痫大鼠脑内神经肽Y受体Y2R和Y5R的表达及分布
徐晓雪 郭凤 王千慧 杨军 赵久晗 张朝东 蔡际群
目的 研究自发性癫痫大鼠(tremor rat,TRM)海马和颞叶皮质中神经肽Y(neuropeptide Y,NPY)Y2和Y5受体(Y2R和Y5R)的表达和分布。方法 以TRM大鼠作为癫痫组,正常Wistar大鼠作为对照组,每组7只,以RT-PCR法检测Y2R和Y5R mRNA水平表达,Western Blot法检测其蛋白水平表达,免疫荧光法分析癫痫组和对照组大鼠海马CA1、CA3和齿状回(DG)区以及颞叶皮质中Y2R与Y5R的分布和定位。 结果 RT-PCR和Western Blot结果显示,与对照组大鼠相比较,癫痫组海马和颞叶皮质中Y2R mRNA相对表达水平(相对灰度值为海马:0.75±0.06vs. 0.51±0.07;颞叶皮质:0.70±0.05vs. 0.55±0.03)及蛋白相对表达水平(相对灰度值为海马:0.79±0.08vs. 0.42±0.05;颞叶皮质:0.72±0.05vs. 0.51±0.07)均显著上调(均P<0.01),Y5R mRNA(相对灰度值为海马:0.52±0.10vs. 0.54±0.06;颞叶皮质:0.46±0.03vs. 0.42±0.04)及蛋白(相对灰度值为海马:0.28±0.06vs. 0.27±0.03;颞叶皮质:0.31±0.05vs. 0.27±0.07)表达均没有明显变化(均P>0.05)。免疫荧光分析发现Y2R与Y5R在癫痫组大鼠海马CA1、CA3区神经元和DG区颗粒细胞以及颞叶皮质神经元中分布广泛且主要定位在细胞膜上。 结论 在TRM中Y2R表达在海马和颞叶皮质中均表达上调,但是Y5R的表达没有明显改变。
癫痫;NPY受体;Y2R;Y5R;自发性癫痫大鼠
癫痫(epilepsy)是一种以大脑神经元异常放电引起短暂的脑功能紊乱为特征的慢性中枢神经系统疾病,其发病机制十分复杂,至今仍未完全阐明。神经肽Y(neuropeptide Y, NPY)是一种重要的内源性神经肽。现已证实癫痫发生时NPY及其受体表达会发生变化,而这种改变可能与癫痫的发病和治疗有重要关系[1]。
NPY受体属于G蛋白耦联受体家族成员。NPY受体活化后通常与抑制性G蛋白(Gi)耦联而抑制腺苷酸环化酶活性,最终动员或抑制钙离子的释放。此外NPY还可通过影响相关离子通道的表达以及激活蛋白激酶C传递不同的调控信息。目前已经发现8种NPY受体亚型,分别命名为Y1R-Y8R[2]。在哺乳动物的中枢神经系统,特别是在海马和皮质等与癫痫发生密切相关的部位,Y2R和Y5R的表达最为丰富[3]。在不同的癫痫模型中,Y2R和Y5R的表达变化以及功能存在一定差别。近年来人工过表达NPY及其特异受体也逐渐成为癫痫基因治疗的新热点[4]。
自发性癫痫大鼠(tremor rat,TRM)是由日本京都大学首次发现的模拟癫痫小发作的理想模型[5],其在10号染色体上存在Tm基因突变,并在出生后无需物理化学因素刺激而出现自发性抽搐以及失神样癫痫发作,通过脑电图能够在海马和皮质中检出5~7 Hz的棘慢综合波。本研究拟利用分子生物学检测方法探讨这两种NPY受体亚型在TRM癫痫发生中的作用,为进一步开发拮抗自发性癫痫的特异性药物和基因治疗提供理论依据。
1 材料和方法
1.1 实验动物与试剂 TRM种鼠(为转基因鼠kyo与Wistar杂交所得)由日本京都大学馈赠,中国医科大学自行繁殖,饲养至4周龄时剪鼠尾基因鉴定后用作癫痫组,中国医科大学实验动物部提供健康Wistar大鼠作为对照组。癫痫组和对照组大鼠均选9~12周龄,雌雄不限,每项实验中模型组和对照组各7只。TRIzol购自SIGMA公司,Y2R、Y5R和GAPDH扩增引物由Takara公司合成,一抗Y2R和Y5R兔多克隆抗体购自ABCAM公司, 一抗GAPDH小鼠单克隆抗体购自Santa Cruz公司。
1.2 方法
1.2.1 RT-PCR检测Y2R和Y5RmRNA表达:癫痫组和对照组大鼠麻醉后断头,迅速取出全脑,剥离海马和颞叶皮质。以TRIzol法提取总RNA,紫外分光光度计测定RNA浓度和纯度。取1 μg总RNA样本模板于10 μL反转录反应体系中,以GAPDH作为内参,参照Takara反转录反应试剂盒操作。PCR扩增引物序列:Y2R上游引物5′-GAGCATGCGCACAGTAACCAA-3′,下游引物5′-TAGGGCACCAAATGGCACAAA-3;Y5R上游引物5′-CGCTTCCATCTGGAGCAGAA-3′,下游引物5′-CATTCCGAGCAGCAGCTGTAT-3′;GAPDH上游引物5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物5′-ATGGTGGTGAAGACGCCAGTA-3′。阴性对照模板为ddH2O,其余体系组分以及反应条件均与实验组相同。反应产物经2%(质量浓度)琼脂糖凝胶电泳后分析灰度值。以Y2R 和Y5R 扩增条带灰度值与作为内参的GAPDH 扩增条带灰度值的比值为相应mRNA相对表达量。
1.2.2 Western Blot分析Y2R和Y5R蛋白表达:在剥离的各组大鼠海马和颞叶皮质组织样本中加入RIPA裂解液以及蛋白酶抑制剂混合物,匀浆超声后低温离心取上清液,BCA法测定提取的总蛋白浓度,加入上样缓冲液煮沸变性后取50 μg/孔,5%(质量浓度)浓缩胶和12%(质量浓度)分离胶进行SDS-PAGE电泳,浓缩胶电压80 V 50 min,分离胶电压120 V 70 min。转印至PVDF膜(200 mA,2 h)。5%(质量浓度)BSA常温封闭1 h后分别加入一抗Y2R(1∶500)、Y5R(1∶400)和GAPDH(1∶1500),4℃过夜孵育。次日TBST洗膜后,加入相应的二抗(Y2R和Y5R二抗为羊抗兔1∶3000;GAPDH二抗为羊抗小鼠1∶3000),37℃孵育1 h,TBST洗膜后ECL化学发光,按一抗说明书上的蛋白相对分子质量确定目的条带位置并测定灰度值,以目的条带灰度值与GAPDH灰度值的比值为Y2R和Y5R蛋白相对表达量。
1.2.3 免疫荧光染色检测Y2R和Y5R蛋白分布:癫痫组和对照组大鼠麻醉后,以4%(质量浓度)多聚甲醛心脏灌流,迅速取脑,4%(质量浓度)多聚甲醛固定24 h,30%(质量浓度)蔗糖沉淀24 h。OCT复合物包埋,冰冻切片机进行10 μm厚的连续冠状切片。0.01 mol/L PBS漂洗3次,每次10 min,1%(质量浓度)正常牛血清蛋白及0.2%(质量浓度)Triton X-100孵育90 min,分别加入一抗兔抗Y2R(1∶50)和兔抗Y5R(1∶40),4℃湿盒过夜。次日PBS清洗,在暗室中加入FITC标记羊抗兔(1∶200),避光孵育2 h后加入DAPI(1∶500)标记细胞核并封片。400倍荧光显微镜下观察Y2R和Y5R阳性细胞,其中两种阳性细胞的细胞核均被标记为蓝色,目的蛋白均被标记为绿色。每只大鼠各选取3张切片,观察部位为颞叶皮质以及海马CA1、CA3和齿状回区。阴性对照一抗由PBS代替,其余步骤均相同。
1.3 统计学处理 实验数据均用均数±标准差表示,数据采用SPSS17.0软件进行统计分析,组间两两比较用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组脑组织Y2R和Y5R mRNA表达 与对照组大鼠比较,癫痫组大鼠海马和颞叶皮质中Y2R mRNA表达均上调(均P<0.01);Y5R mRNA在上述脑区中表达与对照组比较差异均无统计学意义(均P>0.05)(表1和图1)。

表1 各组脑内Y2R和Y5R mRNA相对表达比较

表2 各组大鼠脑组织Y2R和Y5R蛋白相对表达比较
2.2 各组脑组织Y2R和Y5R蛋白表达 与对照组大鼠比较,癫痫组大鼠海马和颞叶皮质中Y2R蛋白相对表达明显增加(均P<0.01);Y5R在上述脑区中蛋白相对表达与对照组比较差异均无统计学意义(均P>0.05)(表2和图2)。
2.3 各组大鼠脑组织Y2R和Y5R蛋白表达定位免疫荧光结果显示这两种NPY受体亚型在两组大鼠海马CA1、CA3和颞叶皮质神经元上均广泛表达。如图3、图4所示,镜下可见神经元形态呈锥形或椭圆状,细胞核较大且被标记为蓝色,Y2R和Y5R蛋白被标记为绿色并主要表达在神经元胞膜上,轴突上也有一定分布。在大鼠海马齿状回区颗粒细胞胞膜上,也能观察到Y2R与Y5R的分布。
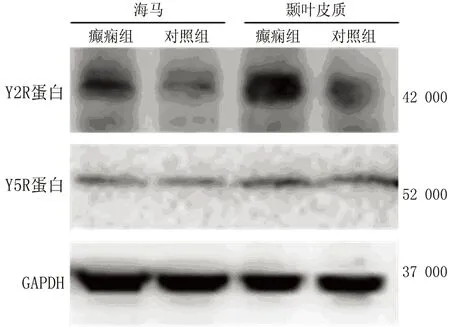
图2 各组大鼠脑内Y2R和Y5R蛋白水平表达(Western Blot法)
3 讨论
NPY是一种具有神经保护作用的内源性神经肽。NPY与其相应受体结合后能够影响下游多条信号通路。癫痫诱发的NPY异常表达与NPY受体的表达变化有密切关系[6]。因此,Y2R和Y5R均可能参与癫痫的发生过程。本研究旨在研究NPY两种重要的受体亚型Y2R和Y5R在TRM海马和颞叶皮质的表达和分布。本研究发现,与对照组大鼠相比,在TRM海马和颞叶皮质中Y2R mRNA及蛋白表达均明显增多,而Y5R的表达没有明显变化。免疫荧光检测结果显示,Y2R和Y5R在TRM海马CA1、CA3和齿状回以及颞叶皮质区域都有广泛的分布。
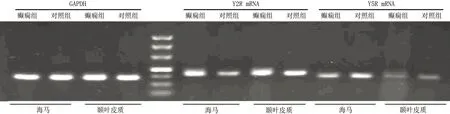
图1 各组大鼠脑内Y2R和Y5R mRNA表达(RT-PCR法)
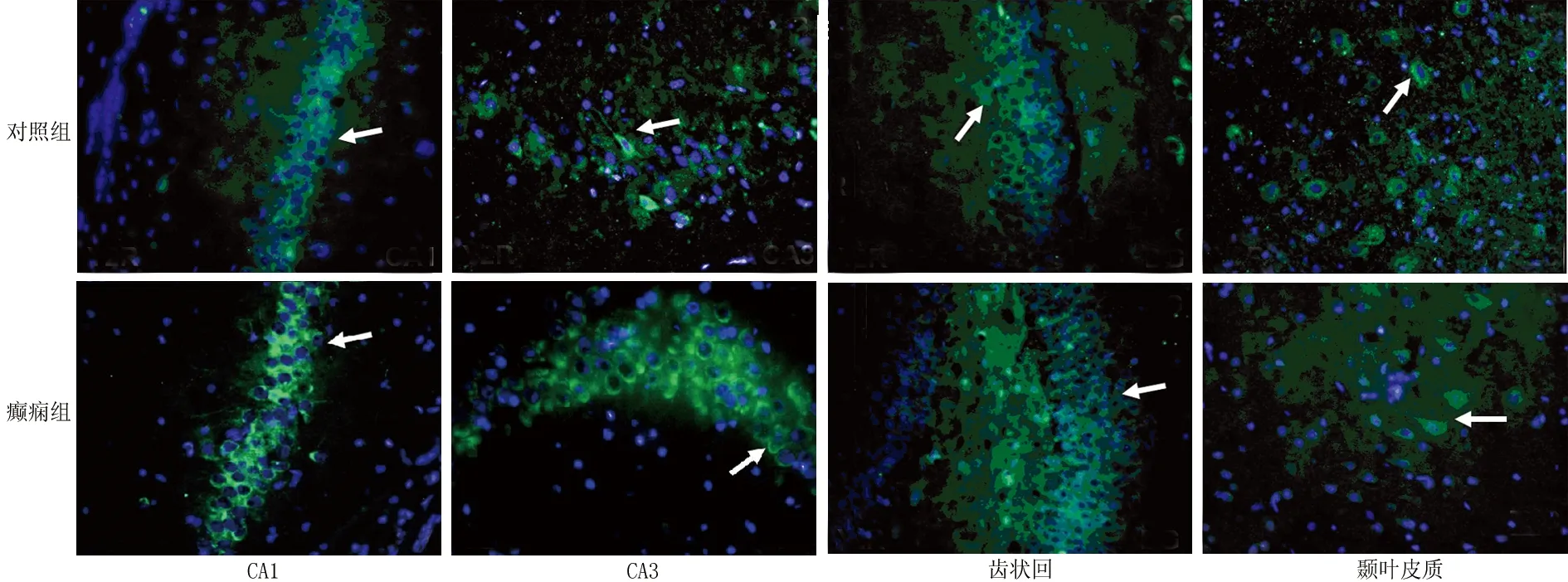
图3 各组大鼠脑组织Y2R蛋白表达分布,图中箭头所示为相应阳性细胞(免疫荧光×400)

图4 各组大鼠脑组织Y5R蛋白表达分布,图中箭头所示为相应阳性细胞(免疫荧光×400)
Y2R与癫痫的关系十分密切,是比较公认的具有抗癫痫功能的NPY受体。海马区Y2R在苔藓纤维和Schaffer侧支的表达浓度最高。突触前区域分布说明Y2R可能通过抑制钙离子介导的谷氨酸释放而发挥NPY的抗癫痫作用[7]。有研究发现局限性癫痫患者中Y2R在海马的齿状回、CA1和CA3区结合量提高43%~48%[8]。因此,由癫痫引起的海马区Y2R增加也可以视为是一种内源性的保护机制,这种机制的产生可能依赖于细胞内外的神经网络传递。由此推测,在TRM脑内Y2R表达的异常升高可能有利于NPY神经保护功能的发挥,但是这种保护并不足以完全抵御癫痫的发生。这有可能是因为蛋白激酶C的影响,因为有研究认为蛋白激酶C的高表达有可能会阻碍由NPY和Y2R介导的谷氨酸抑制作用[9],但是相关机制还需要进一步的实验证实。
有学者认为NPY很有可能通过Y5R介导抑制海马兴奋性传递的过程。Nanobashviii等[10]认为Y5R可以介导NPY对大鼠海马脑片CA3区发作间期自发性癫痫样放电的抑制作用。Y5R与Y2R对于癫痫样放电的抑制作用不同。后者主要作用于癫痫大发作期,而Y5R主要作用于发作间期放电。在Y5R缺失的状态下,NPY对于离体海马脑片的癫痫样放电不起作用。在急性癫痫发作后,在体海马区Y5R mRNA表达明显增加。提示Y5R对于NPY抑制边缘性发作发挥关键作用。但本研究中未发现其在TRM海马以及颞叶皮质中表达异常。这可能是因为NPY通过Y5R作用时,在一定程度上能降低神经元的兴奋性,但其作用与通过Y2R作用相比则显得较小且随着年龄增长而减少,并不足以阻止或减弱电刺激引起惊厥发作后的放电[11]。
综上,本研究显示,与对照组大鼠相比,Y2R在TRM海马和颞叶皮质中表达均明显上调,而Y5R则没有明显变化,提示在TRM海马中,Y2R的异常表达可能有助于NPY抗癫痫作用的发挥。NPY的神经保护作用可能并没有受损,并正常启动,但是这种保护却没有抵御癫痫的发生。这可能是由于NPY表达量不足,也有可能与其他关键蛋白,如蛋白激酶C有关。但上述推测均需要更多的实验进行验证。
[1]陈琅,季晓林,邹漳钰,等 戊四氮致痫大鼠不同脑区神经肽Y的表达及意义[J].中国神经免疫学和神经病学杂志,2005,12:118-121.
[2]Walther C, Mörl K, Beck-Sickinger AG. Neuropeptide Y receptors: ligand binding and trafficking suggest novel approaches in drug development[J]. J Pept Sci, 2011,17: 233-246.
[3]Babilon S1, Mörl K, Beck-Sickinger AG. Towards improved receptor targeting: anterograde transport, internalization and postendocytic trafficking of neuropeptide Y receptors[J].Biol Chem, 2013, 394: 921-936.
[4]McCown TJ. The future of epilepsy treatment: focus on adeno-associated virus vector gene therapy[J]. Drug News Perspect, 2010, 23: 281-286.
[5]Xu X, Guo F, Lv X, et al. Abnormal changes in voltage-gated sodium channels NaV1.1, NaV1.2, NaV1.3, NaV1.6 and in calmodulin/calmodulin-dependent protein kinase Ⅱ, within the brains of spontaneously epileptic rats and tremor rats[J]. Brain Res Bull, 2013, 96: 1-9.
[6]Vezzani A, Sperk G. Overexpression of NPY and Y2 receptors in epileptic brain tissue: an endogenous neuroprotective mechanism in temporal lobe epilepsy?[J]. Neuropeptides, 2004, 38: 245-252.
[7]Staniĉ D, Mulder J, Watanabe M, et al. Characterization of NPY Y2 receptor protein expression in the mouse brain. Ⅱ: Coexistence with NPY, the Y1 receptor, and other neurotransmitter-related molecules[J]. J Comp Neurol, 2011, 519: 1219-1257.
[8]Furtinger S, Pirker S, Czech T, et al. Plasticity of Y1 and Y2 receptors and neuropeptide Y fibers in patients with temporal lobe epilepsy[J]. J Neurosci, 2001, 1: 5804-5812.
[9]Silva AP, Louren J, Xapelli S, et al. Protein kinase C activity blocks neuropeptide Y mediated inhibition of glutamate release and contributes to excitability of the hippocampus in status epilepticus[J]. FASEB J, 2007, 21: 671-681.
[10]Nanobashvili A, Woldbye D, Husum H, et al. Neuropeptide Y5 receptors suppress in vitro spontaneous epileptiform bursting in the rat hippoeampus[J]. Neuro Report, 2004, 15: 339-343.
[11]Ho MW, Beck-Sickinger AG, Colmers WF. Neuropeptide Y(5) receptors reduce synaptic excitation in proximal subiculum, but not epileptiform activity in rat hippocampal slices[J]. J Neurophysiol, 2000, 83: 723-734.
(本文编辑:邹晨双)
The expressions and distributions of NPY Y2R and Y5R in tremor rat brains
XUXiaoxue*,GUOFeng,WANGQianhui,YANGJun,ZHAOJiuhan,ZHANGChaodong,CAIJiqun.
*DepartmentofNeurology,thefirsthospitalofChinaMedicalUniversity,ShenyangLiaoning110001,China
XU Xiaoxue, Email:xiaoxue80cn@sina.com
Objective To explore the expressions and distributions of neuropeptide Y(NPY) Y2 receptor and Y5 receptor (Y2R and Y5R) in tremor rat (TRM) hippocampus(HIP) and temporal lobe cortex(TLC). Methods Normal Wistar was chosen as the control group and TRM was chosen as the epileptic group. Each group contained 7 rats.RT-PCR and Western Blot were carried out to detect the expressions of Y2R and Y5R. The distributions of these two receptors were analyzed by immunofluorescence in TLC and hippocampal CA1, CA3 and DG. Results Compared with Wistar rats, increased Y2R was observed both in the HIP and TLC of TRM on both mRNA levels(HIP:0.75±0.06vs. 0.51±0.07;TLC:0.70±0.05vs. 0.55±0.03,P<0.01) and protein level(0.79±0.08vs. 0.42±0.05;TLC:0.72±0.05vs. 0.51±0.07,P<0.01). However, the Y5R did not obviously change on either mRNA level(HIP:0.52±0.10vs. 0.54±0.06;TLC:0.46±0.03vs. 0.42±0.04,P>0.05)or protein level(HIP:0.28±0.06vs. 0.27±0.03;TLC:0.31±0.05vs. 0.27±0.07,P>0.05).Y2R and Y5R were localized throughout TRM brains, especially on the membranes of pyramidal cells and granule cells.Conclusions The expressions of Y2R increased in TRM HIP and TLC, but Y5R may not be involved in the activation of endogenously neuroprotective system mediated by NPY in TRM epileptogenesis.
epilepsy; NPY receptor; Y2R; Y5R; tremor rat
10.3969/j.issn.1006-2963.2015.02.007
国家自然科学基金青年基金资助项目(81001429)
110001中国医科大学附属第一医院神经内科 中国医科大学神经病学研究所(徐晓雪、杨军、赵久晗、张朝东);110001 中国医科大学药物毒理教研室(郭凤、王千慧、蔡际群)
徐晓雪,Email:xiaoxue80cn@sina.com
R742.1
A
1006-2963 (2015)02-0101-05
2014-07-04)
