蜂胶总黄酮滴丸的高分辨液质联用分析研究
2015-06-12王伟楠孙光伟隋殿军
王伟楠,孙光伟,隋殿军
(长春中医药大学,吉林 长春130117)
蜂胶总黄酮滴丸的高分辨液质联用分析研究
王伟楠,孙光伟,隋殿军*
(长春中医药大学,吉林 长春130117)
目的 阐明蜂胶总黄酮滴丸的主要化学物质基础。方法 利用高分辨液质联用技术对蜂胶总黄酮滴丸进行检测,通过对照品、分子量和质谱裂解规律对未知成分进行指认。结果 经过分析,确定蜂胶总黄酮滴丸的主要化学成分为:山奈酚、乔松素、3-O-乙酰基短松素、白杨素和高良姜素。结论 利用高分辨液质联用技术可以高效准确的在未知提取物中确认主要的化学成分,可以作为蜂胶总黄酮滴丸质量控制的有力手段。
蜂胶;总黄酮;高分辨液质联用;质量控制
蜂胶是一种珍贵的蜂产品,资源极为稀少,被誉为“紫色黄金”,其主要活性物质为总黄酮类化合物[1-2]。现代药理学实验表明[3-6],蜂胶总黄酮具有降压、止痛、舒张血管等作用,是非常重要的活性天然产物。蜂胶总黄酮滴丸是由蜂胶总黄酮制成的中药五类新药,对于冠心病、心绞痛具有较好的疗效[7-9]。然而其化学物质基础尚不明确,传统的高效液相方法在未知成分鉴定方面存在一定的局限性[10-11]。因此,本文利用高效液相-高分辨质谱联用技术(HPLC-HRMS)对蜂胶总黄酮滴丸进行系统的成分分析,通过对照品、分子量和质谱裂解规律对未知成分进行指认,为蜂胶总黄酮滴丸的质量控制提供依据。
1 实验材料
蜂胶购自安国药材市场,经长春中医药大学姜大成教授鉴定为蜂胶(Colla Apis.)。对照品山奈酚(110861-201310)、乔松素(111829-201102)、白杨素(111701-200501)、高良姜素(111699-200602)均购自中国食品药品检定研究院。高效液相用甲醇为色谱纯(Thermo scientific),甲酸为质谱纯(Sigma),其他化学试剂均为分析纯(北京化工厂)。Agilent 1260高效液相 (Agilent Technologies, USA)、Agilent 6520 Q-TOF 质谱仪(Agilent Technologies, USA);超纯水机(Millipore, USA);十万分之一分析天平(METTLER TOLEDO,USA);旋转薄膜蒸发仪(EYELA, Japan)真空干燥箱(上海一恒实验仪器总厂);FW177中草药粉碎机(天津市泰特仪器有限公司);药典筛(浙江上虞市五四仪器厂)。
2 实验方法
2.1 蜂胶总黄酮滴丸制剂工艺 蜂胶药材在4 ℃冷冻一段时间后,粉碎,加10倍量75%的乙醇回流提取2次,合并提取液,过滤;续滤液经减压浓缩后,在真空干燥箱中80 ℃烘干,得到蜂胶粗提物;取一定重量的粗提物,加100倍量氯仿:甲醇(10∶1)涅溶,用等体积1%的NaOH水溶液萃取2次,收集水层,用1%HCl溶液调节pH值=6,室温静置24 h,离心,收集沉淀,干燥,即得蜂胶总黄酮。
称取聚乙二醇6000 25 g,加热熔化,加入蜂胶总黄酮细粉,搅拌混匀,倾入保温管中,调节恒温装置,使药液在(95±1) ℃下滴入冷却过的甲基硅油中〔温度(10±1) ℃〕,将药丸倾入滤纸上,吸干甲基硅油,加入少量滑石粉,混匀,即得蜂胶总黄酮滴丸。
2.2 供试品溶液制备 取蜂胶总黄酮滴丸1 g,干燥、粉碎、精密加入甲醇20 mL,称定重量,超声处理60 min,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,0.22 μm滤膜过滤,备用。
2.3 对照品溶液的制备 精密称定山奈酚、乔松素、高良姜素、白杨素对照品适量,用甲醇溶解稀释成每1 mL含单体化合物各2 μmol/L的溶液,即为对照品溶液。
2.4 分析条件的选择
2.4.1 色谱条件 色谱柱:Agilent ZORBAX SB-AQ (4.6×250 mm,4.5 μm);流速:1.0 mL/min;柱温:30 ℃;进样量:10 μL;流动相A为0.1%甲酸/甲醇,B为0.1%甲酸/水,洗脱条件如下:0~110 min(35%~90% A),110~120 min(90%A)。
2.4.2 质谱条件 离子源:ESI;电离模式:Positive;喷雾器压力:30 psi;干燥气(N2)流速:9 L/min;干燥气温度:350 ℃;毛细管电压:3 500 V;碎裂电压:175 V;锥孔电压:65 V;质量检测范围(m/z):100-1200;数据分析软件:Agilent MassHunter Workstation software-Qualitative Analysis (version B.04.00, Build 4.0.479.5, Service Pack 3, Agilent Technologies, Inc. 2011)。
3 结果
通过HPLC-MS分析,我们发现蜂胶总黄酮滴丸的化学物质基础中主要包括5个含量较高的单体化合物。这5个化合物在本实验所采用的色谱条件下分离度较好,对于定性分析没有明显的干扰,利用质谱数据分析软件MassHunter Workstation software进行分子式计算,发现色谱峰1、2、4、5分别与已有文献报道的蜂胶中主要黄酮类物质山奈酚、乔松素、白杨素和高良姜素的分子式吻合,进一步通过标准品对照可以确定,色谱峰1为山奈酚,色谱峰2为乔松素,色谱峰4为白杨素,色谱峰5为高良姜素。实验结果见图1。
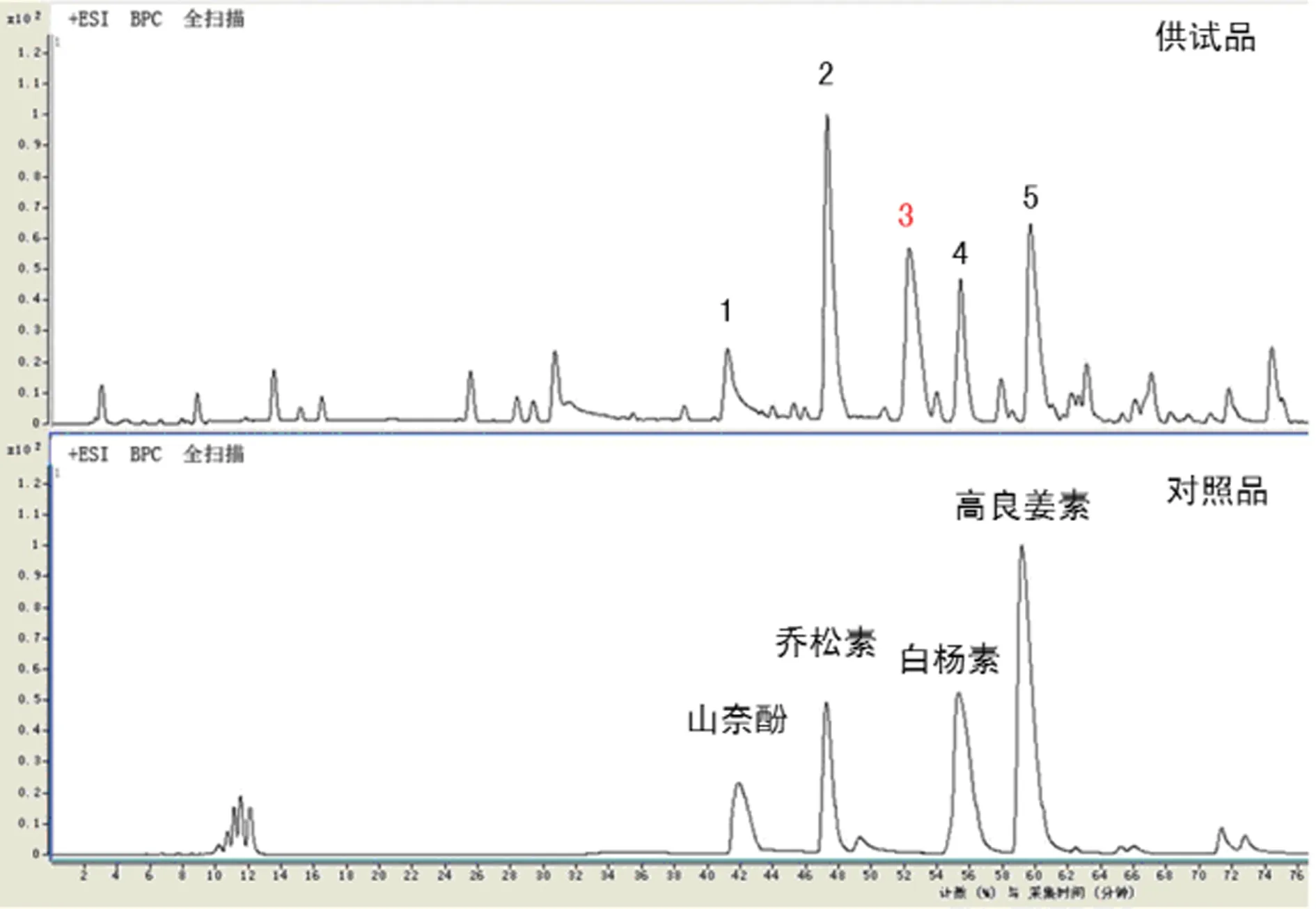
图1 供试品和对照品的质谱图
色谱峰3的分子量为315.1084,计算分子式为C16H14O5,其分子量和色谱行为与黄酮类化合物相似;通过进一步加大质谱碎裂电压,观察色谱峰3的碎片离子,构建了[M+H]+ m/z 315→273→255→227的碎裂规律。通过查阅大量蜂胶及黄酮类化合物液质联用分析的文献[12-17],确定该化合物的分子量、分子式以及质谱裂解规律与3-O-乙酰基短叶松素一致,因此,确定色谱峰3为3-O-乙酰基短叶松素。实验结果见图2、表1。
4 讨论
虽然目前在市场上有很多与蜂胶相关的健康产品,但产品的质量和开发程度参差不齐;绝大多数的产品仅仅是将蜂胶粗加工后简单包装以食品的形式出售,还有一些是将蜂胶中提取的活性成分开发成宝健食品或中药五类新药,蜂胶总黄酮滴丸就是这类产品的典型代表。本实验通过高分辨液质联用技术对蜂胶总黄酮滴丸的成分进行了系统的分析,从中指认出5个含量最高的黄酮类化合物,填补了蜂胶总黄酮滴丸物质基础研究的空白,为蜂胶总黄酮滴丸的作用机理研究和临床安全使用奠定了基础。

图2 色谱峰3的质谱裂解规律
表1 色谱峰指认

色谱峰编号保留时间m/z[M+H]+MSn[M+H]+计算分子式定性鉴别141.355287.0810165,153,121C15H10O6山奈酚247.403257.0854215,153,131C15H12O4乔松素352.508315.1084273,255,000C16H14O53⁃O⁃乙酰基短叶松素459.359255.0745209,153,129C15H10O4白杨素555.566271.0691165,153,105C15H10O5高良姜素
[1]周志龙.天然的绿色药品--蜂胶的医疗价值[J].吉林中医药,2003,23(5):51.
[2]徐响,张红城,董捷.蜂胶功效成分研究进展[J ] 食品工业科技,2008,29(9):286- 289.
[3]王元元,黄云英,杜娟,等.蜂蜜、蜂胶对深Ⅱ度烫伤大鼠创面愈合的影响[J].天津中医药大学学报,2012,31(3):154-156.
[4]王启海,梁枫,侯晞,等.蜂胶总黄酮对全脑缺血再灌注大鼠脑损伤的保护作用[J].长春中医药大学学报,2014,30(6):967-970.
[5]胡福良,玄红专.蜂胶的生物学活性及毒性和过敏反应[J].科技通报,2003,19(2):166-169.
[6]何晓波,周俐斐,芦柏震.蜂胶的药理活性[J].中国药业,2006,15(1):27-28.
[7]郭金昊,杨传华,王静,等.蜂胶总黄酮滴丸治疗慢性稳定性心绞痛气虚血瘀证疗效及安全性研究[J].吉林中医药,2015,35(9):893-896.
[8]许妍妍,张煜.蜂胶与冠心病心绞痛[J ] 吉林医学,2009,30(3):273-275.
[9]隋殿军.蜂胶总黄酮滴丸治疗心血管疾病的药效学及毒理学研究[C].//2009年传统医药国际科技大会论文集,2009:278-283.
[10]张翠平,胡福良.蜂胶中类黄酮化合物分析方法的研究进展[J].蜜蜂杂志,2010,30(3): 3-7.
[11]张翠平,柳刚,胡福良.液质联用在蜂胶质量控制研究中的应用[J].中国蜂业中旬刊(学术),2012(1):90-93,96.
[12]VOLPI N, BERGONZINI G. Analysis of flavonoids from propolis by on-line HPLC-electrospray mass spectrometry [J]. J Pharm Biomed Anal, 2006,42(3): 354-361.
[13]PELLATI F, ORLANDINI G, PINETTI D, et al. HPLC-DAD and HPLC-ESI-MS/MS methods for metabolite profiling of propolis extracts [J]. J Pharm Biomed Anal, 2011, 55(5):934-948.
[14]MIDORIKAWA K, BANSKOTA A H, TEZUKA Y, et al. Liquid chromatography-Mass spectrometry analysis of Propolis [J]. Phytochem Anal, 2001,12(6): 366-373.
[15]SORAIA I F, MIGUEL V B, LETICIA M E, et al. Phenolic characterization of northeast Portuguese propolis: usual and unusual compounds [J]. Anal Bioanal Chem, 2010, 396(2):887-897.
[16]贾艾玲,郑爱竹,王睿,等.不同地区蜂胶原料药的质量评价[J].辽宁中医杂志,2014, 41(2): 316-318.
[17]韩红祥,王维,陈雪松,等.应用HPLC-MS联用技术研究不同基源蜂胶指纹图谱[J].吉林中医药,2011,31(12):1221-1223.
HPLC-HRMS analysis of propolis total flavonoids dripping pills
WANG Weinan,SUN Guangwei,SUI Dianjun*
(Changchun University of Chinese Medicine, Jilin Changchun 130117)
Objective To elucidate the chemical basis for propolis total flavonoids dripping pills (PTFDP). Methods PTFDP were detected via HPLC-HRMS while determining unknown compounds through reference compounds, molecular weight and MS fragmentation rules. Results After analysis, the major components of PTFDP were determined to be kaempferol, pinocembrin, pinobanksin-3-O-acetate, galangin and chrysin. Conclusion HPLC-HRMS was proved to be effective and accurate in the characterization of main chemical components in unknown extracts. Hence this technology would be a promising strategy for the quality control of PTFDP.
propolis; total flavonoids; HPLC-HRMS; quality control
10.13463/j.cnki.jlzyy.2015.12.026
国家自然科学基金项目(81173543)。
王伟楠(1985-),男,博士研究生,讲师。主要从事中药化学研究。
R284.1
A
1003-5699(2015)12-1272-03
赵玉芝
2015-11-27)
*通信作者:隋殿军,教授,博士研究生导师,电子信箱-cnweinanwang@163.com
