盐酸小檗碱改善胰岛素抵抗与α7烟碱型乙酰胆碱受体相关性研究*
2015-06-06王定坤陆付耳王开富
邹 欣, 王定坤, 李 芬, 龚 菂, 陆付耳△, 王开富△
1华中科技大学同济医学院附属同济医院中西医结合研究所,武汉 4300302华中科技大学化学与化工学院,武汉 430074
盐酸小檗碱改善胰岛素抵抗与α7烟碱型乙酰胆碱受体相关性研究*
邹 欣1, 王定坤1, 李 芬2, 龚 菂1, 陆付耳1△, 王开富1△
1华中科技大学同济医学院附属同济医院中西医结合研究所,武汉 4300302华中科技大学化学与化工学院,武汉 430074
目的 观察盐酸小檗碱对α7烟碱型乙酰胆碱受体(α7 nAChR)的影响,进一步探讨盐酸小檗碱通过抗炎通路改善胰岛素抵抗的分子机制。方法 以3T3-L1脂肪细胞为研究对象,采用高糖加胰岛素诱导的方法建立胰岛素抵抗的细胞模型,分别给予广谱nAChR激动剂尼古丁(烟碱)、特异性α7 nAChR激动剂氯化胆碱、炎症激活物内毒素(LPS)和抗炎中药盐酸小檗碱及抗炎西药阿斯匹林处理,并设立相应的空白对照组,采用反转录聚合酶链反应(RT-PCR)方法检测成熟脂肪细胞中α7 nAChR mRNA的表达,用放射免疫方法检测细胞上清液中炎性细胞因子TNF-α、IL-1、IL-6的水平,并用免疫组织化学的方法检测α7 nAChR的蛋白表达。结果 经烟碱和氯化胆碱干预成熟脂肪细胞后,细胞中α7 nAChR mRNA表达水平与LPS、模型组比较均明显增加(均P<0.05),纯中药盐酸小檗碱干预后成熟脂肪细胞中α7 nAChR mRNA表达也明显增加,与LPS、模型组比较差异具有统计学意义(P<0.05);西药阿斯匹林也促进细胞中α7 nAChR mRNA的表达;上述4组α7 nAChR蛋白表达呈不同程度的增加,TNF-α、IL-1、IL-6等炎性细胞因子受到明显的抑制,与LPS、模型组比较差异具有统计学意义(P<0.05)。结论 两种激动剂、抗炎西药阿司匹林和抗炎中药盐酸小檗碱均能上调α7 nAChR mRNA和蛋白的表达,明显抑制炎性细胞因子分泌;盐酸小檗碱可能通过抗炎机制改善胰岛素抵抗。
盐酸小檗碱; 烟碱; α7烟碱型乙酰胆碱受体; 胰岛素抵抗; 胆碱能抗炎通路
有关炎症导致胰岛素抵抗(insulin resistance,IR)的分子机制研究进展快速,认为胰岛素和受体结合后通过两条途径将信号下传至效应器,其一为代谢通路,即炎症因子如TNF-α、IL-1、IL-6、急性期反应蛋白等经由远分泌和/或旁分泌能严重干扰胰岛素敏感细胞内胰岛素信号下传[INR/IRS(insulin receptor substrates)/PI3K通路],使糖、脂代谢利用受阻,主要表现为TNF-α、IL-1、IL-6等炎症因子通过激活IKKB使IRS1 307位丝氨酸磷酸化,阻断胰岛素信号通路,同时通过激活NF-κB而上调炎症因子进而诱发IR[1-3],因此认为TNF-α、IL-1、IL-6等炎症因子是导致IR的至关重要的因素。有关盐酸小檗碱改善胰岛素抵抗的分子机制阐述较多,但关于通过激活胆碱能抗炎通路,抑制炎性细胞因子改善胰岛素抵抗的相关报道较少,现将盐酸小檗碱通过抗炎机制改善胰岛素抵抗与α7烟碱型乙酰胆碱受体相关性研究报道如下。
1 材料与方法
1.1 实验材料
细胞系3T3-L1前脂肪细胞株购自中国科学院细胞库。DMEM培养液、胰蛋白酶、胎牛血清均购于美国Gibco公司;分化诱导剂1-甲基-3-异丁基黄嘌呤(1-methyl-3-isobuthylxanthine,IBMX)、地塞米松(Dex)、胰岛素(INS)均购自美国Sigma公司;用于提取RNA的Trizol禽类成髓细胞瘤病毒(AMV)反转录酶、Taq DNA聚合酶、三磷酸脱氧核糖核苷酸(dNTPs)、10×PCR缓冲液等均为日本TaKaRa公司生产;α7 nAChR抗体为博士德公司生产;盐酸小檗碱(批号:110713-200208,纯度:99.0%,购自中国药品生物制品检定所);烟碱(批号:130518,规格:20 mg/支,纯度:≥98%,购自西亚试剂公司);氯化胆碱(批号:20121026,纯度:98%~101.0%,购自国药集团化学试剂有限公司);阿司匹林(批号:J20080078,规格:100 mg,购自拜耳医药保健有限公司);细菌内毒素(LPS)(批号150601,规格:160 EU/支,购自中国食品药品检定研究院)。
1.2 细胞培养
在37℃、5% CO2的培养条件下,3T3-L1前脂肪细胞在含10%胎牛血清(FBS)的高糖DMEM培养液中培养,待细胞接触抑制2 d后开始诱导分化,用含0.5 mmol/L 3-异丁基-1-甲基黄嘌呤(IBMX)、1 μmol/L地塞米松、10 μg/mL胰岛素、10%FBS的高糖DMEM培养液培养48 h,之后换用10%FBS的高糖DMEM培养液培养,每2天换液1次,至诱导分化8~12 d,90%~95% 3T3-L1细胞呈脂肪细胞表型,表明诱导分化成熟可用于实验[4]。
1.3 细胞分组及干预
将诱导分化成熟的3T3-L1脂肪细胞用含0.2%BSA的高糖DMEM培养液培养12 h后分别换用含25 mmol/L葡糖糖、0.6 mmol/L胰岛素、1%BSA的高糖DMEM培养液培养18 h(设为模型组);另在用含25 mmol/L葡糖糖、0.6 mmol/L胰岛素、1%BSA的高糖DMEM培养液培养的细胞中分别加烟碱(6 μmol/L,烟碱组)、氯化胆碱(6 μmol/L,氯化胆碱组)、盐酸小檗碱(10 μmol/L,盐酸小檗碱组)、内毒素(LPS)(200 ng,LPS组)、阿斯匹林(35 μmol/L,阿斯匹林组)、罗格列酮(0.5 μmol/L,罗格列酮组),另设空白对照组(诱导分化成熟的3T3-L1脂肪细胞),共分8组[5]。
1.4 标本处理及指标检测
上述各组细胞培养24 h后分别收集细胞上清液采用ELISA的方法检测TNF-α、IL-1、IL-6等炎性细胞因子。收集一部分细胞按照TaKaRa公司Trizol试剂说明书提取细胞总RNA,按10 μL体系反转录成cDNA模板,用于PCR扩增。采用Premier5.0软件设计α7 nAChR和β-actin引物。α7 nAChR:上游5′-GCAAAGAGCCATACCCAG-3′,下游5′-TGATCTCAGCCACAAGCAG-3′;β-actin:上游5′-TCCTCCCTGGAGAAGAGCTA-3′,下游5′-TCAGGAGGAGCAATGATCTTG-3′。反应条件:94℃预变性5 min进入循环,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环,循环结束后72℃再延伸10 min,降至4℃。扩增产物经20 g/L琼脂糖凝胶电泳,用美国UVP凝胶成像分析管理系统对电泳谱带成像,结合quantity one软件分析,结果以目的基因与β-actin灰度比值行半定量分析。另一部分细胞经0.25%胰酶消化后置另一玻片上进行细胞爬片并用丙酮:甲醇(50:50)混合液固定30 min后自然晾干,用于免疫组织化学法检测α7 nAChR蛋白表达。按试剂盒说明书操作,荧光显微镜下切片背景为棕红色,阳性细胞胞质呈淡蓝或棕黄色,多为圆形或卵园形,内有蓝色的细胞核,高倍镜(20×10)下观察每张切片左上、右上、左下、右下和中央5个视野阳性细胞数,求出平均阳性细胞数和阳性细胞百分率并作统计学处理。
1.5 统计学处理
2 结果
2.1 各组3T3-L1脂肪细胞中α7 nAChR mRNA表达水平比较
经烟碱和氯化胆碱2种α7 nAChR激动剂干预后成熟脂肪细胞中α7 nAChR mRNA表达上调,凝胶电泳显示:在398 bp处PCR产物明显增多,与β-actin灰度比值明显增高,与LPS、模型组比较差异有统计学意义(均P<0.05);纯中药盐酸小檗碱干预后成熟脂肪细胞中α7 nAChR mRNA表达也明显增加,在398 bp处PCR产物明显增多,与LPS、模型组比较差异具有统计学意义(均P<0.05),结果见图1、表1。
2.2 各组3T3-L1脂肪细胞中α7 nAChR阳性细胞数及百分率的比较
烟碱、氯化胆碱、盐酸小檗碱和阿斯匹林组4组α7 nAChR蛋白表达表现为不同程度的增加,蓝色细胞颗粒增多,阳性细胞数明显高于其它组,与LPS、模型组比较差异具有统计学意义(图2、表2)。
2.3 各组细胞培养上清液中炎性细胞因子水平比较
烟碱、氯化胆碱、盐酸小檗碱和阿斯匹林4组细胞中TNF-α、IL-1、IL-6等炎性细胞因子不同程度地受到抑制,与LPS、模型组比较差异具有统计学意义(P<0.05或P<0.01),见表3。
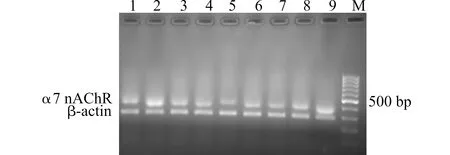
M:Marker;1:空白对照组;2:盐酸小檗碱组;3、4:模型组;5:LPS组;6:罗格列酮组;7:阿斯匹林组;8:氯化胆碱组;9:烟碱组
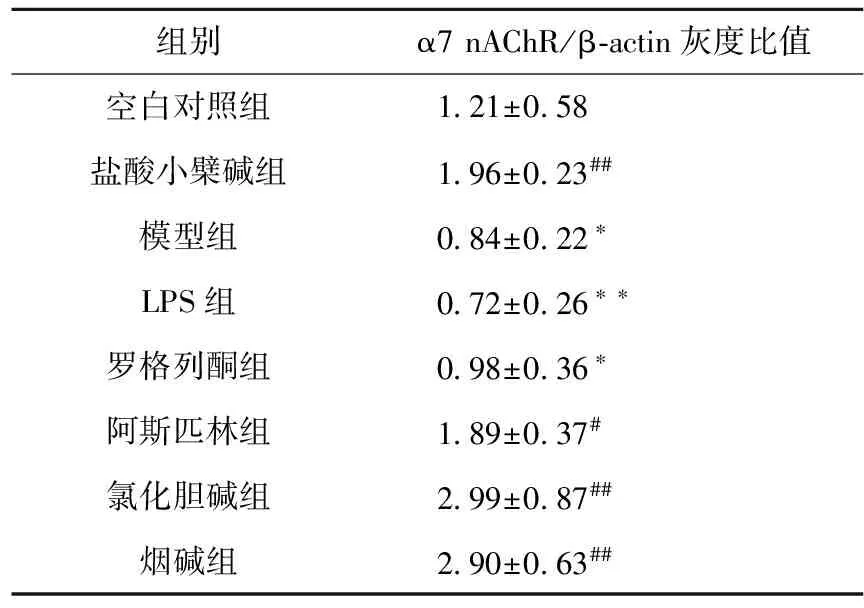
组别α7nAChR/β⁃actin灰度比值空白对照组1 21±0 58盐酸小檗碱组1 96±0 23##模型组0 84±0 22∗LPS组0 72±0 26∗∗罗格列酮组0 98±0 36∗阿斯匹林组1 89±0 37#氯化胆碱组2 99±0 87##烟碱组2 90±0 63##
与空白对照组比较,*P<0.05**P<0.01;与LPS、模型组比较,#P<0.05##P<0.01

A:烟碱组;B氯化胆碱组;C盐酸小檗碱组;D:LPS组;E:阿斯匹林组;F:模型组;G:罗格列酮组;H:空白对照组
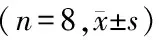
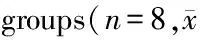

组别阳性细胞个数阳性细胞率(%)空白对照组178 80±41 3325 53±0 05烟碱组294 71±58 82∗∗##46 83±0 09∗∗##氯化胆碱组198 80±21 31##29 70±0 03#盐酸小檗碱组183 93±42 08##28 36±0 04LPS组112 50±31 36∗∗18 81±0 02∗∗阿斯匹林组173 40±30 47##24 93±0 07罗格列酮组157 50±53 17#22 45±0 07模型组132 50±31 36∗18 95±0 02∗∗
与空白对照组比较,*P<0.05**P<0.01;与LPS、模型组比较,#P<0.05##P<0.01
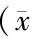
表3 3T3-L1脂肪细胞各组细胞培养上清液中炎性细胞因子水平±s,n=10)
与空白对照组比较,*P<0.05**P<0.01;与LPS、模型组比较,#P<0.05##P<0.01
3 讨论
2型糖尿病发病机制十分复杂,主要表现为胰岛素抵抗(insulin resistance,IR),即靶器官对胰岛素作用的敏感性下降。虽然IR与胰岛素分泌功能障碍存在相互关联,但目前认为“氧化应激”与“慢性炎症”是导致IR的主要因素。因此,观察纯中药盐酸小檗碱通过对胆碱能N受体α7亚基(α7 nAChR)mRNA和蛋白表达的影响从而抑制TNF-α、IL-1、IL-6等炎症细胞因子,探讨盐酸小檗碱通过抗炎通路改善胰岛素抵抗的分子机制。
体外建立IR细胞模型可用于筛选治疗IR的药物及探索药物改善IR的分子机制,建立3T3-L1脂肪细胞IR的模型是体外研究IR的最常用的模型之一,在体外3T3-L1前脂肪细胞具有定向分化为成熟脂肪细胞的特性。目前有多种方法可诱导3T3-L1脂肪细胞形成IR,如采用游离脂肪酸、地塞米松、肿瘤坏死因子等诱导3T3-L1脂肪细胞形成IR,此外还有研究表明通过模拟IR患者体内高糖高胰岛素状态也可诱导3T3-L1脂肪细胞形成IR[6],本研究选用后者建立3T3-L1脂肪细胞IR模型,并分别给予广谱nAChR激动剂尼古丁(烟碱)、特异性α7 nAChR激动剂氯化胆碱、炎症激活物内毒素(LPS)和抗炎中药盐酸小檗碱及抗炎西药阿斯匹林等干预模型细胞,实验结果显示:经烟碱和氯化胆碱干预后,成熟脂肪细胞中α7 nAChR mRNA表达水平均明显增加,无论抗炎西药阿司匹林还是抗炎中药盐酸小檗碱均可促进成熟脂肪细胞中α7 nAChR mRNA表达;免疫组化结果显示烟碱、氯化胆碱、盐酸小檗碱及阿司匹林4组细胞中α7 nAChR蛋白表达呈不同程度的增加,阳性细胞数和阳性细胞百分率均增加,ELISA检测TNF-α、IL-1、IL-6等炎性细胞因子受到明显的抑制,与模型组及LPS组比较差异具有统计学意义,表明2种抗炎药物对LPS没有直接抑制作用,其控制炎症反应可能是通过激活α7 nAChR受体而起作用,另表明α7 nAChR mRNA和蛋白质对控制炎症因子的表达十分重要。罗格列酮是临床上常用来改善胰岛素抵抗的药物,但该组对上述指标没有明显影响,表明其作用机制不是通过抗炎而发挥作用的。
“炎症学说”认为胰岛素和受体结合后通过2条途径将信号下传至效应器,其一为代谢通路,即炎症因子如TNF-α、IL-1、IL-6、急性期反应蛋白等经由远分泌和/或旁分泌能严重干扰胰岛素细胞内胰岛素信号下传[INR/IRS(insulin receptor substrates)/PI3K通路],使糖、脂代谢利用受阻,主要表现为TNF-α、IL-1、IL-6等炎症因子通过激活IKKB使IRS1 307位丝氨酸磷酸化,阻断胰岛素信号通路,同时通过激活NF-κB而上调炎症因子进而诱发IR[2-4],因此认为TNF-α、IL-1、IL-6等炎症因子是导致IR的至关重要的因素。
胆碱能抗炎通路是新近发现的一种神经-免疫调节通路,其潜在的药物作用靶点是α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7 nAChR)[7]。Tracey等[8]结合自己的研究成果提出了胆碱能抗炎通路,认为迷走神经的主要递质乙酰胆碱(acetylcholine,ACh)和其受体是胆碱能抗炎通路的重要组成部分,该通路主要内容是:迷走神经释放的递质ACh结合巨噬细胞表面的α7 nAChR,激活细胞膜α7 nAChR,可以抑制促炎细胞因子的合成和释放,从而发挥减轻组织和/或器官炎症损伤的作用。胆碱能神经递质的受体主要有毒蕈碱样受体(M胆碱受体)和烟碱样受体(N胆碱受体)两大类。α7 nAChR是属于N胆碱受体的一个亚型,在机体内广泛存在。在胆碱能抗炎通路中,α7 nAChR是ACh的作用靶点,是迷走神经实现炎症调节作用的核心,更是有效的潜在药理学作用靶点,有研究证明3T3-L1脂肪细胞中存在α7 nAChR并可被烟碱和氯化胆碱激活[9],本研究结果除与文献报道吻合之外,我们还进一步观察了盐酸小檗碱不仅能促进IR的3T3-L1脂肪细胞中α7 nAChR mRNA和蛋白的表达而且还能抑制细胞分泌TNF-α、IL-1、IL-6等炎症因子,抗炎中药盐酸小檗碱是否通过激活α7 nAChR阻止炎症因子的表达而改善胰岛素抵抗、促进细胞对葡萄糖的吸收利用尚有待后续进一步研究。
[1] 周媛,刘保林,唐宁,等.胰岛素抵抗的炎症机制及治疗研究进展[J].海峡医药,2008,20(4):10-13.
[2] Doi Y,Kiyohara Y,Kubo M,et al.Elevated C-recative protein is a predictor of the development of diabetes in a general Japanese population:the Hisayama Study[J].Diabetes Care,2005,28(10):2479-2500.
[3] Hirabara S M,Gorjão R,Vinolo M A,et al.Molecular targets related to inflammation and insulin resistance and potential interventions[J].J Biomed Biotechnol,2012:379024.
[4] Nelson B A,Robinson K A,Buse M G.High glucose and glucosamine induce insulin resistance via different mechanisms in 3T3-L1 adipocytes[J].Diabetes,2000,49(6):981-999.
[5] 易屏,陆付耳.小檗碱对3T3-L1胰岛素抵抗细胞模型PI3K p85蛋白表达的影响[J].世界华人消化杂志,2008,16(19):2102-2106.
[6] Buren J,Liu H X,Lauritz J,et al.High glucose and insulin in combination cause insulin receptor substrate-1 and-2 depletion and protein kinase Bdesensitisation in primary cultured rat adipocytes:possible impicatons for inslin resitance in type 2 diabetes[J].Eur J Endocrinol,2003,148(1):157-167.
[7] 陈基快,倪敏,沈甫明.治疗炎性疾病的新靶点-α7烟碱型乙酰胆碱受体[J].第二军医大学学报,2012,33(8):897-899.
[8] Tracey K J.Physiology and immunology of the cholinergic anti-inflammatory pathway[J].J Clin Invest,2007,117(2):289-296.
[9] 梁晓燕,胡秀芬,卢慧玲,等.3T3-L1前脂肪细胞中烟碱样乙酰胆碱受体A7对脂肪因子肾上腺髓质素mRNA表达的影响[J].实用儿科临床杂志,2008,23(19):1484-1487.
(2015-06-01 收稿)
Berberine Hydrochloride Improves Insulin Resistance by Upregulating the Expression of α7 Nicotinic Acetylcholine Receptor
Zou Xin1,Wang Dingkun1,Li Fen2etal
1InstituteofIntegratedTraditionalChineseandWesternMedicine,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China2SchoolofChemistryandChemicalEngineering,HuazhongUniversityofScienceandTechnology,Wuhan430074,China
Objective To examine the molecular mechanism of berberine hydrochloride improving insulin resistance through the anti-inflammatory pathway by observing the effects of berberine hydrochloride on α7 nicotinic acetylcholine receptor(α7 nAChR).Methods Insulin-resistant 3T3-L1 adipocyte models were established by using high glucose and insulin induction.Cells were treated by a broad-spectrum nAChR agonist nicotine,a specific α7 nAChR agonist choline chloride,an inflammatory activator lipopolysaccharide(LPS)and a traditional Chinese medicine berberine hydrochloride and a Western medicine asprin with anti-inflammatory property,respectively.Corresponding blank control groups were set up as well.Reverse transcription polymerase chain reaction(RT-PCR)was used to detect the expression of α7 nAChR mRNA,radioimmunoassay(RIA)to detect the levels of inflammatory cytokines TNF-α,IL-1 and IL-6 in cell supernatant,and immunohistochemical method to detect the expression of α7 nAChR protein.Results The α7 nAChR mRNA expression level was obviously increased in cells treated with nicotine or choline chloride when compare with blank control group and other groups(P<0.05).The expression of α7 nAChR mRNA was also significantly increased in 3T3-L1 adipocytes after treatment with the traditional Chinese medicine berberine hydrochloride and there was significant difference when compared with LPS and model groups(P<0.05).Asprin also promoted the expression of α7 nAChR mRNA in 3T3-L1 adipocytes.Immunohistochemical results showed that the expression levels of α7 nAChR protein were increased to varying degrees in nicotine,choline chloride,berberine hydrochloride and asprin groups.Inflammatory cytokines such as TNF-α,IL-1,IL-6 were obviously suppressed in these groups.Significant difference was noted in the expression levels of α7 nAChR and inflammatory cytokines levels between the four groups and LPS or model group(P<0.05).Conclusion The broad-spectrum nAChR agonist nicotine,the specific α7 nAChR agonist choline chloride,asprin and berberine hydrochloride with anti-inflammatory property can regulate the expression of α7 nAChR at mRNA and protein levels,significantly suppress the secretion of inflammatory cytokines.Berberine hydrochloride can obviously improve insulin resistance through anti-inflammatory mechanism.
berberine hydrochloride; nicotine; α7 nicotinic acetylcholine receptor(α7 nAchR); insulin resistance; cholinergic anti-inflammatory pathway
*国家自然科学基金资助项目(No.81373872);湖北省自然科学基金资助项目(No.2012FFBO2516)
R587
10.3870/j.issn.1672-0741.2015.05.007
邹 欣,男,1975年生,主管技师,E-mail:zouxingqx@sina.com
△通讯作者,Corresponding author,E-mail:felu@tjh.tjmu.edu.cn(陆付耳);wkf58@163.com(王开富)
