姜黄素联合吉西他滨对胰腺癌细胞体外增殖、凋亡及肿瘤干细胞表型特征的影响*
2015-06-06李德民
许 琮, 夏 超, 李德民, 常 莹, 赵 秋,2△
1华中科技大学同济医学院附属同济医院消化内科,武汉 4300302武汉大学中南医院消化内科,武汉 430071
论 著
姜黄素联合吉西他滨对胰腺癌细胞体外增殖、凋亡及肿瘤干细胞表型特征的影响*
许 琮1, 夏 超1, 李德民1, 常 莹1, 赵 秋1,2△
1华中科技大学同济医学院附属同济医院消化内科,武汉 4300302武汉大学中南医院消化内科,武汉 430071
目的 研究联合使用姜黄素及吉西他滨对胰腺癌细胞增殖、凋亡及肿瘤干细胞表型特征的影响,初步评价姜黄素治疗胰腺癌的临床应用前景。方法 采用恶性程度、分化程度不同的胰腺癌细胞系panc03.27、Capan-2及PANC-1细胞,分为DMSO处理组、单纯吉西他滨处理组、单纯姜黄素处理组以及吉西他滨联合姜黄素处理组,采用CCK8(Cell Counting Kit-8)试剂盒测定细胞增殖力的改变;同时采用FITC Annexin V凋亡检测试剂盒分析不同处理组之间细胞凋亡率的差异,利用Western blot检测胰腺癌干性基因Notch1及Oct4的表达改变。结果 Panc03.27细胞中与单纯使用吉西他滨比较,联合使用姜黄素组细胞活力由(46.70±3.49)%下降为(35.53±1.84)%(P=0.047),细胞凋亡率由(5.01±0.75)%上升至(13.11±0.89)%(P<0.01),Notch1及Oct4表达明显下调(均P<0.01);Capan-2细胞中与单纯使用吉西他滨比较,联合使用姜黄素组细胞活力由(47.13±2.39)%下降至(5.36±0.25)%(P<0.01),细胞凋亡率由(13.02±1.79)%上升至(20.11±1.11)%(P<0.01),而Notch1及Oct4表达未见明显差异;PANC-1细胞中与单纯使用吉西他滨比联合使用姜黄素组细胞活力由(82.59±5.69)%下降至(7.33±0.25)%(P<0.01),细胞凋亡率由(6.77±2.03)%上升至(25.08±3.14)%(P<0.01),Notch1及Oct4表达明显下调(P<0.05)。结论 姜黄素可协同吉西他滨抑制胰腺癌细胞的增殖、诱导细胞的凋亡及抑制肿瘤干细胞表型特征。
胰腺癌; 姜黄素; 吉西他滨; 联合用药
胰腺癌是一种预后极差、致死性极高的恶性肿瘤,多数患者诊断时早已发生远处转移,吉西他滨虽然是治疗进展期胰腺癌的一线化疗药物,但由于存在原发或继发耐药性,其临床疗效仍较差[1]。因难以寻找到新型、低毒、高效的抗肿瘤药物,故如何进行胰腺癌的联合化学治疗是当前研究的方向之一。姜黄素(Curcumin)是一种从姜科植物的根茎姜黄中提取的植物多酚,参与多种生物学调控过程,我们既往的研究发现,姜黄素能够阻断TGF-β1诱导的PANC-1细胞的上皮间质转化(epithelial-mesenchymal transition,EMT)过程从而抑制其侵袭转移[2]。肿瘤细胞中存在一类特殊细胞群体——肿瘤干细胞(cancer stem cells,CSCs),具有自我更新和多向分化潜能,有助于肿瘤细胞产生化疗抗性以适应不同的微环境[3]。多种信号通路及相关基因参与了肿瘤干细胞的调控过程,其中Octamer-binding transcription factor 4(OCT4)是控制胰腺癌干细胞自我更新及分化的关键基因[4],而Notch信号通路作为控制细胞增殖、凋亡的重要通路,在多种肿瘤包括胰腺癌的干细胞表型调控中亦发挥关键作用[5]。值得注意的是,已经有报道称Notch1及Oct4等基因的表达与胰腺癌吉西他滨的耐药性有关[6-8]。本研究采用胰腺癌常见的恶性程度较高的细胞株PANC-1、panc03.27及Capan-2,探讨姜黄素协同吉西他滨抑制胰腺癌细胞的增殖、促进细胞凋亡及抑制肿瘤干细胞表型的作用,探索临床治疗胰腺癌更有效的化疗方案。
1 材料与方法
1.1 材料
人胰腺癌细胞株PANC-1及Capan-2细胞购自中国科学院上海生命科学研究院细胞资源中心,panc03.27购自ATCC细胞库。其中PANC-1细胞采用DMEM培养液,Capan-2细胞及panc03.27细胞采用RPMI 1640培养液,所有细胞均使用10%的胎牛血清(美国Gibco公司)、1%青-链霉素培养液培养。本实验所采用的姜黄素购自Sigma公司,以DMSO溶解配制储存液,浓度为30 mmol/L;吉西他滨购自Cayman公司,以0.9%生理盐水配制为终浓度20 mmol/L,-20℃长期保存。Notch1、Oct4及GAPDH等抗体购自美国CST公司。
1.2 细胞分组及处理
PANC-1、Capan-2及panc03.27细胞随机分为4组处理:①DMSO对照处理组;②吉西他滨处理组:以20 μmol/L药物终浓度处理细胞;③姜黄素处理组:以20 μmol/L药物终浓度处理细胞;④姜黄素联合吉西他滨处理组:分别加入终浓度20 μmol/L的姜黄素及20 μmol/L的吉西他滨药物。所有细胞加药后常规培养24 h。
1.3 细胞增殖实验
采用CCK-8检测试剂盒(武汉启动子生物有限公司)检测,以5 000个/孔细胞量接种96孔板贴壁后,在上述4组不同药物处理的细胞中加入CCK-8试剂,按说明书操作,计算450 nm吸光度值(A),细胞活力(cell viability)=(A实验组-A空白组)/(A对照组-A空白组)×100%。
1.4 细胞凋亡实验
采用BD公司的FITC Annexin V凋亡检测试剂盒检测,以3×105个/孔细胞量接种于6孔板,细胞贴壁后,给予上述4组不同药物处理24 h后,使用不含EDTA的胰酶消化细胞,按说明书操作,利用流式细胞仪检测细胞凋亡率,实验重复3次。
1.5 Western blot检测
以1.5×105接种不同的胰腺癌细胞于6孔板中,细胞贴壁后给予上述4组药物处理24 h,用含PMSF的NP-40裂解细胞提取总蛋白,BCA法测定细胞浓度,加入4×十二烷基硫酸钠上样缓冲液后100℃水浴5 min,蛋白变性后-80℃冰箱保存。以50 μg蛋白量上样,行聚丙烯酰胺凝胶电泳2 h后,聚偏氟乙烯(PVDF)膜转印2 h,并以5%脱脂牛奶封闭1 h,孵育Notch1、Oct4及GAPDH等抗体4℃过夜,隔天洗膜,敷二抗,最后使用增强化学发光(ECL)法显影。
1.6 统计学分析
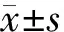
2 结果
2.1 姜黄素协同吉西他滨抑制胰腺癌细胞的增殖
利用CCK-8检测试剂盒检测细胞增殖水平的改变,以DMSO处理组为对照,我们发现:①panc03.27细胞中,吉西他滨处理组细胞活力为(46.70±3.49)%,姜黄素处理组细胞活力为(63.87±3.98)%,吉西他滨联合姜黄素处理组细胞活力为(35.53±1.84)%,联合使用吉西他滨及姜黄素对细胞增殖的抑制作用与单独使用吉西他滨药物处理差异具有统计学意义(P=0.047);②Capan-2细胞中,吉西他滨处理组细胞活力为(47.13±2.39)%,姜黄素处理组细胞活力为(24.54±2.96)%,吉西他滨联合姜黄素处理组细胞活力为(5.36±0.25)%,联合使用吉西他滨及姜黄素抑制效率比单独使用吉西他滨对细胞活力的抑制效率明显(P<0.01);③PANC-1细胞中,吉西他滨处理组细胞活力为(82.59±5.69)%,姜黄素处理组细胞活力为(52.35±10.63)%,吉西他滨联合姜黄素处理组细胞活力为(7.33±0.25)%,联合使用吉西他滨及姜黄素比单独使用吉西他滨明显抑制细胞的增殖(P<0.01)。见图1。
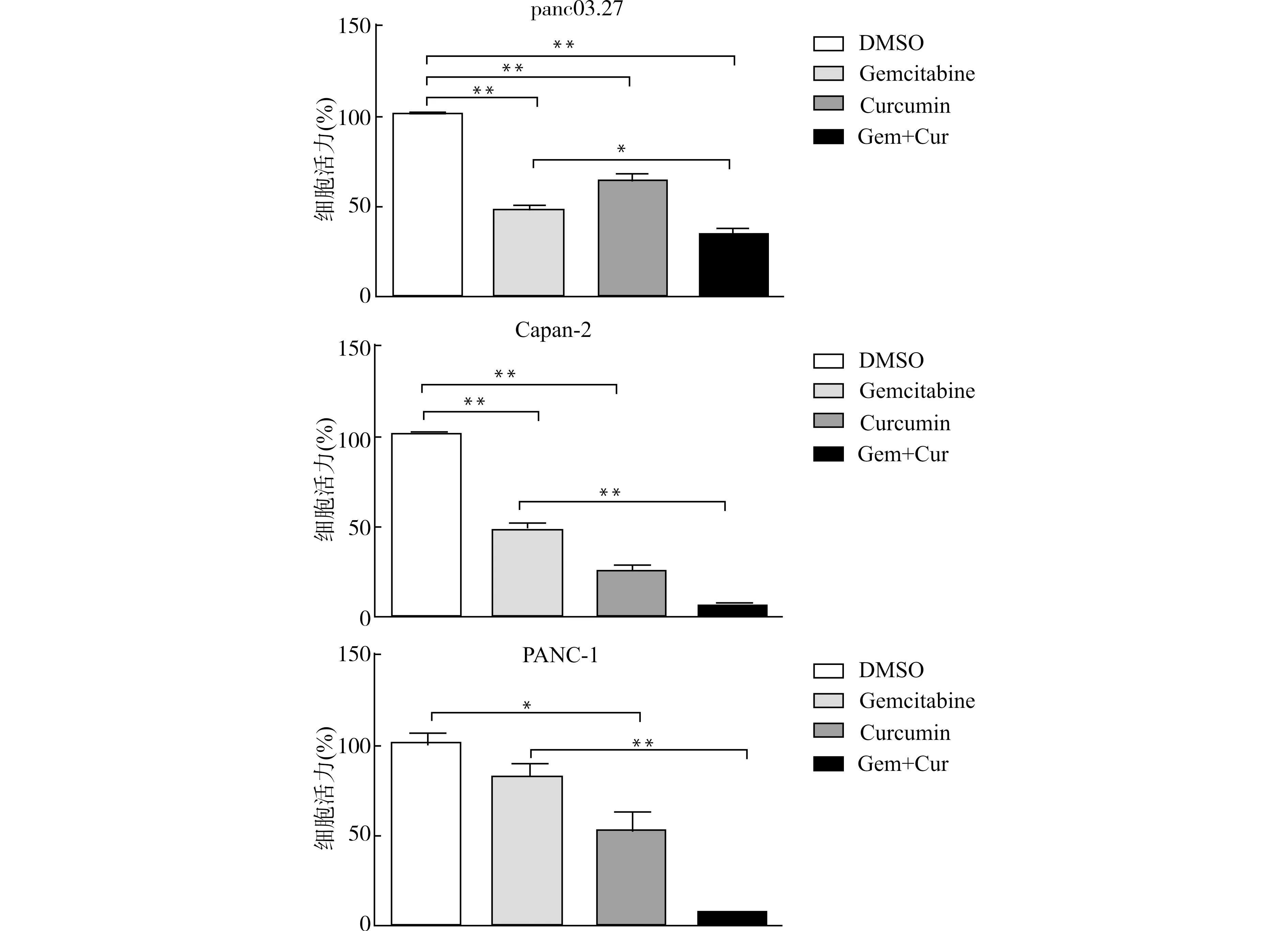
*P<0.05 **P<0.01
2.2 姜黄素协同吉西他滨促进胰腺癌细胞的凋亡
利用FITC Annexin V凋亡检测试剂盒检测上述药物对胰腺癌细胞凋亡率的影响发现:①panc03.27细胞中,DMSO处理组细胞凋亡率为(1.09±2.28)%,吉西他滨处理组细胞凋亡率为(5.01±0.75)%,姜黄素处理组细胞凋亡率为(3.01±1.28)%,而联合使用吉西他滨及姜黄素组细胞凋亡率为(13.11±0.89)%,比单用吉西他滨处理的细胞凋亡增加明显(P<0.01);②Capan-2细胞中,DMSO处理组细胞凋亡率为(2.01±1.67)%,吉西他滨处理组细胞凋亡率为(13.02±1.79)%,姜黄素处理组细胞凋亡率为(14.99±0.93)%,联合使用吉西他滨及姜黄素处理细胞后凋亡率为(20.11±1.11)%,比单用吉西他滨促进细胞凋亡的效果显著(P<0.01);③PANC-1细胞中,DMSO处理组细胞凋亡率为(3.42±2.98)%,吉西他滨处理组细胞凋亡率为(6.77±2.03)%,姜黄素处理组细胞凋亡率为(19.84±3.90)%,联合使用吉西他滨及姜黄素处理组细胞凋亡率为(25.08±3.14)%,比单用吉西他滨后细胞的凋亡率增加(P<0.01)。见图2(实验重复3次,图2为1次的流式检测结果)。
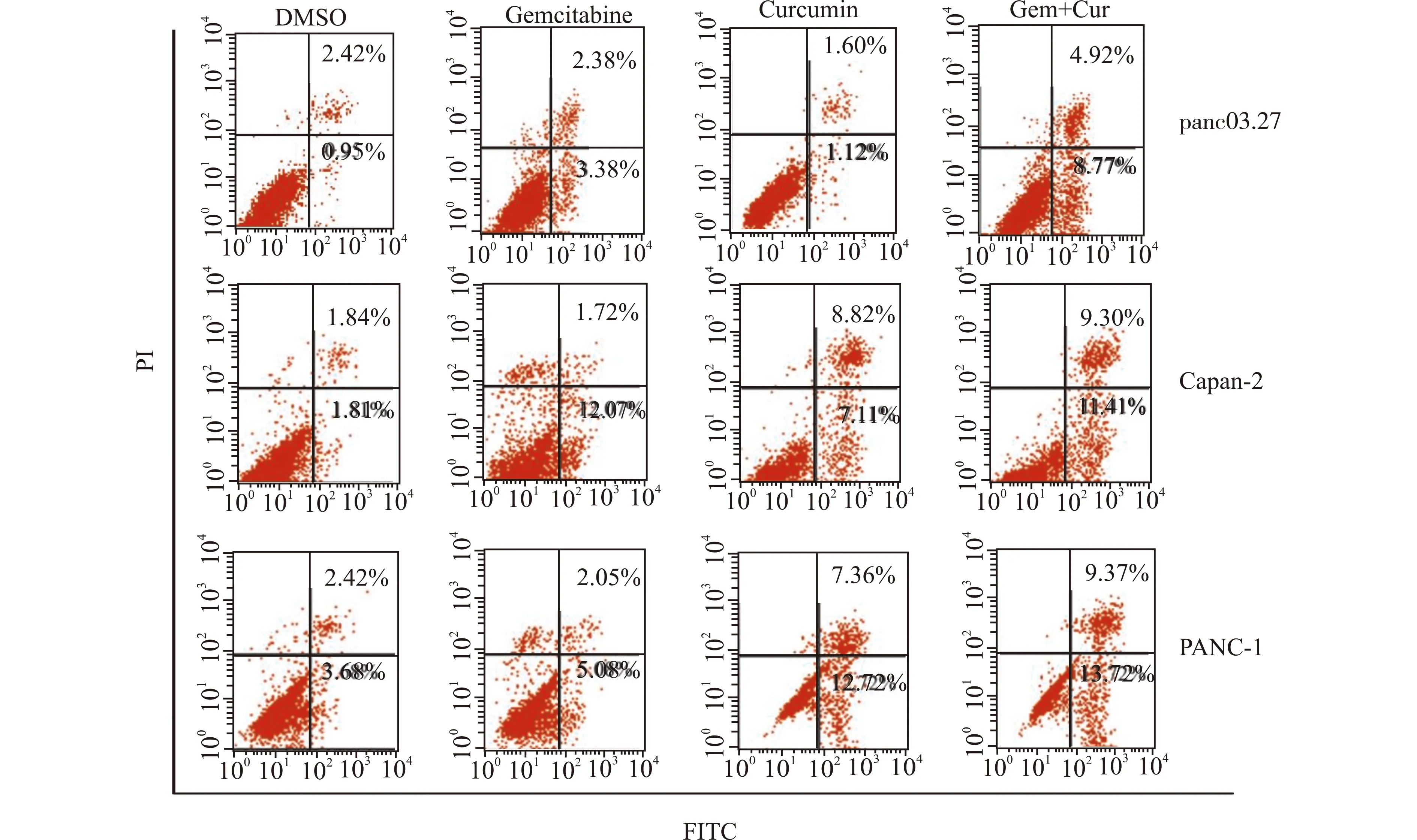
图2 吉西他滨、姜黄素及吉西他滨联合姜黄素处理胰腺癌细胞后凋亡率的变化Fig.2 Changes of the apoptosis rate of pancreatic cancer cells treated with gemcitabine and curcumin alone or combined
2.3 吉西他滨联合姜黄素抑制胰腺癌干细胞表型特征
Western blot检测联合应用姜黄素及吉西他滨对胰腺癌干细胞表型特征的影响(图3),利用Image J软件对结果进行灰度分析后我们发现:①panc03.27细胞中,Notch1的表达量在4组细胞中分别为(0.227±0.034),(0.581±0.027),(1.146±0.044)及(0.029±0.036),说明单用吉西他滨及姜黄素后Notch1的表达量都有所上调,而联合应用吉西他滨和姜黄素可在一定程度上抑制单用吉西他滨对Notch1表达上调的影响(P<0.01);而Oct4在4组细胞中的表达量分别为(0.354±0.076),(0.573±0.095),(0.316±0.120)及(0.187±0.067),说明单用吉西他滨及姜黄素分别可以上调和下调Oct4的表达,联合使用2种药物则可以明显抑制Oct4的表达(P<0.01)。②Capan-2细胞中,Notch1的表达量在4组细胞中分别为(1.130±0.076),(1.431±0.093),(1.613±0.143)及(1.720±0.023),单用吉西他滨及姜黄素后细胞Notch1的表达均有所上调,然而联合用药后Notch1的表达也依然上调,差异并无统计学意义(P>0.05);而Oct4的表达量在4组细胞中分别为(0.450±0.124),(0.404±0.063),(1.145±0.057)及(0.872±0.048),说明Oct4蛋白在单用吉西他滨后表达下调,却在单用姜黄素后表达明显上调,联合用药后表达却依然上调,故不能说明联合用药能够抑制Capan-2细胞的CSC表型特征。③PANC-1细胞中,Notch1的表达量在4组细胞中分别为(0.798±0.067),(1.081±0.073),(0.641±0.094)及(0.694±0.112),说明单用吉西他滨后Notch1表达上调而单用姜黄素则Notch1的表达则下调,联合用药后则明显抑制Notch1的表达,差异具有统计学意义(P=0.049);Oct4在4组细胞中的表达量分别为(0.931±0.073),(0.967±0.083),(0.677±0.079)及(0.766±0.096),说明单用吉西他滨和姜黄素后分别上调和下调Oct4的表达,且联合用药后Oct4表达明显下调,差异具有统计学意义(P<0.01)。
3 讨论
过去的几十年内尽管对肿瘤的治疗提出了很多新的方式方法,但是针对胰腺癌的治疗仍未取得明显的进展。即使肿瘤发现及时且早期阶段即行手术切除,这类患者仍有大约80%的概率因为复发或转移而死于胰腺癌,平均术后生存期不足2年[9]。胰腺癌的预后如此之差除了因为肿瘤本身容易发生侵袭转移外,还很大程度上与对常见化疗药物存在一定的耐药性有关。肿瘤干细胞(CSCs)是一群具有自我更新及多向分化潜能的细胞,被认为参与肿瘤发展、复发、转移及化疗抗性等多种过程[10],而胰腺癌中CSCs的作用也相继被人们所发现[11]。如同其他生物学过程一样,肿瘤干细胞表型的控制有多种信号通路及基因参与,包括Notch1、Hedegehog、CXCR4及Oct4等[12]。
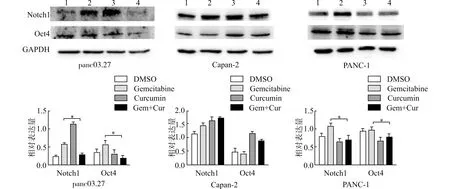
1:DMSO;2:Gemcitabine;3:Curcumin;4:Gem+Cur;*P<0.05
吉西他滨是胰腺癌的一线化疗药物,但是仅仅不到10%的胰腺癌患者对吉西他滨有效应[13]。虽然很多年前人们就已经提出几种化疗药物联合应用可以有效对抗肿瘤,但是在胰腺癌中联合化疗方案一直未能取得令人满意的结果,于是人们将对抗肿瘤的化疗方向拓展到中草药成分后发现,很多类似姜黄素、槲皮素[14]等植物成分提取物可以起到很好的抑癌效果。有报道发现,姜黄素联合环氧化物酶-2(COX-2)抑制剂塞来昔布可以明显抑制胰腺癌细胞的生长[15],此外尚有研究发现姜黄素可改变胰腺癌细胞中microRNA的表达[16]从而发挥其生物学调控作用,这些研究都预示着姜黄素很可能在联合化疗方案中起到很好的抗癌作用。
本实验研究选取恶性程度不同、分化程度不同的胰腺癌panc03.27、Capan-2及PANC-1细胞系,根据我们以往的研究结果[17-19],选取合适的药物作用浓度即20 μmol/L的姜黄素及20 μmol/L的吉西他滨,分为DMSO对照组、吉西他滨处理组、姜黄素处理组以及吉西他滨联合姜黄素处理组。检测不同处理组接受药物作用24 h后细胞增殖、凋亡及干性基因(Notch1及Oct4)等表达的变化,以分析吉西他滨联合姜黄素是否可以很好地促进肿瘤细胞的凋亡、抑制其增殖,更重要的是减少化疗抗性及复发的可能。
结果发现:①对于panc03.27细胞,单用吉西他滨或单用姜黄素处理均可以明显抑制细胞的增殖,但细胞凋亡率则未有明显差异,检测Notch1表达均有上调趋势,而Oct4的表达在姜黄素处理组仅有一定程度的下调,而在联合用药后,细胞的增殖明显受抑制、凋亡明显增加、Notch1及Oct4的表达下调。②对于Capan-2细胞而言,吉西他滨或姜黄素处理组细胞增殖明显受抑制,细胞凋亡明显增加,Notch1表达均有所上调,而Oct4的表达改变不甚明显,联合用药后抑制增殖、促凋亡作用明显,却在Notch1及Oct4的表达中与单纯使用吉西他滨组未见有明显差异,说明联合用药在Capan-2细胞中对CSC表型特征的调控方面可能未有明显临床意义。③对于PANC-1细胞,这一恶性程度较高化疗耐药性强的细胞,传统的吉西他滨并不能很好地抑制细胞增殖、促进细胞凋亡,联合使用姜黄素后则能够明显抑制细胞的增殖、凋亡,同时明显下调Notch1及Oct4的表达。
吉西他滨主要作用机制为抑制核苷酸还原酶活性,从而影响DNA合成引起细胞凋亡,而对药物所介导的凋亡过程不敏感是导致化疗耐药的重要原因之一[20]。多数胰腺癌细胞中往往存在NF-κB及COX-2等参与细胞凋亡信号通路的不断活化[21-22]。而有研究发现,姜黄素主要通过抑制NF-κB、COX-2、及EGFR等的表达发挥作用[23-24],因此协同使用姜黄素可以改善细胞对吉西他滨产生的凋亡信号通路的耐受性。肿瘤干细胞作为导致化疗抗性的重要原因之一,本研究首次利用联合用药方案检测与胰腺癌吉西他滨化疗抗性相关的干性基因Notch1及Oct4的表达改变,发现除了Capan-2细胞,联合应用姜黄素比单独使用吉西他滨可以更好地抑制肿瘤干性特征,或者一定程度上恢复对干性基因的上调作用,进而推测其可能带来好的临床应用前景,其具体机制及体内实验有待进一步研究探索。
[1] Shevchenko I,Karakhanova S,Soltek S,et al.Low-dose gemcitabine depletes regulatory T cells and improves survival in the orthotopic Panc02 model of pancreatic cancer[J].Int J Cancer,2013,133(1):98-107.
[2] 庞慧芳,覃华,赵秋,等.姜黄素对胰腺癌细胞上皮间质转化的影响[J].世界华人消化杂志,2014,22(18):2565-2571.
[3] Xia J,Chen C,Chen Z,et al.Targeting pancreatic cancer stem cells for cancer therapy[J].Biochim Biophys Acta,2012,1826(2):385-399.
[4] Lin H,Sun L H,Han W,et al.Knockdown of OCT4 suppresses the growth and invasion of pancreatic cancer cells through inhibition of the AKT pathway[J].Mol Med Rep,2014,10(3):1335-1342.
[5] Bao B,Wang Z,Ali S,et al.Notch-1 induces epithelial-mesenchymal transition consistent with cancer stem cell phenotype in pancreatic cancer cells[J].Cancer Lett,2011,307(1):26-36.
[6] Du X,Zhao Y P,Zhang T P,et al.Notch1 contributes to chemoresistance to gemcitabine and serves as an unfavorable prognostic indicator in pancreatic cancer[J].World J Surg,2013,37(7):1688-1694.
[7] Quint K,Tonigold M,Di Fazio P,et al.Pancreatic cancer cells surviving gemcitabine treatment express markers of stem cell differentiation and epithelial-mesenchymal transition[J].Int J Oncol,2012,41(6):2093-2102.
[8] Wang D,Zhu H,Zhu Y,et al.CD133(+)/CD44(+)/Oct4(+)/Nestin(+)stem-like cells isolated from Panc-1 cell line may contribute to multi-resistance and metastasis of pancreatic cancer[J].Acta Histochem,2013,115(4):349-356.
[9] Humphris J L,Johns A L,Simpson S H,et al.Clinical and pathologic features of familial pancreatic cancer[J].Cancer,2014,120(23):3669-3675.
[10] Visvader J E,Lindeman G J.Cancer stem cells:current status and evolving complexities[J].Cell Stem Cell,2012,10(6):717-728.
[11] Castellanos J A,Merchant N B,Nagathihalli N S.Emerging targets in pancreatic cancer:epithelial-mesenchymal transition and cancer stem cells[J].Onco Targets Ther,2013,6:1261-1267.
[12] Zhan H X,Xu J W,Wu D,et al.Pancreatic cancer stem cells:new insight into a stubborn disease[J].Cancer Lett,2015,357(2):429-437.
[13] Burris H A 3rd,Moore M J,Andersen J,et al.Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer:a randomized trial[J].J Clin Oncol,1997,15(6):2403-2413.
[14] Zhou W,Kallifatidis G,Baumann B,et al.Dietary polyphenol quercetin targets pancreatic cancer stem cells[J].Int J Oncol,2010,37(3):551-561.
[15] Lev-Ari S,Zinger H,Kazanov D,et al.Curcumin synergistically potentiates the growth inhibitory and pro-apoptotic effects of celecoxib in pancreatic adenocarcinoma cells[J].Biomed Pharmacother,2005,59(Suppl 2):S276-S280.
[16] Sun M,Estrov Z,Ji Y,et al.Curcumin(diferuloylmethane)alters the expression profiles of microRNAs in human pancreatic cancer cells[J].Mol Cancer Ther,2008,7(3):464-473.
[17] 杨芳,赵秋,王渝,等.姜黄素抑制STAT3信号通路对胰腺癌细胞增殖的影响[J].世界华人消化杂志,2011,19(30):3149-3157.
[18] 柯晓煜,王渝,谢祚启,等.LY294002联合吉西他滨对胰腺癌PANC-1细胞p-Akt和MRP表达的影响[J].世界华人消化杂志,2011,19(36):3678-3681.
[19] 侯伟,覃华,刘南植,等.姜黄素对缺氧条件下HepG2细胞VEGF表达的影响[J].世界华人消化杂志,2008,16(20):2234-2238.
[20] Wang Z,Li Y,Ahmad A,et al.Pancreatic cancer:understanding and overcoming chemoresistance[J].Nat Rev Gastroenterol Hepatol,2011,8(1):27-33.
[21] Arlt A,Gehrz A,Muerkoster S,et al.Role of NF-kappaB and Akt/PI3K in the resistance of pancreatic carcinoma cell lines against gemcitabine-induced cell death[J].Oncogene,2003,22(21):3243-3251.
[22] 李旭,江建新,王敏,等.慢病毒介导Vimentin基因沉默抑制胰腺癌细胞侵袭和粘附的机制[J].华中科技大学学报:医学版,2013,42(3):247-253.
[23] Wang W,Abbruzzese J L,Evans D B,et al.The nuclear factor-kappa B RelA transcription factor is constitutively activated in human pancreatic adenocarcinoma cells[J].Clin Cancer Res,1999,5(1):119-127.
[24] Lev-Ari S,Starr A,Vexler A,et al.Inhibition of pancreatic and lung adenocarcinoma cell survival by curcumin is associated with increased apoptosis,down-regulation of COX-2 and EGFR and inhibition of Erk1/2 activity[J].Anticancer Res,2006,26(6b):4423-4430.
(2015-05-18 收稿)
Synergistic Effect of Curcumin plus Gemcitabine Combination Therapy on the Proliferation,Apoptosis and Cancer Stem Cell Phenotype of Pancreatic Cancer Cells
Xu Cong,Xia Chao,Li Deminetal
DepartmentofGastroenterology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Objective To investigate the effect of combination therapy with curcumin and gemcitabine on the proliferation,apoptosis and cancer stem cell phenotype of pancreatic cancer cells in order to preliminarily examine the application potential of curcumin to the treatment of pancreatic cancer.Methods Human pancreatic cancer cell lines of different malignancy and differentiation,panc03.27,Capan-2 and PANC-1,were used in this study.They were divided into DMSO group,gemcitabine treatment group,curcumin treatment group and gemcitabine+curcumin treatment group in terms of different treatments.Cell counting Kit-8 assay and flow cytometry were employed to detect the proliferation activity and apoptosis rate of these pancreatic cancer cells,respectively.The protein expression of genes associated with cancer stem cells(Notch1 and Oct4)was measured by Western blot.Results Comparison of the proliferation and apoptosis between the single gemcitabine group and the combination group found that,in panc03.27 cells,the cell viability was reduced from(46.70±3.49)% to(35.53±1.84)%(P=0.047),the apoptosis rate was increased from(5.01±0.75)% to(13.11±0.89)%(P<0.01)and the expression levels of Notch1 and Oct4 were suppressed(P<0.01);in Capan-2 cells,the cell viability was reduced from(47.13±2.39)% to(5.36±0.25)%(P<0.01),the apoptosis rate was increased from(13.02±1.79)% to(20.11±1.11)%(P<0.01),and the expression levels of Notch1 and Oct4 were not significantly different;in PANC-1 cells,the cell viability was reduced from(82.59±5.69)% to(7.33±0.25)%(P<0.01),the apoptosis rate was increased from(6.77±2.03)% to(25.08±3.14)%(P<0.01),and the expression levels of Notch1 and Oct4 were suppressed(P<0.05).Conclusion Curcumin can synergistically inhibit the proliferation,promote the apoptosis of pancreatic cancer cells,and suppress the phenotype of cancer stem cells when used with gemcitabine.
pancreatic cancer; curcumin; gemcitabine; combination therapy
*国家自然科学基金青年基金资助项目(No.81302112)
R735.9
10.3870/j.issn.1672-0741.2015.05.001
许 琮,女,1987年生,博士研究生,E-mail:cheryl_9@163.com
△通讯作者,Corresponding author,E-mail:zhaoqiu@medmail.com.cn
