一水草酸钙晶体介导巨噬细胞炎症反应的体外研究*
2015-06-06吴柏霖李森茂
吴柏霖, 李森茂, 胡 嘏, 余 虓
华中科技大学同济医学院附属同济医院泌尿外科,武汉 430030
一水草酸钙晶体介导巨噬细胞炎症反应的体外研究*
吴柏霖, 李森茂, 胡 嘏, 余 虓△
华中科技大学同济医学院附属同济医院泌尿外科,武汉 430030
目的 研究一水草酸钙晶体(calcium oxalate monohydrate,COM)引起的不同表型巨噬细胞的炎症反应。方法 在大鼠草酸钙结石模型中研究肾脏巨噬细胞的浸润情况,明确是否存在肾脏炎症。体外分离培养小鼠骨髓源巨噬细胞,流式细胞仪鉴定其细胞表面标志。将巨噬细胞体外分化为M1和M2,Real-time PCR鉴定细胞标志。Real-time PCR检测COM及损伤标志分子ATP对巨噬细胞IL-1β表达的影响,ELISA法检测其IL-1β的分泌。结果 在大鼠草酸钙结石模型肾脏切片中,可见大量巨噬细胞浸润,显著多于对照大鼠。体外分离小鼠巨噬细胞,流式细胞仪鉴定表面标志符合巨噬细胞表型,Real-time PCR鉴定M1和M2的标志也符合其相应表型。M1高表达IL-1β、CCL2,低表达MR、ARG;M2高表达MR、ARG,低表达IL-1β、CCL2。COM及其损伤分子ATP均可使M1高表达IL-1β。结论 在草酸钙大鼠模型中,巨噬细胞浸润明显,COM和ATP可加重巨噬细胞炎症,并可加重M1的促炎症作用。
一水草酸钙; 巨噬细胞; 肾结石; 炎症反应
尿石症是泌尿外科临床上最常见的疾病之一。尿石症治疗后易复发,5~10年的复发率为50%,20年的复发率为75%[1-2],且复发过的患者再发结石的可能性更大[3]。草酸钙是最常见的泌尿系结石成分,其中最为多见的是一水草酸钙晶体(calcium oxalate monohydrate,COM),高草酸尿被认为是草酸钙结石形成最重要的危险因素[4]。
单核-巨噬细胞是固有免疫的重要组成部分[5],是人体对抗病原体的第一道防线。现研究发现,巨噬细胞存在不同的表型。根据巨噬细胞激活方式发挥效应的T淋巴细胞的不同,可分为M1和M2两型[6]。M1为经典激活途径的巨噬细胞,激活TH1淋巴细胞或NK细胞,从而杀伤病原体。与此相反,M2应答于TH2淋巴细胞分泌的IL-4[7]。M2具有更强的吞噬能力,并抑制炎症反应。总而言之,M1具有促进炎症反应的作用,M2发挥着清除寄生虫,免疫抑制,促进组织修复等功能。
肾结石不仅由电解质代谢异常引起,同样有基因水平的改变,亦是机体免疫系统参与的综合性疾病。Okada等[8-10]对草酸钙结石模型小鼠的研究发现,在肾结石形成和清除过程中,肾脏组织内均存在巨噬细胞浸润,并且巨噬细胞相关基因(如glpcan3,Mpeg1,Lgals3,Ccl6,Vim,Spp1,Ccl2,Fn1等)表达增加。巨噬细胞标志Emr1与这些基因的表达水平存在线性关系[9-10]。Ghazali等[11]发现粒巨噬细胞集落刺激因子(GM-CSF)通过激活外周血单核细胞与含钙结石的形成、高钙尿和骨钙损失有关。De Water等[12]认为巨噬细胞可能参与草酸钙结石的清除。因此,本研究拟在体外应用COM晶体作用于巨噬细胞,研究COM对不同表型巨噬细胞的影响及其炎症状态。
1 材料与方法
1.1 主要材料与试剂
SD大鼠和C57BL/6小鼠均购自华中科技大学同济医学院实验动物学部。Anti-mouse F4/80-APC(ebioscience),anti-mouse CD11b-APC(Abgent),anti-mouse CD11c-APC(Abgent),anti-mouse CD68 antibody(Abcam),鼠IL-1β ELISA试剂盒(R&D),鼠CCL2 ELISA试剂盒(博士德),TAKARA SYBR®Premix Ex TaqTM试剂盒(宝生物),TAKARA PrimeScript®RT reagent Kit(宝生物),Trizol(Life technologies)。
1.2 草酸钙结石大鼠模型的构建
SD大鼠每2只1笼,每日饮用1%乙二醇溶液;4周后,处死大鼠,获取大鼠肾脏,Von Kossa染色显示肾脏草酸钙晶体,CD68免疫组化染色显示肾脏巨噬细胞浸润。
1.3 Von Kossa染色
石蜡包埋后的肾脏组织经切片置于载玻片上,在细胞超净工作台的紫外灯下,用2%硝酸银水溶液浸染1 h,使用5%硫代硫酸钠溶液浸泡2 min双蒸水漂洗3遍,0.1%核固红染液染色5 min,常规脱水、透明,封片。镜下见草酸钙晶体呈黑色或棕黑色。
1.4 CD68免疫组化检测
肾脏组织常规切片。3%双氧水漂洗切片5 min,将切片置于0.01 mol/L枸橼酸缓冲液内,电磁炉煮沸,反复2遍,PBS漂洗2遍。室温下5% BSA封闭30 min,在切片上加稀释好的一抗(CD68),4℃孵育过夜,TBS漂洗3遍,滴加结合生物素的山羊抗兔二抗,室温孵育30 min,TBS漂洗3遍,滴加SABC-AP,室温孵育30 min,TBS漂洗4遍,稀释好显色液,滴加至切片,室温孵育15 min,双蒸水漂洗2遍,核固红复染,双蒸水漂洗,常规封片,置于显微镜下观察。
1.5 小鼠骨髓源巨噬细胞(BMDM)体外培养
颈椎脱臼处死小鼠,浸于75%乙醇内消毒15 min。眼科剪剪开双侧后肢皮肤,分离后肢肌肉,剪下双侧胫骨和股骨,PBS内充分漂洗,剪去骨周围软组织。剪去长骨两端,胰岛素针冲出其内骨髓,冲至盛有BMDM培养液(RPMI 1640培养液+10% FBS)的培养皿内。将培养皿内液体转移至50 mL离心管内,15 mL注射器大力吹打,将骨髓完全吹散,300 g离心5 min,弃上清,以含有20 ng/mL M-CSF的RPMI 1640+10%FBS诱导培养液重悬,细胞计数,按1×106种于10 cm培养皿内,及2×105种于6孔板内,4×104种于24孔板内,每2天更换诱导培养液,换液时收集旧培养液并离心取沉淀,将离心下的细胞重新平均种回培养皿和培养板,约第3天细胞贴壁,至第7天细胞完全贴壁。
1.6 BMDM诱导分化为M1和M2
BMDM培养7 d后,更换培养液分别诱导M1、M2,细胞更换BMDM培养液继续培养,细胞为M0;更换M1诱导培养液(BMDM培养液+1 μg/mL LPS+20 ng/mL IFN-γ),细胞为M1;更换为M2诱导培养液(BMDM培养液+10 ng/mL IL-4+10 ng/mL IL-13),细胞为M2,持续培养48 h。
1.7 流式细胞术鉴定BMDM表面标志
0.5%胰蛋白酶消化BMDM 5 min,BMDM培养液终止消化,离心并收集1 × 106个细胞,PBS漂洗后离心,用PBS重悬1% BSA,按工作浓度稀释F4/80、CD11b、CD11c流式抗体,分别使用流式抗体孵育BMDM细胞15 min,流式细胞仪检测相应抗原表达。
1.8 PCR检测不同表型巨噬细胞标志
Trizol法提取细胞总RNA,经逆转录为cDNA,Real-time PCR检测细胞标志的表达。变性95℃,退火60℃,延伸72℃。引物见表1。

表1 Real-time PCR引物序列
1.9 小鼠IL-1β ELISA检测
配制800 pg/mL小鼠IL-1β标准液,并倍比稀释至浓度为400、200、100、50、25、12.5 pg/mL。在酶标板中加入各浓度IL-1β标准液以及待测样品,室温孵育2 h。倾去板内液体,400 μL洗涤液洗板4遍。每孔加入200 μL IL-1β结合物,室温孵育2 h。倾去板内液体,400 μL洗涤液洗板4遍。每孔加入底物结合物200 μL,避光室温孵育30 min。每孔加入50 μL反应终止液1,孔内颜色由蓝变黄。使用酶标仪记录波长450 nm处A值,绘制IL-1β浓度标准曲线,并计算待测样品IL-1β浓度。
1.10 COM的制备
将20 mmol/L草酸钠溶液5 mL与20 mmol/L氯化钙溶液5 mL等体积混合,立即产生白色沉淀,置于37℃温箱中充分反应过夜,3 000 r/min离心5 min,弃上清,无菌双蒸水重悬,3 000 r/min离心5 min,弃上清,超净细胞工作台风干。
1.11 COM及ATP处理BMDM
1 mmol/L COM及5 mmol/L ATP处理M1和M2细胞,PCR检测细胞炎症因子的表达,ELISA法检测M1细胞因子IL-1β的表达。
1.12 统计学分析
实验数据以均数±标准差表示,使用SPSS 12.0软件进行t检验和单因素方差分析,以P< 0.05为差异有统计学意义。
2 结果
2.1 大鼠肾脏组织染色
如图1所示,大鼠在饮用1%乙二醇4周后,肾脏切片Von Kossa染色,在高倍镜下见肾小管内黑色晶体沉着,如箭头所示。草酸钙晶体主要分布在肾脏髓质及皮髓质交界区,在圆形或管形肾小管内见黑色的晶体沉着,肾脏结构无明显变化。
CD68是巨噬细胞的表面标志,约95%的巨噬细胞高表达CD68,因此,CD68常用于检测巨噬细胞,并定位巨噬细胞。对照大鼠未应用1%乙二醇,肾脏切片内几乎未见巨噬细胞浸润,肾脏结构完好;草酸钙模型大鼠肾脏切片可在肾脏肾小管间及肾小球内见棕色染色,提示巨噬细胞浸润,草酸钙结石模型大鼠的肾脏内巨噬细胞显著多于对照大鼠,提示模型大鼠肾脏非特异性炎症更加严重。
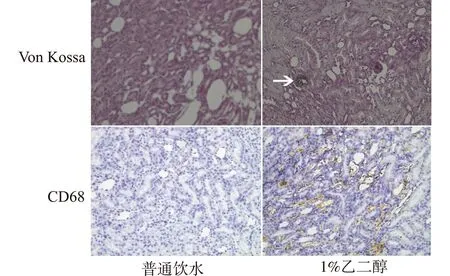
箭头示草酸钙晶体
2.2 BMDM流式鉴定
BMDM分化为成熟的巨噬细胞后,细胞高表达F4/80、CD11b,而低表达CD11c。如图2所示,细胞表达F4/80为86.76%,CD11b表达为99.34%,CD11c表达为4.82%,符合巨噬细胞高表达F4/80、CD11b,低表达CD11c的特点。因此,经原代分离培养的细胞为小鼠骨髓源巨噬细胞。
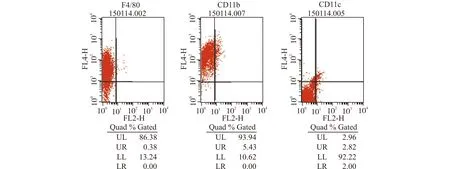
图2 流式细胞仪鉴定巨噬细胞表面标志F4/80、CD11b、CD11c的表达Fig.2 Flow cytometry analysis of F4/80,CD11b,and CD11c expression on macrophages
2.3 Real-time PCR检测BMDM特异性基因的表达
如图3所示,以M0作为对照,计算M1和M2相对M0的基因表达量。M1细胞IL-1β相对M0表达为(61.133±5.560)倍,M2 IL-1β相对M0表达为(1.513±0.671)倍,二者间差异有统计学意义(P<0.05);M1 CCL2表达相对M0为(13.727±4.051)倍,M2 CCL2相对M0表达为(1.760±0.426)倍,二者间差异有统计学意义(P<0.05);M1 MR表达相对M0为(0.200±0.082)倍,M2 MR相对M0表达为(6.503±2.054)倍,二者间差异有统计学意义(P<0.05);M1 ARG表达相对M0为(0.650±0.238)倍,M2 ARG相对M0表达为(13.583±3.697)倍,二者间差异有统计学意义(P<0.05)。
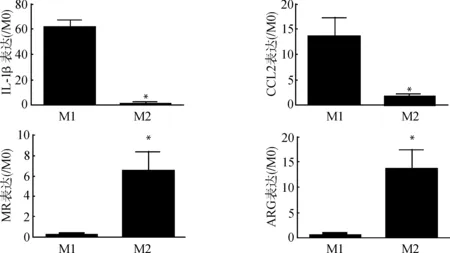
与M1比较,*P<0.05
2.4 COM对巨噬细胞炎症反应的影响
如图4所示,M1的IL-1β相对M0表达约为(61.133±5.560)倍,M1与COM培养24 h后,IL-1β表达约为M0的(92.540±12.257)倍,与M1差异有统计学意义(P<0.05);ATP是细胞损伤后释放的产物,同时亦是巨噬细胞的强致炎物,作为阳性对照,IL-1β表达约为M0的(110.583±13.715)倍,与M1差异有统计学意义(P<0.05),与M1+COM组无统计学差异(P>0.05)。M2对COM及ATP反应不明显,对IL-1β的表达无影响。
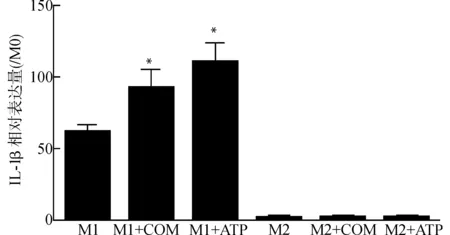
与M1比较,*P<0.05
为进一步研究COM对M1细胞的致炎作用,收集M1、M1+COM、M1+ATP 3组的细胞培养上清,ELISA检测IL-1β浓度。
如图5所示,1 mmol/L COM晶体培养M1 24 h,ATP作为阳性对照,未受COM刺激的M1的IL-1β浓度为(31.810±4.264)pg/mL,COM处理组的IL-1β浓度(65.550±10.803)pg/mL,显著高于M1,差异有统计学意义(P<0.05);ATP组的IL-1β浓度为(83.813±7.887)pg/mL,显著高于M1,差异有统计学意义(P<0.05),但与COM组相比差异无统计学意义(P>0.05)。实验结果提示COM具有促进M1分泌IL-1β的作用,并促进炎症反应。

与M1比较,*P< 0.05
3 讨论
CD68是巨噬细胞的表面标志,通过免疫组化等手段可标记出全体巨噬细胞,但其无法区分出巨噬细胞的不同表型。在草酸钙结石大鼠模型中,大鼠肾脏中不仅出现草酸钙晶体的沉积,同时也出现了肾脏内巨噬细胞聚集,并显著多于对照大鼠,提示巨噬细胞的聚集及其发挥的功能可能与草酸钙晶体的形成有关。有研究发现,利用clodronate liposomes清除体内的巨噬细胞,可在草酸钙结石小鼠模型中大幅减少草酸钙晶体的形成[13]。亦有研究证实CSF-1(即M-CSF)与草酸钙结石形成有关,CSF-1缺陷小鼠同样可引起肾脏内草酸钙晶体形成减少[14],CSF-1的缺失,可减少体内的非特异性炎症反应,提示炎症反应与草酸钙晶体在肾脏的形成密切相关。
F4/80是小鼠巨噬细胞的表面标志,CD11b和CD11c也是常用的巨噬细胞鉴定用表面标志,通常巨噬细胞CD11b高表达,而CD11c低表达,因此,F4/80、CD11b、CD11c一起即可在体外鉴定巨噬细胞。为鉴定不同的巨噬细胞表型,需使用额外的表面标志进行鉴定,M1高表达iNOS、MHC class Ⅱ等,M2高表达巨噬细胞清道夫受体(MSR)、清道夫受体(CD163)、甘露糖受体(mannose receptor,MR、CD206)等。因此可用于进一步鉴定巨噬细胞表型。研究发现,巨噬细胞可相互转化,但可能同样在细胞成熟初期就可形成两种细胞亚型,即在体内有不同的细胞因子分别促使不同亚型的巨噬细胞成熟。CSF-1即M-CSF,研究发现CSF-1更倾向于使细胞向M2分化,GM-CSF则倾向于使巨噬细胞分化为M1[14]。M1倾向于分泌IL-1β、IL-6、TNF-α、CCL2等促炎因子,而M2倾向于分泌IL-10、arg-1等抑制炎症的细胞因子。因此,GM-CSF及M-CSF可能与上述细胞因子的分泌直接相关。
ATP由于细胞的损伤,可释放至细胞外,不仅作为细胞的能量分子,ATP还是细胞的强致炎物质,触发IL-1β的最终剪切成熟,是炎症反应中IL-1β成熟并发挥生理功能的最后一步,因此,ATP具有极强的诱导炎症反应的作用。本研究发现,COM诱导M1分泌IL-1β的能力与阳性对照ATP相似,因此,COM同样为M1的强致炎物质。而COM和ATP却无法诱导M2分泌IL-1β,提示COM及ATP无法诱导M2发生向M1的转化。有研究发现,COM同样可激活树突状细胞的炎性体NLRP3,并介导IL-1β的最终剪切成熟[13]。M1和M2分泌IL-1β上的差异,可能是由于巨噬细胞缺乏LPS及IFN-γ的刺激,因此炎症反应的形成有赖于M1细胞的参与。
[1] Sutherland J W,Parks J H,Coe F L.Recurrence after a single renal stone in a community practice[J].Miner Electrolyte Metab,1985,11(4):267-269.
[2] Trinchieri A,Ostini F,Nespoli R,et al.A prospective study of recurrence rate and risk factors for recurrence after a first renal stone[J].J Urol,1999,162(1):27-30.
[3] Strauss A L,Coe F L,Deutsch L,et al.Factors that predict relapse of calcium nephrolithiasis during treatment:a prospective study[J].Am J Med,1982,72(1):17-24.
[4] Jaeger P,Robertson W G.Role of dietary intake and intestinal absorption of oxalate in calcium stone formation[J].Nephron Physiol,2004,98(2):64-71.
[5] Gordon S,Martinez F O.Alternative activation of macrophages:mechanism and functions[J].Immunity,2010,32(5):593-604.
[6] Gordon S,Taylor P R.Monocyte and macrophage heterogeneity[J].Nat Rev Immunol,2005,5(12):953-964.
[7] Stein M,Keshav S,Harris N,et al.Interleukin 4 potently enhances murine macrophage mannose receptor activity:a marker of alternative immunologic macrophage activation[J].J Exp Med,1992,176(1):287-292.
[8] Okada A,Nomura S,Higashibata Y,et al.Successful formation of calcium oxalate crystal deposition in mouse kidney by intraabdominal glyoxylate injection[J].Urol Res,2007,35(2):89-99.
[9] Okada A,Yasui T,Fujii Y,et al.Renal macrophage migration and crystal phagocytosis via inflammatory-related gene expression during kidney stone formation and elimination in mice:Detection by association analysis of stone-related gene expression and microstructural observation[J].J Bone Miner Res,2010,25(12):2701-2711.
[10] Okada A,Yasui T,Hamamoto S,et al.Genome-wide analysis of genes related to kidney stone formation and elimination in the calcium oxalate nephrolithiasis model mouse:detection of stone-preventive factors and involvement of macrophage activity[J].J Bone Miner Res,2009,24(5):908-924.
[11] Ghazali A,Fuentes V,Desaint C,et al.Low bone mineral density and peripheral blood monocyte activation profile in calcium stone formers with idiopathic hypercalciuria[J].J Clin Endocrinol Metab,1997,82(1):32-38.
[12] De Water R,Noordermeer C,Houtsmuller A B,et al.Role of macrophages in nephrolithiasis in rats:an analysis of the renal interstitium[J].Am J Kidney Dis,2000,36(3):615-625.
[13] Mulay S R,Kulkarni O P,Rupanagudi K V,et al.Calcium oxalate crystals induce renal inflammation by NLRP3-mediated IL-1 beta secretion[J].J Clin Invest,2013,123(1):236-246.
[14] Taguchi K,Okada A,Kitamura H,et al.Colony-stimulating factor-1 signaling suppresses renal crystal formation[J].J Am Soc Nephrol,2014,25(8):1680-1697.
(2015-05-29 收稿)
COM-mediated Inflammation Response of MacrophagesInVitro
Wu Bolin,Li Senmao,Hu Jiaetal
DepartmentofUrology,TongjiHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Objective To examine the calcium oxalate monohydrate(COM)-induced inflammation response of macrophages with different phenotypes.Methods The infiltration of macrophages was evaluated in the rat model of calcium oxalate stone to confirm the inflammation in the kidney.The mouse bone marrow derived macrophages were isolatedinvitroand identified by flow cytometry.The macrophages were allowed to differentiate into M1 and M2invitroand their markers identified by real-time PCR.The effect of COM and ATP on the expression of IL-1β was detected by real-time PCR and the secretion of IL-1β by ELISA.Results A greater number of macrophages were found infiltrating the kidney tissues in the rat model of calcium oxalate stone.Flow cytometry confirmed that the surface markers of cells isolated from the mouse were consistent with those of macrophages.Real-time PCR showed that the markers of M1 and M2 were in accordance with the phenotypes of M1 and M2.M1 over-expressed IL-1β and CCL2,and down-expressed MR and ARG.The expression levels of the four molecules in M2 were on the contrary to those in M1.COM and ATP could induce the secretion of IL-1β by M1.Conclusion In the rat model of calcium oxalate stone,the macrophages infiltrate the kidney tissues obviously.COM and ATP exacerbate the inflammation response of macrophages and the M1-induced inflammation.
calcium oxalate monohydrate; macrophage; kidney stone; inflammation
*国家自然科学基金资助项目(No.81000292)
R692.4
10.3870/j.issn.1672-0741.2015.05.002
吴柏霖,男,1989年生,博士研究生,E-mail:noitamina@163.com
△通讯作者,Corresponding author,E-mail:yujiuhu@163.com
