乙酰唑胺对戊四氮致慢性癫痫大鼠海马水通道蛋白4表达的影响*
2015-06-06周玉波王林杰胡景鑫雷水生朱晓琴
陈 丽, 余 涵, 周玉波, 马 猛, 王林杰, 胡景鑫, 雷水生, 朱晓琴△
1广州医科大学基础学院,广州 5114362广州医科大学附属第五医院皮肤美容科,广州 510700
乙酰唑胺对戊四氮致慢性癫痫大鼠海马水通道蛋白4表达的影响*
陈 丽1, 余 涵1, 周玉波1, 马 猛1, 王林杰1, 胡景鑫1, 雷水生2△, 朱晓琴1△
1广州医科大学基础学院,广州 5114362广州医科大学附属第五医院皮肤美容科,广州 510700
目的 观察乙酰唑胺(acetazolamide,AZA)对戊四氮(pentylenetetrazole,PTZ)致慢性癫痫大鼠发作及海马水通道蛋白4(aquaporin-4,AQP4)表达的影响,探讨其抗癫痫的可能机制。方法 将实验大鼠随机分为4组:对照组(每日腹腔注射生理盐水)、致痫组[每日腹腔注射亚惊厥剂量PTZ 35 mg/(kg·d)建立慢性癫痫大鼠模型]、乙酰唑胺干预组[每日先腹腔注射AZA 35 mg/(kg·d)预处理,30 min后再腹腔注射亚惊厥剂量PTZ]和乙酰唑胺对照组[每日单纯腹腔注射AZA]。各组采用以上注射方式连续给药28 d,每次注射后1 h内记录各组大鼠癫痫发作级别,统计各组每天平均发作级别,观察乙酰唑胺对大鼠慢性癫痫发作的影响;最后1次给药1 d后,脑电图记录各组大鼠脑电的改变,免疫组化观察AQP4在海马内分布,实时荧光定量PCR(RT-qPCR)和Western blot检测AQP4 mRNA和蛋白的表达。结果 对照组和乙酰唑胺对照组无明显癫痫发作,乙酰唑胺干预组潜伏期为(23.5±2.4)d,而致痫组潜伏期为(18.2±1.7)d,乙酰唑胺干预可明显延长慢性癫痫大鼠点燃的潜伏期(P<0.05);脑电图结果对照组和乙酰唑胺对照组无明显痫样波,致痫组记录到棘波、尖波等痫样波,而乙酰唑胺干预组痫样波明显减弱;免疫组化结果显示:AQP4主要分布在海马CA3区血管周围;RT-qPCR和Western blot结果显示慢性致痫组AQP4 mRNA及蛋白表达明显增加(P<0.05或P<0.01),乙酰唑胺干预组AQP4表达降低但仍高于对照组(P<0.05),乙酰唑胺对照组AQP4表达较对照组明显降低(P<0.05)。结论 乙酰唑胺能够抑制癫痫的发作,延长慢性点燃潜伏期,并且抑制AQP4的表达,其作用机制可能是与乙酰唑胺抑制AQP4表达,改善慢性癫痫状态下脑内水和离子平衡有关。
慢性癫痫; 水通道蛋白4; 乙酰唑胺; 戊四氮
癫痫是由多种病因引起神经元突然的、短暂的、异常同步放电所致的脑功能紊乱。乙酰唑胺(acetazolamide,AZA)是碳酸酐酶抑制剂,目前临床上用于治疗癫痫和青光眼。然而乙酰唑胺抗癫痫作用机制还不是很清楚。水通道蛋白(Aquaporins,AQPs)又称作水孔蛋白,水通道蛋白4为脑内主要水通道蛋白亚型,是最近发现的一种与水的通透性有关的膜转运蛋白,并在各种原因产生的脑水肿中起重要作用[1]。研究发现AQP4表达量在癫痫患者脑内发生改变[2],体内外研究表明AQP4可能在癫痫发作中起关键作用[3]。最近研究发现乙酰唑胺可抑制AQP4的表达[4]。因此我们选择乙酰唑胺进行干预,观察其对大鼠癫痫发作的影响以及对癫痫发作后AQP4表达水平的改变,以探讨乙酰唑胺抗癫痫的可能机制,为乙酰唑胺作为AQP4抑制剂以及探索AQP4在癫痫发作过程中的作用机制提供实验依据。
1 材料与方法
1.1 实验材料
乙酰唑胺购自Sigma公司;戊四氮(pentamethazol,PTZ)购自Sigma公司;Trizol购自Invitrogen公司;引物合成由上海Invitrogen生物工程公司完成;RT-qPCR试剂盒购自TaKaRa公司;AQP4兔抗大鼠单克隆抗体购自Santa Cruz公司;DAB购自Bioword公司;辣根过氧化物酶标记山羊抗兔IgG购自武汉博士德生物技术有限公司。
1.2 动物分组
选用成年健康(Sprague-Dawley,SD)大鼠(广州医科大学实验动物中心提供),体重(240±40)g,雌雄不拘,实验室常规条件下喂养。按实验要求随机分为4组,①对照组(n=15):腹腔注射生理盐水;②致痫组(n=25):腹腔注射亚惊厥剂量戊四氮;③乙酰唑胺干预组(n=25):先腹腔注射乙酰唑胺,30 min后再腹腔注射亚惊厥剂量戊四氮;④乙酰唑胺对照组(n=15):腹腔注射乙酰唑胺。
1.3 慢性动物模型的建立
成年SD大鼠,腹腔注射亚惊厥剂量戊四氮35 mg/(kg·d),连续注射28 d。每次注射后1 h内观察并记录痫性发作潜伏期和发作强度。按Racine癫痫发作分级标准评价[5],0级:无发作反应;Ⅰ级:口周及面部肌肉抽搐;Ⅱ级:点头样发作;Ⅲ级:前肢阵挛发作;Ⅳ级:直立,全身强直阵挛发作;Ⅴ级:直立并摔倒,全身强直阵挛发作伴失张力发作。其中,≤Ⅲ级的为轻度发作,Ⅳ级及以上的为重度发作,凡至少连续出现5 d Ⅱ级以上的发作即认为慢性点燃成功[6]。
1.4 大鼠海马脑电检测
最后1次给药1 d后,进行脑电监测。将各组动物取俯卧位固定于立体定向仪(美国Stoelting公司),根据诸葛启钏的《大鼠脑立体定位图》进行海马定位,于海马深部前囟后3.0 mm,旁开2.5 mm,钻开颅骨,挑开硬脑膜,用脑立体定位仪将脑电图记录电极送入硬膜下3.0 mm。将引导电极信号输入BL-420E生物机能实验系统记录大鼠癫痫发作频率。连续记录1 h内大鼠癫痫的放电频率,以出现尖波、棘波为癫痫发作的脑电波。
1.5 免疫组化检测海马AQP4蛋白的表达及定位
冰冻包埋组织块行30 μm厚连续切片,切片依次入(10%甲醇:0.3% H2O2)溶液30 min,正常山羊血清封闭液孵育2 h,兔抗大鼠AQP4一抗(1:500)4℃孵育过夜,辣根过氧化物酶标记山羊抗兔IgG(1:200)室温孵育1 h,其间使用PBS充分洗涤。最后切片入DAB显色液中显色5~10 min,贴片,常规脱水透明封片。阴性对照实验用PBS代替一抗。在同一光强度、放大倍数(×10、×40)下观察。
1.6 RT-qPCR检测AQP4 mRNA的表达
称取50 mg海马,溶于500 μL Trizol,逆转录合成cDNA;β-actin的引物序列:上游5′-GGAGA-TTACTGCCCGGCTCCTA-3′,下游5′-GACTCA-TCGTACTCCTGCTTGCTG-3′,扩增片段长度为150 bp。AQP4的引物序列:上游5′-TGCAGC-AGAGAGACATCAT-3′,下游5′-TGGAGACGT-CATCTGTGAGC-3′,扩增片段长度为185 bp。qPCR反应条件为95℃ 30 s;95℃ 5 s,60℃ 34 s,共40个循环;95℃ 15 s,60℃ 1 min,95℃ 15 s。实验数据使用AQP4和β-actin RNA循环阈值(Ct)之差(ΔCt)计算得到相关基因的表达情况。计算对比的样本间基因表达的差异(ΔΔCt),表达差异的倍数RQ为2-ΔΔCt,以对照组的RQ值为1,各组是相对于1的变化倍数。
1.7 Western blot检测AQP4蛋白的表达
取50 mg海马组织加入蛋白裂解液,匀浆收集上清。蛋白定量后,以40 μg/孔上样,经10% SDS-PAGE垂直电泳后电转移至PVDF膜上,5%脱脂奶粉室温封闭1 h,然后加入AQP4兔抗大鼠单克隆抗体(1:2 000)和β-actin兔抗大鼠单克隆抗体(1:2 000)4℃孵育过夜,辣根过氧化物酶标记山羊抗兔IgG(1:5 000)室温孵育1 h,ECL显色,利用Gene Gnome成像分析系统检测蛋白条带。使用Image J软件测定各条带的灰度值,以β-actin作为内参标准化AQP4蛋白的表达水平。
1.8 统计学处理
2 结果
2.1 大鼠行为学观察
戊四氮注射后第1周首先出现外周胆碱能反应,表现为全身颤抖、竖毛、嘴和面部肌肉抽搐(Ⅰ级),到第2周出现活动减少、咀嚼、节律性点头(Ⅱ级),随后出现头颈上仰、前肢阵挛发作(Ⅲ级),第3、4周部分大鼠明显出现直立竖尾、以尾拍击地面、全身强直阵挛发作甚至直立并摔倒(Ⅳ、Ⅴ级);对照组和乙酰唑胺对照组未见癫痫发作,见图1。第4周末戊四氮致痫组和乙酰唑胺干预组大鼠点燃率100%(25/25)。致痫组慢性点燃潜伏期为(18.2±1.7)d,乙酰唑胺干预组潜伏期为(23.5±2.4)d,乙酰唑胺干预组慢性点燃潜伏期明显延长(P<0.05)。

图1 每天记录各组大鼠给药期间癫痫平均发作级别Fig.1 The average daily seizure severity in each group
2.2 脑电图痫波改变
脑电图结果显示对照组和乙酰唑胺对照组无明显痫样波,为正常脑电图波。致痫组记录到棘波、尖波等痫样波,而乙酰唑胺干预组痫样波减弱或消失。各组大鼠海马脑电图记录见图2。
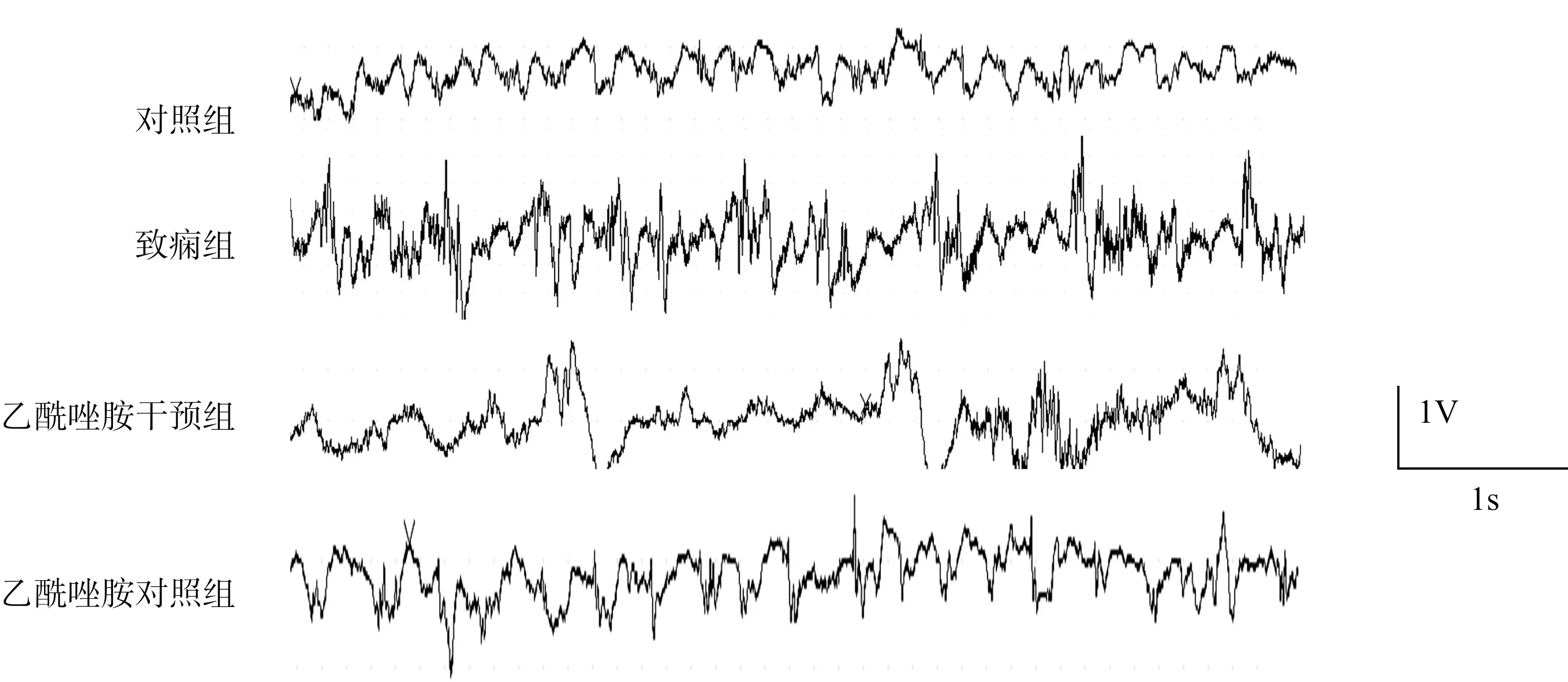
图2 各组大鼠海马脑电记录图Fig.2 The electroencephalogram(EEG) of rat hippocampus in each group
2.3 免疫组化检测结果
免疫组化AQP4阳性表达呈棕褐或棕黄色,可见AQP4主要分布在海马CA3区血管周围,结果见图3。
2.4 RT-qPCR检测海马AQP4 mRNA表达
各组AQP4 mRNA相对表达量分别为(1.000 0±0.000 1)、(3.965 0±0.367 7)、(1.930 7±0.231 4)、(0.321 0±0.315 4)。致痫组和乙酰唑胺干预组大鼠海马中AQP4 mRNA的表达增加,高于对照组(P<0.05或P<0.01),乙酰唑胺对照组表达低于对照组(P<0.05),乙酰唑胺干预组AQP4 mRNA表达低于致痫组(P<0.05),结果见图4。
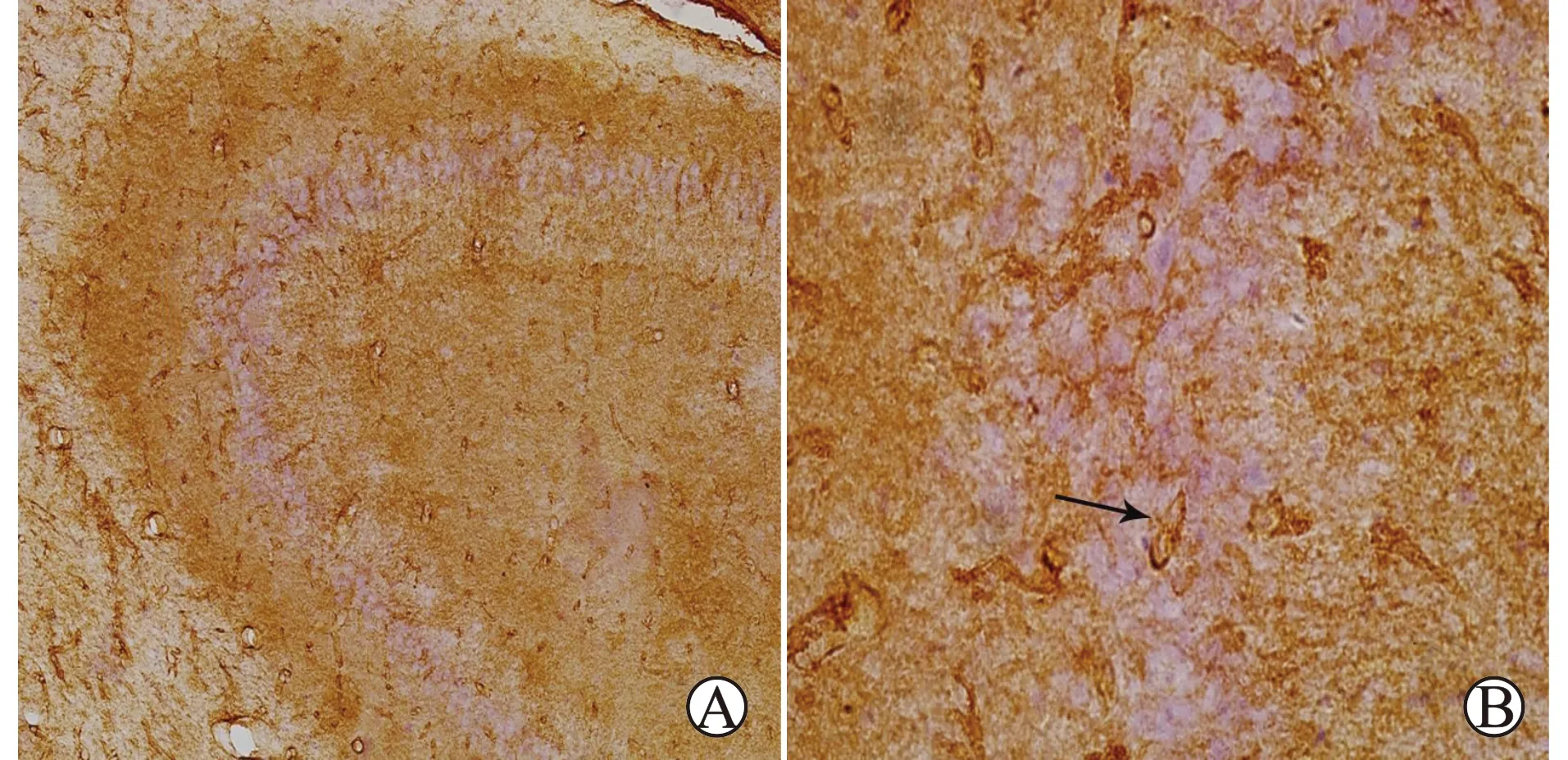
A:10倍镜下海马CA3区观察;B:40倍镜下海马CA3区观察;箭头示AQP4阳性蛋白
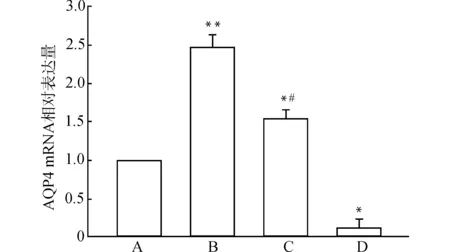
A:对照组;B:致痫组;C:乙酰唑胺干预组;D:乙酰唑胺对照组;与对照组比较,*P<0.05 **P<0.01;与致痫组比较,#P<0.05
2.5 Western blot检测海马AQP4蛋白表达
Western blot结果见图5,AQP4蛋白在对照组、致痫组、乙酰唑胺干预组及乙酰唑胺对照组表达相对灰度值比值分别为(0.349 9±0.042 5),(0.576 1±0.037 5),(0.462 5±0.026 0),(0.219 0±0.013 7)。戊四氮致大鼠慢性癫痫后海马AQP4蛋白表达明显增高,致痫组和乙酰唑胺干预组与对照组比较差异有统计学意义(P<0.01或P<0.05),致痫组AQP4蛋白表达高于乙酰唑胺干预组(P<0.05),乙酰唑胺对照组与对照组比较蛋白表达明显降低(P<0.05),结果见图5。
3 讨论
水通道蛋白(AQPs)是分布于水分代谢活跃细胞膜上,为主要介导水被动跨膜转运的功能蛋白质,对保持细胞内环境水和电解质的平衡起着非常重要的作用[7]。AQP4在正常脑组织中呈极性分布,主要位于血管周围的星形细胞足突处,而靠近神经元侧足突表达较少[2]。近年研究表明,AQP4分布特点的维持与其锚定蛋白复合物相关,即抗肌萎缩蛋白复合物(dystrophin-associated proteins,DAPs),其主要由肌聚糖、α-小肌营养蛋白(α-dystrobrevin)和α-互养蛋白(α-syntrophin)等构成[8]。

A:对照组;B:致痫组;C:乙酰唑胺干预组;D:乙酰唑胺对照组;与对照组比较,*P<0.05 **P<0.01;与致痫组比较,#P<0.05
戊四氮作为γ氨基丁酸(GABA)的拮抗物,通过阻止GABA自发释放而致痫,戊四氮点燃的大鼠模型,其痫性发作形式、脑电图变化和病理学改变与人类相似。本研究采用戊四氮化学点燃建立慢性大鼠癫痫模型,通过行为学观察发现符合慢性癫痫标准,大鼠慢性癫痫模型构建成功。
AQP4主要位于围绕在血管周围的星形细胞足突处,这种分布模式有助于调节细胞与血管间水的转运,本实验免疫组化检测结果也显示,AQP4主要表达在脑血管周围。近年来AQP4与癫痫的关系已成为研究的热点,Binder等[9-11]观察AQP4敲除鼠和野生鼠对惊厥剂戊四氮的反应性发现AQP4敲除鼠癫痫发作潜伏期延长,体内电刺激的方法记录AQP4敲除鼠脑电发现癫痫诱发阈值和癫痫发作耐受能力明显高于普通野生型小鼠。本实验脑电记录也发现抑制AQP4表达能够降低痫波发生。另外,在临床研究中采用定量逆转录PCR对颞叶癫痫致海马硬化患者手术所取海马标本的检测发现AQP4 mRNA明显增加[12]。在本实验中RT-qPCR和Western blot的结果均提示,慢性致痫组AQP4表达与对照组相比明显增多,与上述研究结果一致。
研究已证实神经元电活动的稳定性有赖于脑细胞外间隙(extracellular spaces,ECS)相对容积变化[13]。其主要原因是ECS内包含大量离子、神经递质如兴奋性氨基酸和抑制性氨基酸等,构成脑内细胞兴奋性活动的微环境,因此ECS相对容积改变的同时,通常都伴随着细胞外离子或神经递质浓度改变进而影响正常神经元的电活动。在神经纤维网系统中,神经元与神经元之间或神经元与神经胶质细胞之间都存在特定的突触联系。研究表明使用低渗液在降低ECS相对容积的同时也增强了突触间的联系,提高了神经元兴奋性同步化频率,增加癫痫活动的发放,而高渗介质则有相反的作用[14]。研究显示AQP4表达增加以及分布极性改变是脑内ECS改变的重要原因[15]。AQP4在血管侧分布减少,而在神经元侧分布增加,这种极性改变影响了星形胶质细胞将水分子及时排出到血管内,结果过多的水分子滞留在星形胶质细胞内,造成细胞肿胀,导致细胞外间隙容积减少,间接引起细胞外兴奋性递质或K+浓度增加,另一方面肿胀的星形胶质细胞还可通过容积敏感性阴离子通道(volume-regulated anion channels,VRACs)释放兴奋性氨基酸,从而增强该部位脑神经元兴奋性,引起癫痫发作[16]。
研究还发现AQP4和内向整流钾离子通道(inwardly rectify-ing potassium channel,Kir4.1)在星形胶质细胞血管周围足突上都呈现极性分布特点,而且在功能上相耦联[17]。Amiry-Moghaddam等[18]发现,敲除α-syntrophin基因的小鼠惊厥易感性增加,并且海马区域血管周围AQP4显著缺失,用微电极测量K+的清除率发现细胞外K+清除时间明显延长,导致神经元周围K+浓度过高。
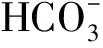
本研究中我们发现,致痫组与乙酰唑胺干预组点燃率无差别,在乙酰唑胺对照组中,乙酰唑胺能够明显抑制AQP4的表达,而在乙酰唑胺干预组其抑制效应并不是很明显。乙酰唑胺干预组RT-qPCR和Western blot结果显示该组AQP4的表达依然高于正常组,说明癫痫发作过程中还有其他因素调节AQP4表达。研究发现双氯芬酸钠能够增强促炎因子上调星形胶质膜上AQP4的表达[20]。Ito等[21]研究发现经侧脑室穿刺注射IL-1β后可引起AQP4的表达上调,也有研究显示AQP4缺失可以明显减轻脂多糖(LPS)诱导的促炎反应[22]。既往研究已证实,脑内促炎症因子失衡是癫痫发作的重要原因[23],提示AQP4还可能通过与促炎因子相互作用促进癫痫发作。但AQP4具体是通过何种作用机制来影响癫痫发作还需进一步的研究。
[1] 崔向,宁尹岭,王玉来.水通道蛋白4在大鼠创伤性脑水肿中的作用机制[J].中国康复理论与实践,2005,11(9):719-721.
[2] Medici V,Frassoni C,Tassi L,et al.Aquaporin 4 expression in control and epileptic human cerebral cortex[J].Brain Res,2011,1367:330-339.
[3] Binder D K,Nagelhus E A,Ottersen O P.Aquaporin-4 and epilepsy[J].Glia,2012,60(8):1203-1214.
[4] Sripathirathan K,Brown J R,Neafsey E J,et al.Linking binge alcohol-induced neurodamage to brain edema and potential aquaporin-4 upregulation:evidence in rat organotypic brain slice cultures andinvivo[J].J Neurotrauma,2009,26(2):261-273.
[5] Mcnamara J O.Kindling:an animal model of complex partial epilepsy[J].Ann Neurol,1984,16 (Suppl):S72-S76.
[6] Song M Y,Tian F F,Wang Y Z,et al.Potential roles of the RGMa-FAK-Ras pathway in hippocampal mossy fiber sprouting in the pentylenetetrazole kindling model[J].Mol Med Rep,2015,11(3):1738-1744.
[7] Verkman A S.Knock-out models reveal new aquaporin functions[J].Handb Exp Pharmacol,2009,(190):359-381.
[8] Amiry-Moghaddam M,Frydenlund D S,Ottersen O P.Anchoring of aquaporin-4 in brain:molecular mechanisms and implications for the physiology and pathophysiology of water transport[J].Neuroscience,2004,129(4):999-1010.
[9] Binder D K,Oshio K,Ma T,et al.Increased seizure threshold in mice lacking aquaporin-4 water channels[J].Neuroreport,2004,15(2):259-262.
[10] Binder D K,Yao X,Verkman A S,et al.Increased seizure duration in mice lacking aquaporin-4 water channels[J].Acta Neurochir Suppl,2006,96:389-392.
[11] Binder D K,Yao X,Zador Z,et al.Increased seizure duration and slowed potassium kinetics in mice lacking aquaporin-4 water channels[J].Glia,2006,53(6):631-636.
[12] Lee T S,Eid T,Mane S,et al.Aquaporin-4 is increased in the sclerotic hippocampus in human temporal lobe epilepsy[J].Acta Neuropathol,2004,108(6):493-502.
[13] Da T,Verkman A S.Aquaporin-4 gene disruption in mice protects against impaired retinal function and cell death after ischemia[J].Invest Ophthalmol Vis Sci,2004,45(12):4477-4483.
[14] Traynelis S F,Dingledine R.Role of extracellular space in hyperosmotic suppression of potassium-induced electrographic seizures[J].J Neurophysiol,1989,61(5):927-938.
[15] Binder D K,Papadopoulos M C,Haggie P M,et al.Invivomeasurement of brain extracellular space diffusion by cortical surface photobleaching[J].J Neurosci,2004,24(37):8049-8056.
[16] Benfenati V,Caprini M,Nicchia G P,et al.Carbenoxolone inhibits volume-regulated anion conductance in cultured rat cortical astroglia[J].Channels(Austin),2009,3(5):323-336.
[17] Dibaj P,Kaiser M,Hirrlinger J,et al.Kir4.1 channels regulate swelling of astroglial processes in experimental spinal cord edema[J].J Neurochem,2007,103(6):2620-2628.
[18] Amiry-Moghaddam M,Otsuka T,Hurn P D,et al.An alpha-syntrophin-dependent pool of AQP4 in astroglial end-feet confers bidirectional water flow between blood and brain[J].Proc Natl Acad Sci U S A,2003,100(4):2106-2111.
[19] Huber V J,Tsujita M,Kwee I L,et al.Inhibition of aquaporin 4 by antiepileptic drugs[J].Bioorg Med Chem,2009,17(1):418-424.
[20] Asai H,Kakita H,Aoyama M,et al.Diclofenac enhances pr-oinflammatory cytokine-induced aquaporin-4 expression in cultured astrocyte[J].Cell Mol Neurobiol,2013,33(3):393-400.
[21] Ito H,Yamamoto N,Arima H,et al.Interleukin-1 beta induces the expression of aquaporin-4 through a nuclear factor-kappaB pathway in rat astrocytes[J].J Neurochem,2006,99(1):107-118.
[22] Li L,Zhang H,Varrin-Doyer M,et al.Proinflammatory role of aquaporin-4 in autoimmune neuroinflammation[J].FASEB J,2011,25(5):1556-1566.
[23] 邓镇,罗淼珊,赵元淑,等.GluN2A 抑制剂对癫痫持续状态大鼠脑内P-糖蛋白表达的影响[J].华中科技大学学报:医学版,2014,43(2):168-172.
(2015-04-02 收稿)
Effect of Acetazolamide on the Expression of Aquaporin-4 in Hippocampus of Rats with PTZ-induced Chronic Epilepsy
Chen Li,Yu Han,Zhou Yuboetal
SchoolofBasicSciences,GuangzhouMedicalUniversity,Guangzhou510182,China
Objective To observe the effect of acetazolamide(AZA)on pentylenetetrazole(PTZ)-induced chronic epileptic seizures in rats and aquaporin-4(AQP4)expression in hippocampus tissue of rats,and investigate the possible antiepileptic mechanism of AZA.Methods The experimental rats were randomly divided into four groups:control group,in which the rats were daily intraperitoneally injected with normal saline;epileptic group,in which the rats were daily administered a subconvulsive dose of PTZ(35 mg/kg);AZA+PTZ group,in which the rats were daily treated with AZA(35 mg/kg)30 min before PTZ injection;AZA group,in which the rats were intraperitoneally injected with AZA(35 mg/kg)each day.All groups were administered for 28 consecutive days.The seizure severity of rats within one hour after each injection was recorded and the average daily seizure severity was obtained in each group to observe the effect of AZA on chronic epileptic seizures.One day after the last administration,the electroencephalogram changes of rats were recorded.Immunohistochemistry was used to detect the distribution of AQP4 in rat hippocampus.Real-time quantitative PCR(RT-qPCR)and Western blot were used to detect the expression of AQP4.Results Behavioral observation showed that rats in control group and AZA group had no obvious epileptic seizure.The average latent period was significantly increased in AZA+PTZ group(23.5±2.4)d compared with that in the PTZ group(18.2±1.7)d(P<0.05).AZA intervention could significantly prolong the latent period of chronic epilepsy.EEG showed no significant epileptic waves in the control group and the AZA group,but spike wave and sharp wave in the epileptic group.In the AZA+PTZ group,the number of epileptic waves was conspicuously reduced.Immunohistochemistry showed AQP4 was primarily localized surrounding brain capillaries in hippocampus CA3 region.The results of RT-qPCR and Western blot showed that the expression level of AQP4 mRNA and protein in hippocampus of PTZ group was increased obviously(P<0.05 orP<0.01).But the expression of AQP4 mRNA and protein in AZA+PTZ group was much lower than in PTZ group(P<0.05).The AQP4 mRNA and protein levels in AZA group were markedly reduced as compare with control group(P<0.05).Conclusion AZA can suppress the epileptic seizures and extend kindling latency.The antiepileptic mechanism of AZA may be associated with inhibition of AQP4 expression and maintenance of water and ion balance in the brain of rats with chronic epilepsy.
chronic epilepsy; aquaporin-4; acetazolamide; pentylenetetrazole
*广州市科技计划项目(No.2013J4100103);广州市属高校科研计划项目(No.2012C128, 2012D001);广东省省级科技计划项目(No.2013B021800191,2014A020212512)
R742.1
10.3870/j.issn.1672-0741.2015.05.003
陈 丽,女,1990年生,硕士研究生,E-mail:chenli601793349@163.com
△通讯作者,Corresponding author,E-mail:Leishuisheng@126.com(雷水生);whzhuxiaoqin@163.com(朱晓琴)
