Poly I:C对小鼠脑缺血再灌注损伤的保护作用及其机制研究*
2015-06-06潘琳娜李昌俊郭莲军
潘琳娜, 吕 青, 樊 萍, 李昌俊, 郭莲军
1南昌市第二医院(南昌市中西医结合医院)神经内科,南昌 3300032华中科技大学同济医学院基础医学院药理学系,武汉430030
Poly I:C对小鼠脑缺血再灌注损伤的保护作用及其机制研究*
潘琳娜1, 吕 青2, 樊 萍1, 李昌俊2, 郭莲军2
1南昌市第二医院(南昌市中西医结合医院)神经内科,南昌 3300032华中科技大学同济医学院基础医学院药理学系,武汉430030
目的 观察特异性激活Toll样受体3(Toll-like receptor 3,TLR3)-Toll/IL-1受体结构域接头分子(Toll/IL-1 receptor domain containing adaptor inducing IFN-β,TRIF)信号通路药物聚肌胞苷酸(polyinosinic polycytidylic acid,Poly I:C)对局灶性脑缺血损伤小鼠是否有保护作用,并探讨保护作用是否与抑制炎性作用有关。方法 对小鼠进行一次性肌肉注射0.3 mg/kg Poly I:C,24 h后进行左侧大脑中动脉栓塞(middle cerebral artery occlusion,MCAO),栓塞2 h后进行再灌注6、12、22 h,诱导小鼠的脑缺血再灌注损伤模型,TTC染色方法测定脑缺血体积;Western blot方法检测缺血侧脑组织TRIF蛋白表达;ELISA方法检测小鼠缺血侧半脑脑组织炎性因子干扰素-β(interferon-β,IFN-β)、白细胞介素-10(interleukin-10,IL-10)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的含量。结果 缺血2 h再灌注6、12、22 h的小鼠出现明显的神经缺陷症状及脑组织梗死,在缺血再灌注各个时间点,小鼠缺血侧脑组织中IL-6、TNF-α表达均升高。0.3 mg/kg Poly I:C能减少梗死面积,改善神经缺陷,提高小鼠缺血侧脑组织TRIF蛋白的表达,能在不同时间点升高IFN-β水平并降低缺血再灌注缺血侧脑组织IL-6和TNF-α的含量。结论 0.3 mg/kg Poly I:C对脑缺血损伤小鼠有保护作用,保护作用机制与抑制小鼠脑缺血再灌注损伤过程中的炎症反应有关。
Poly I:C; 脑缺血再灌注; TRIF; 炎性因子
最近有大量研究显示,Toll样受体3(Toll-like receptor 3,TLR3)的特异性激动剂聚肌胞苷酸(polyinosinic polycytidylic acid,Poly I:C)对神经细胞缺血缺氧有保护作用,其保护作用与下游产生干扰素(interferon-β,IFN-β)有关。如宋璞等[1]发现Poly I:C可减轻缺糖缺氧诱导的原代皮质神经元的损伤。Marsh等[2]发现10~100 μg/mL Poly I:C对体外皮层神经元氧糖剥夺再灌注损伤有保护作用,并认为其保护作用可能与下游的TRIF-IFN-β通路有关。Borysiewicz等[3]用H2O2化学性缺氧制作星形胶质细胞缺氧模型,证实Poly I:C对H2O2所致的缺氧细胞具有保护作用。前期体外细胞实验证实,Poly I:C可以激活TRIF-IFN-β,从而抑制细胞炎症反应[4],对氧糖剥夺的神经细胞具有保护作用。目前国内外研究中,关于Poly I:C对阻塞大脑中动脉引起的经典脑缺血再灌注损伤动物的保护作用及炎症抑制作用机制,尚不清楚。
本实验通过对大脑中动脉阻塞(MCAO)造模动物进行行为学评分,以及对其脑缺血面积进行测定,观察脑组织损伤程度,并且检测不同时间点小鼠缺血侧脑组织中脑缺血组织TRIF表达及炎性因子IFN-β、IL-10、IL-6、TNF-α的含量,观察Poly I:C对MCAO模型所致的脑缺血再灌注损伤小鼠保护作用,并进一步探讨其保护作用是否与抑制炎性反应有关。
1 材料与方法
1.1 实验动物及主要材料
选择体重20~22 g的6~8周健康成年雄性昆明种小白鼠30只,由华中科技大学同济医学院实验动物学部提供。适应性喂养3 d。Poly I:C购于广东邦民制药厂有限公司,溶于生理盐水,-20℃避光保存。IFN-β、IL-10、IL-6、TNF-α ELISA检测试剂盒购于RD公司(USA);TRIF一抗购自ABCAM公司(Cambridge,UK);β-actin一抗购自Santa Cruz生物技术公司(CA,USA);罗丹明标记的IgG-过氧化物酶结合化学发光物的二抗均购自武汉三鹰生物技术有限公司;水合氯醛:用双蒸水配成10%的溶液,常温保存;2,3,5-三苯基四氮唑(TTC):购于Sigma公司(St,Louis,MO,USA),用双蒸水配成20 g/L的溶液,常温避光保存;二喹啉甲酸(Bicin choninic acid,BCA)蛋白定量试剂盒、蛋白裂解液均购自上海碧云天生物技术有限公司;ECL显影液购自Pierce生物技术公司(Rockford,USA);其它化学试剂均为分析纯。偏氟乙烯膜(Poly vinylidenedifluoride membrane,PVDF)购自Bio-Rad公司(Hercules,CA,USA);激光多普勒血流仪:Ex135Hu,英国Moor Instruments公司;pH计:DELTA320,梅特勒(上海)有限公司;Elx800酶标仪:德国Bio2tek仪器公司;-80℃超低温冰箱:美国Thermo公司;DYY-8C型电泳仪;小型水平摇床:北京六一仪器厂;台式高速低温离心机:德国Biofuge-22 RHeraeus公司;HW-1000超级恒温水浴:成都泰盟科技有限公司;凝胶成像分析系统:美国Alpha公司。
1.2 小鼠脑缺血复灌模型制作及MCAO模型成功的判断标准
选择成年雄性健康昆明种小鼠,随机分为3组:假手术组(Control)、缺血再灌模型溶剂组(I/R,Media)、Poly I:C给药组(Poly I:C+I/R)。假手术组、I/R组小鼠给予生理盐水,Poly I:C+I/R组小鼠肌肉注射预给药(0.3 mg/kg),24 h后进行大脑中动脉阻塞制作局灶性脑缺血模型[5]。除假手术组不进行大脑中动脉栓塞过程,其余两组进行局灶性脑缺血2 h后再灌注6 h、12 h和22 h,并且相应进行行为学评分,然后麻醉下断头取脑,-80℃下速冻5 min,振荡切片机切取脑片,每张脑片厚1 mm。本研究中MCAO模型的成功判定主要用激光多普勒血流探测仪检测脑血流的变化,判断标准参考Iwai等[6]制作标准。
1.3 神经行为学评分
按照Longa评分[7]标准,于小鼠缺血复灌22 h后对各组进行行为学评分记录。
1.4 脑缺血面积的计算
将脑片置入2%TTC溶液中,37℃恒温下染色15 min。取出后4%多聚甲醛固定,24 h后拍照并输入计算机,采用Image-Proplus6.0图像处理软件分析脑梗死面积,计算出总的梗死体积,用梗死总体积除以总体积,计算出梗死百分比。
1.5 采用Western blot方法分析TRIF脑组织表达量
取各组左侧大脑半球(缺血侧)脑组织,用眼科剪剪碎后,用含蛋白酶抑制剂及磷酸化蛋白酶抑制剂的冰冷蛋白裂解液,4℃下电动珠研磨匀浆机匀浆后,4℃下裂解30 min,12 000 g离心15 min,收集上清液并提取蛋白,以BSA作为标准蛋白绘制标准曲线,根据标准曲线计算各样本蛋白的浓度。提取的蛋白加入5×上样缓冲液,配制蛋白电泳样品,每份样品含蛋白50 μg,上样体积为15 μL,95℃下5 min,准备电泳用。根据参考文献[4]的方法进行电泳,取出凝胶,4℃下恒流250 mA,转膜2~3 h,室温下封闭1.5 h,然后加入相应一抗(兔源TRIF 1:600、小鼠源β-actin 1:1 000),4℃过夜,TBST洗膜后加入相应二抗室温下孵育1.5 h。加入ECL显色液,暗室下胶片曝光、扫描后用软件(Image J software,NIH Image,USA)定量分析。
1.6 用ELISA法测定脑缺血小鼠缺血侧脑组织中炎性因子IFN-β、IL-10、TNF-α、IL-6的含量
蛋白提取及蛋白浓度测定同Western blot蛋白提取过程。
ELISA法测定炎性因子含量,采用双抗体夹心ABC-ELISA法。根据试剂盒操作步骤,在450 nm处测A值,IFN-β、IL-10、TNF-α、IL-6浓度与A值呈正比,通过绘制标准曲线求出样本中各炎性因子浓度。
1.7 统计学分析
采用SPSS 18.0统计软件进行统计和分析,组间数据比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 Poly I:C对小鼠脑缺血2 h再灌注22 h后行为学评分的影响
神经行为学评分结果显示,小鼠脑缺血2 h再灌22 h后,I/R 22 h组、Poly I:C+ I/R 22 h治疗组动物均有不同程度的神经功能缺失症状。与I/R 22 h组动物比较,Poly I:C+ I/R 22 h治疗组的动物神经缺失症状有明显改善(P<0.05),结果见图1。
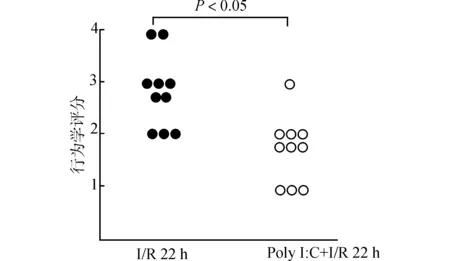
图1 脑缺血2 h再灌注22 h后小鼠神经行为学评分统计图Fig.1 Statistical graph of neurological deficit scores after 2-h ischemia and 22-h reperfusion
2.2 Poly I:C对小鼠脑缺血2 h再灌注22 h后脑梗死体积的影响
脑缺血2 h再灌注22 h后,脑片经TTC染色,梗死区域呈苍白色,非梗死区域呈红色,梗死部分与MCA支配的脑区一致。Poly I:C+ I/R组小鼠缺血侧梗死体积与I/R组相比明显减少,差异具有统计学意义(P<0.05),结果见图2。

A:各组小鼠脑片TTC染色图;B:各组小鼠脑梗死体积统计图;与I/R 22 h组比较,*P<0.05;n=10
2.3 Poly I:C对缺血再灌注不同时间点小鼠缺血侧脑组织TRIF蛋白质表达的影响
脑缺血2 h再灌注6、12、22 h后,I/R不同时间点组小鼠缺血侧脑组织TRIF蛋白质的表达与Control组相比有下降,但差异无统计学意义。Poly I:C+I/R不同时间点组缺血侧脑组织的TRIF蛋白质表达与I/R相应时间点组缺血侧脑组织相比均明显增加,差异有统计学意义,结果见图3。
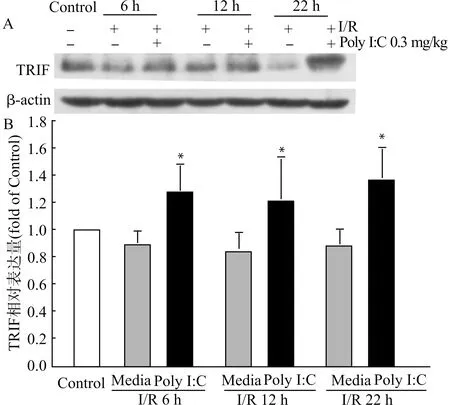
与相应时间点I/R组比较,*P<0.05;n=6
2.4 Poly I:C对脑缺血2 h复灌后小鼠缺血侧脑组织IFN-β、IL-10、TNF-α、IL-6蛋白表达的影响
脑缺血2 h再灌注各个时间点,I/R不同时间点组小鼠缺血侧脑组织IFN-β、IL-10蛋白含量的表达与Control组相比有一定程度升高,其中IFN-β差异有统计学意义。Poly I:C+I/R 22 h组小鼠脑组织IFN-β蛋白含量与I/R 22 h组相比显著升高,差异有统计学意义。而Poly I:C+I/R不同时间点对IL-10表达无明显影响。I/R 6 h、12 h和22 h组小鼠缺血侧脑组织TNF-α、IL-6蛋白含量与相应Control组相比,TNF-α、IL-6蛋白含量显著升高,而Poly I:C+I/R组小鼠缺血侧脑组织TNF-α蛋白含量与I/R组相应时间点小鼠缺血侧脑组织相比,在再灌注12 h显著下降,差异有统计学意义。Poly I:C+I/R小鼠缺血侧脑组织IL-6蛋白含量与I/R组相应时间点小鼠缺血侧脑组织相比,在再灌注6 h、12 h显著下降,差异有统计学意义,结果见图4。
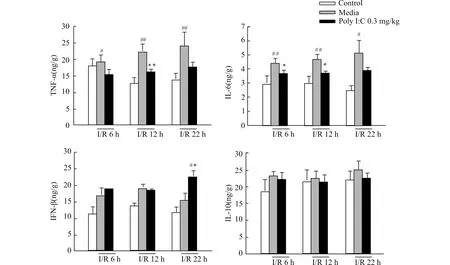
与相应时间点Control组比较,#P<0.05 ##P<0.01;与相应时间点I/R组比较,*P<0.05 **P<0.01;n=6
3 讨论
研究显示,在脑缺血再灌注损伤过程中,炎症反应扮演了重要的角色,炎性细胞因子可以表达于免疫细胞,脑细胞包括神经胶质和神经元也可产生炎性细胞因子。卒中过程中,常见的与炎症相关的细胞因子有TNF-α,IL-6、IL-10、IFN-β等。其中TNF-α和IL-6会加重脑损伤[8-9]。但IL-10可能具有保护神经元作用,有报道证实,IL-10可拮抗IL-1β、TNF-α等介导的炎性反应,具有脑缺血神经保护作用[10]。IFN-β对实验性脑缺血损伤有保护作用,其机制可能与IFN-β具有极为显著的炎症抑制作用有关,临床上已成功将其用于复发-缓解型多发性硬化症的治疗[11-14]。脑缺血再灌注早期,缺血的星形胶质细胞、小胶质细胞及神经元分泌大量的炎性细胞因子,以促炎症因子的合成为主,随着时间推移,抗炎因子分泌逐渐增加,抗炎作用逐渐加强,抗炎和促炎作用逐渐趋于动态平衡[15]。本研究结果显示,大鼠脑缺血再灌注后6 h,脑组织的IL-6、TNF-α含量即已经明显升高,这与国外Uno等[16]研究结果一致。
Poly I:C是TLR3的特异性配体,而TLR3专一介导TRIF依赖信号通路,其主要介导下游的TRIF-IFN-β通路,TRIF能介导IRF3、IRF7激活,IRF3、IRF7是调节I型IFN表达的关键转录因子。在静息细胞中,IRF3以无活性的单体构象存在于胞质中,若细胞被激活,IRF3即产生磷酸化,形成IRF3/IRF3同型二聚体,以及与IRF7形成IRF3/IRF7异型二聚体,进入细胞核引起特异的基因表达。同时TBK1、IKK发生寡聚反应,产生磷酸酶活性。有磷酸酶活性的TBK1、IKKε激活IRF3使其二聚化,最终IRF3促进IFN-β表达[11-12]。本研究在MCAO小鼠上证实,给予0.3 mg/kg Poly I:C,MCAO小鼠脑缺血体积明显下降,同时,我们检测了脑缺血组织中TRIF蛋白的表达,结果显示Poly I:C可以明显增加脑缺血损伤小鼠脑缺血组织TRIF的表达,进一步用ELISA方法检测到脑缺血损伤小鼠脑缺血侧脑组织IFN-β分泌是增加的。而在单纯脑缺血时TRIF及IFN-β表达变化不大,提示在缺血过程中,主要是炎性通路被激活,而TRIF信号通路处于相对静息状态,Poly I:C特异性激活TRIF信号通路后,使下游TRIF及IFN-β表达增加。实验结果进一步显示,与I/R组比较,Poly I:C+I/R组在缺血再灌12 h时,TNF-α明显下降,在缺血再灌6 h和12 h时,IL-6也明显下降(均P<0.05)。因此,从以上实验表明,Poly I:C有桔抗小鼠脑缺血损伤的作用,Poly I:C通过激活TLR3-TRIF信号通路,进而增加IFN-β表达,同时抑制炎性因子分泌。
[1] 宋璞,崔桂荣,陈伟,等.TLR3在poly(I:C)-LMW预处理后缺糖缺氧诱导的原代皮质神经元的表达意义[J].中国实用神经疾病杂志,2012,15(8):1-4.
[2] Marsh B,Stevens S L,Packard A E,et al.Systemic lipopolysaccharide protects the brain from ischemic injury by reprogramming the response of the brain to stroke:a critical role for IRF3[J].J Neurosci,2009,29(31):9839-9849.
[3] Borysiewicz E,Doppalapudi S,Kirschman L T,et al.TLR3 ligation protects human astrocytes against oxidative stress[J].J Neuroimmunol,2013,255(1/2):54-59.
[4] 潘琳娜,涂秀英,李昌俊,等.Poly I:C对氧糖剥夺损伤星形胶质细胞TLR3信号通路的影响[J].华中科技大学学报:医学版,2014,43(3):292-295.
[5] Lu Q,Xia H,Xu H,et al.Betulinic acid protects against cerebral ischemia-reperfusion injury in mice by reducing oxidative and nitrosative stress[J].Nitric Oxide,2011,24(3):132-138.
[6] Iwai M,Liu H W,Chen R,et al.Possible inhibition of focal cerebral ischemia by angiotensin II type 2 receptor stimulation[J].Circulation,2004,110(7):843-848.
[7] Longa E Z,Weinstein P R,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[8] Dirnagl U,Iadecola C,Moskowitz M A.Pathobiology of ischaemic stroke:an integrated view[J].Trends Neurosci,1999,22(9):391-397.
[9] Vikman P,Ansar S,Henriksson M,et al.Cerebral ischemia induces transcription of inflammatory and extracellular-matrix-related genes in rat cerebral arteries[J].Exp Brain Res,2007,183(4):499-510.
[10] Wang Q,Tang X N,Yenari M A.The inflammatory response in stroke[J].J Neuroimmunol,2007,184(1/2):53-68.
[11] Marsh B J,Stenzel-Poore M P.Toll-like receptors:novel pharmacological targets for the treatment of neurological diseases[J].Curr Opin Pharmacol,2008,8(1):8-13.
[12] Veldhuis W B,Derksen J W,Floris S,et al.Interferon-beta blocks infiltration of inflammatory cells and reduces infarct volume after ischemic stroke in the rat[J].J Cereb Blood Flow Metab,2003,23(9):1029-1039.
[13] Marsh B J,Stenzel-Poore M P.Toll-like receptors:novel pharmacological targets for the treatment of neurological diseases[J].Curr Opin Pharmacol,2008,8(1):8-13.
[14] Veldhuis W B,Derksen J W,Floris S,et al.Interferon-beta blocks infiltration of inflammatory cells and reduces infarct volume after ischemic stroke in the rat[J].J Cereb Blood Flow Metab,2003,23(9):1029-1039.
[15] Nayak A R,Kashyap R S,Purohit H J,et al.Evaluation of the inflammatory response in sera from acute ischemic stroke patients by measurement of IL-2 and IL-10[J].Inflamm Res,2009,58(10):687-691.
[16] Uno H,Matsuyama T,Akita H,et al.Induction of tumor necrosis factor-alpha in the mouse hippocampus following transient forebrain ischemia[J].J Cereb Blood Flow Metab,1997,17(5):491-499.
(2015-07-01 收稿)
Poly I:C Protects against Mouse Cerebral Ischemia/Reperfusion Injury
Pan Linna1,Lv Qing2,Fan Ping1etal
1DepartmentofNeurology,TheSecondHospitalofNanchang(NanchangHospitalofIntegratedTraditionalChineseandWesternMedicine),Nanchang330003,China2DepartmentofPharmacology,SchoolofBasicMedicalSciences,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430030,China
Objective To examine the influence of polyinosinic-polycytidylic acid(Poly I:C)on focal cerebral ischemia-reperfusion injury through Toll-like receptor 3(TLR3)-Toll/IL-1 receptor domain-containing adaptor inducing IFN-β(TRIF)signaling pathway in mice and to explore the effects of Poly I:C on the inhibition of inflammatory reaction.Methods Mouse ischemia/reperfusion(I/R)models were established by 2 h left middle cerebral artery occlusion(MCAO)followed by 6,12,22 h reperfusion.Animals were treated with 0.3 mg/kg Poly I:C via one-time intramuscular injection before MCAO.Cerebral infarct volume was detected by TTC staining;the expression level of TRIF protein in ischemic brain tissues was measured by Western blot,and TNF-α,IL-6,IFN-β,and IL-10 levels by ELISA.Results Two-h left MCAO followed by 6,12,22 h reperfusion could result in severe nerve defects and cerebral infarction.The levels of TNF-α and IL-6 were significantly increased in ischemic brain tissues at each I/R time point.Treatment of the mice with Poly I:C(0.3 mg/kg)prior to MCAO could reduce cerebral infarct volume,improve the nerve defects,increase TRIF protein expression,enhance the secretion of IFN-β,and down-regulate the levels of TNF-α and IL-6 in ischemic brain tissues.Conclusion Poly I:C can protect against cerebral ischemia-reperfusion injury by reducing inflammation reaction.
Poly I:C; cerebral ischemia/reperfusion; TRIF; inflammatory cytokines
*国家自然科学基金资助项目(No.81001432)
R743.32
10.3870/j.issn.1672-0741.2015.05.004
潘琳娜,女,1980年生,住院医师,医学博士,E-mail:huizhounanchang@163.com
