AR42J细胞自分泌Shh信号参与雨蛙素诱导的急性胰腺炎*
2015-06-05周翔宇陈霞黄娟曾凡才
周翔宇,陈霞,黄娟,曾凡才
(1四川医科大学附属第一医院血管甲状腺外科,2四川医科大学附属第一医院消化内科,3四川医科大学附属第一医院病理科,4四川医科大学生物化学教研室,四川泸州646000)
论著
AR42J细胞自分泌Shh信号参与雨蛙素诱导的急性胰腺炎*
周翔宇1,陈霞2,黄娟3,曾凡才4
(1四川医科大学附属第一医院血管甲状腺外科,2四川医科大学附属第一医院消化内科,3四川医科大学附属第一医院病理科,4四川医科大学生物化学教研室,四川泸州646000)
目的:观察Hedgehog信号在急性胰腺炎(AP)体外模型中的表达变化。方法:不同浓度的雨蛙素诱导大鼠胰腺腺泡细胞株AR42J,构建AP体外细胞模型,重组Shh作用于AR42J细胞。采用RT-PCR、Western-blot分别检测细胞Shh信号分子表达;ELISA检测上清Shh水平。结果:与对照组相比,雨蛙素诱导组Shh的mRNA和蛋白水平表达明显升高,细胞自分泌Shh水平也明显升高,呈雨蛙素浓度依赖性。重组Shh刺激后,Shh相关信号Shh、Gli1和Ptch1表达呈浓度依赖性地升高。结论:在雨蛙素诱导的AR42J细胞,自分泌的Shh信号参与急性胰腺炎的发病机制。
雨蛙素;AR42J;急性胰腺炎;Sonic Hedgehog信号
急性胰腺炎(Acute Pancreatitis,AP)是胰酶自身消化胰腺及周围组织引起的炎症,临床常见,症状轻重不一,严重者可危及生命。目前认为AP的发病包含复杂的信号级联,始于胰腺腺泡细胞内的炎症反应[1]。因此对胰腺腺泡细胞早期事件的了解,有助于对AP分子病理机制的认识。急性胰腺炎症过程中,腺泡细胞遭受损失的同时,必然启动组织的自身修复和再生机制,作为调节细胞增殖和损伤后组织修复的重要信号-Hedgehog(Hh)信号,是否参与急性胰腺炎症损伤的机制值得重视。Hh信号广泛参与器官发育、调节细胞增殖和损伤过程,我们前期的体内研究证实Hh信号参与小鼠急性胰腺炎症过程[2]。当前的研究,采用雨蛙素诱导AR42J细胞构建AP的体外模型,进一步探讨Hh信号在AP中的表达变化,以期为AP发病的分子病理机制提供理论依据。
1 材料和方法
1.1 细胞培养及模型建立
大鼠胰腺腺泡细胞株AR42J购自美国ATCC,细胞在含有10%胎牛血清的RPMI-1640培养基中常规培养、传代。取传代2次且生长良好的对数生长期细胞,培养24 h后,分别加入含0、1、1.5、2、2.5、3 μM的雨蛙素(caerulein)(美国Sigma公司)的完全培养基继续孵育24 h,以不加雨蛙素的细胞作为对照组。收集培养上清液和细胞备用。
1.2 实验方法
1.2.1 RT-PCR
Trizol(美国Invitrogen公司)方法提取总RNA,使用SuperScript逆转录试剂盒(美国Invitrogen公司)将总RNA逆转录为cDNA。实时荧光定量PCR,βactin作为内参基因,所有反应均在荧光定量仪iCycler iQ(美国Bio-Rad公司)上进行,反应条件为94℃预变性5 min,95℃变性10 s,60℃退火延伸30 s,共40个循环,最后做溶解曲线。检测Hh信号的3个亚基:Sonic hedgehog(Shh)、Indian hedgehog(Ihh)和Desert hedgehog(Dhh),以及Hedgehog信号通路下游分子Gli1和Ptch1。扩增cDNA的序列,表1。

表1 RT-PCR使用的引物序列
1.2.2 Western-blot
Western-blot检测Shh蛋白水平,取约100 mg胰腺组织匀浆,RIPA裂解液裂解1~1.5 h,超声粉碎细胞,使用1×Buffer缓冲液溶解细胞,匀浆,离心,取上清液。提取总蛋白。10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,上样,经分离、电泳将蛋白电转至硝酸纤维素膜,加入1∶200的Shh羊抗兔单克隆一抗孵育(美国Upstate公司),4℃过夜,加入1∶1 000的兔抗鼠二抗室温孵育(美国Santa Cruz公司)1 h,孵育,TBST再冲洗,加入化学发光剂显影(美国Thermo公司)。
1.2.3 ELISA
Shh的ELISA试剂盒购自美国Sigma公司,检测严格按照产品说明书进行。
1.3 重组Shh作用于AR42J细胞对Shh信号通路的影响
不同浓度即0,0.5,1,2 μg/mL的重组Shh(rShh)诱导AR42J细胞,RT-PCR检测Shh及其下游信号分子Gli1和Ptch1的表达。
1.4 统计学处理
2 结果
2.1 RT-PCR检测结果
不同浓度的雨蛙素刺激胰腺AR42J细胞后,Hh信号的3个亚基Shh,Ihh,Dhh的mRNA表达水平都有不同程度的增加,且呈浓度依赖性,浓度为3 μM时升高最明显。3个亚基中,Shh表达最明显(图1-A)。
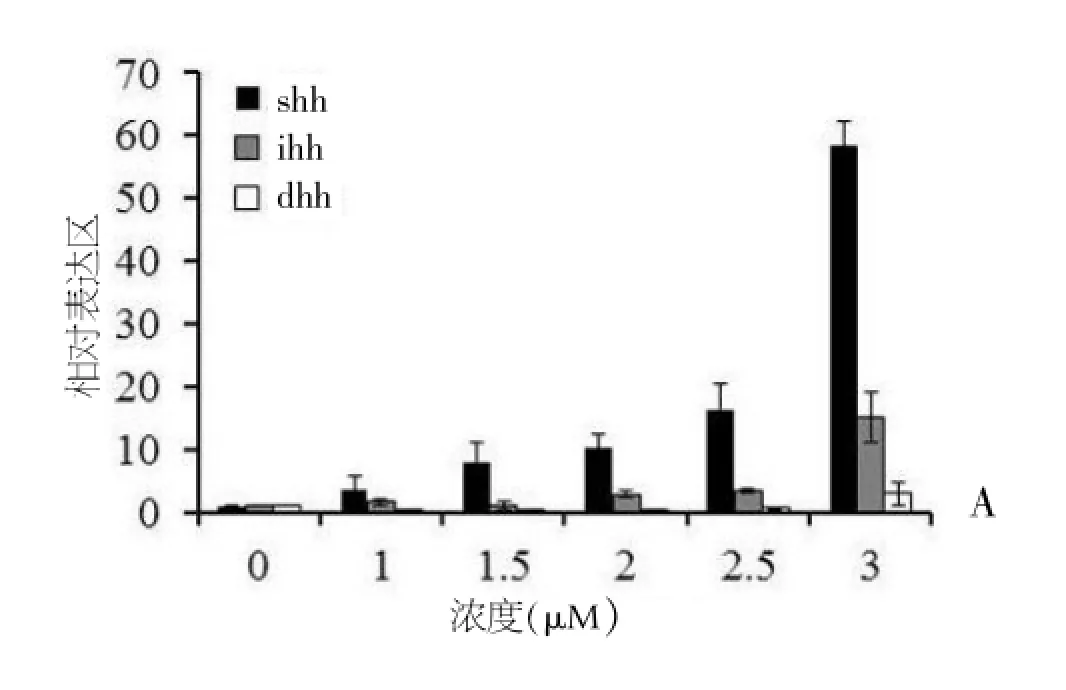
注:A不同浓度的雨蛙素刺激AR42J细胞,RT-PCR检测Hedgehog亚基的mRNA变化,3个亚基都有不同程度升高,Shh升高最明显
2.2 Western-blot检测Shh蛋白水平
进一步检测表达最明显的Shh,发现和基因检测结果相似,Shh蛋白水平呈浓度依赖的升高,雨蛙素浓度在3 μM时蛋白水平最高(图1-B)。
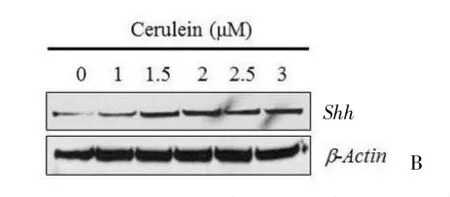
图1 RT-PCR和Western-blot检测Hedgehog的3个亚基
2.3 ELISA检测细胞上清Shh水平
不同浓度的雨蛙素诱导AR42J细胞后,检测细胞上清液,结果发现,与无雨蛙素刺激的正常AR42J细胞相比,雨蛙素刺激后,可溶性的Shh水平呈剂量依赖性的增加,3 μM时水平最高(图2)。
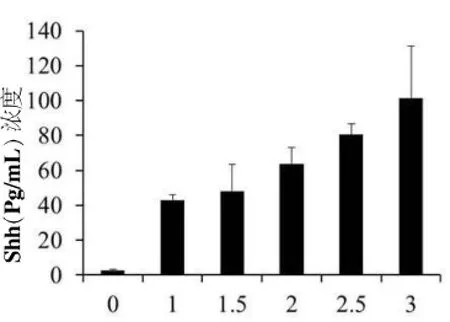
图2 ELISA检测Shh表达
2.4 RT-PCR检测Shh信号通路相关分子
为了探讨是否可溶性的Shh能激活Shh信号通路,在正常培养的AR42J细胞加入不同浓度的重组Shh(rShh)蛋白刺激,结果发现Shh,Gli1和Ptch1表达都明显升高,也呈浓度依赖性RT-PCR检测Shh信号通路分子mRNA表达(图3)。
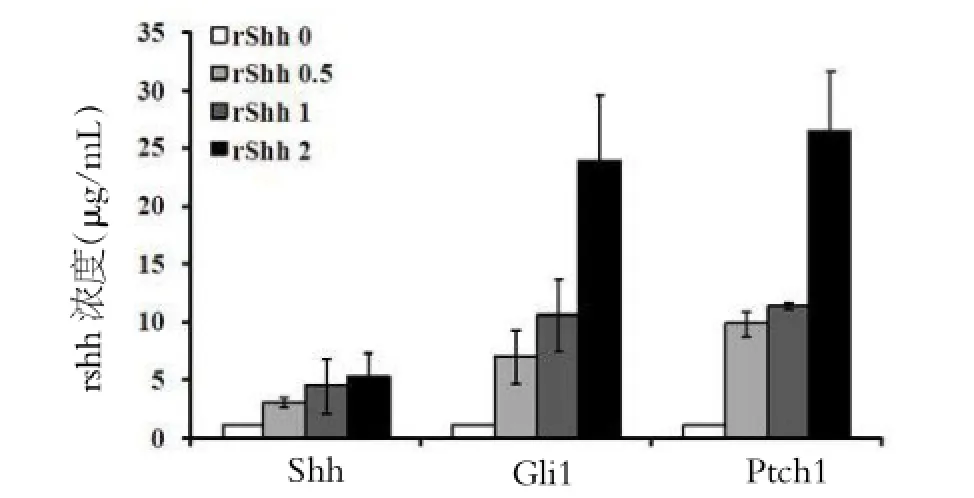
图3 重组rShh剂量依赖地促进Shh、下游Gli1和Ptch1分子表达
3 讨论
Hedgehog(Hh)信号分子是从果蝇体内分离的一种分节极性基因,哺乳动物和其他生物都广泛存在,主要由Hh配体Desert Hedgehog(Dhh),Sonic Hedgehog(Shh),Indian Hedgehog(Ihh)、两个膜受体Patched(Ptch)、Smoothened(Smo)及下游的转录因子Gli家族(Gli1,Gli2,Gli3)组成,在细胞分化、胚胎发育、器官形成、损伤修复和肿瘤等生理和病理过程中起重要的调节作用[3]。
研究表明,Hedgehog-Gli信号通路与胰腺关系密切。在胰腺发育过程中,Hh信号转导通路参与调控胰腺的正常发育,胰岛细胞、胰腺形态的发生都与之相关,在正常的成熟胰腺组织中无表达或仅轻度表达[4]。Hh表达的异常与胰腺慢性炎症的发生、发展密切相关[5]。而Hh信号是否参与急性胰腺炎(AP)的发病过程却少见报道。我们前期的体内研究发现,Shh在小鼠AP模型中表达明显升高。当前的研究即是进一步从体外模型探讨Shh在AP的表达变化。
目前公认AP发病机制是胰腺腺泡细胞中胰蛋白酶原被提前过度激活,说明胰腺腺泡细胞中在AP中起始动作用。大鼠AR42J胰腺腺泡细胞系具有胰腺腺泡细胞的绝大多数功能,而成为进行AP体外实验的标准细胞系。我们用不同浓度雨蛙素诱导AR42J细胞成功构建体外AP模型,首先探讨Hh的3个亚基的表达变化。结果发现,3个亚基Dhh,Shh,Ihh的mRNA表达不同程度的增加,且呈浓度依赖性增加,其中,Shh表达最明显。说明,AP发病过程中,Hh信号的亚基中,Shh是主要的参与者。我们进一步检查Shh蛋白水平,发现和基因水平相似,Shh蛋白水平也随雨蛙素浓度的增加而升高。由于Shh是一个分泌因子,为了探讨是否Shh上调与AR42细胞自分泌Shh有关,雨蛙素诱导细胞后,ELISA检测了细胞上清,发现可溶性的Shh水平呈剂量依赖性的增加。证实雨蛙素诱导胰腺腺泡细胞后,细胞自分泌Shh增加参与AP的发病过程。
为了探讨是否可溶性的Shh能激活Shh信号通路,我们在正常培养的AR42J细胞加入不同浓度的重组Shh(rShh)蛋白刺激,结果发现Shh,Gli1和Ptch1表达都呈浓度依赖性明显升高。说明可溶性的Shh可以激活Shh-Gli1-Ptch1信号轴,胰腺腺泡细胞是Shh信号通路的重要靶细胞。
有关Shh在急性胰腺炎症损伤过的具体作用,当前的研究无法证实。我们前期通过体内加入Hh的拮抗剂Cyclopamine,已经初步证实Shh可能起保护性的作用,具体的机制不清楚[2]。回顾文献,在组织急性炎症损伤过程中,Hh可能主要起保护性的作用,包括缓解缺氧,对抗氧化应激,减少细胞凋亡等。Agouni等[6]发现微粒携带的Shh可以诱导内皮细胞释放NO,促发NO信号相关的酶磷酸化和活化表达,减少反应性氧化物质的产生。相应的,特异性地抑制PI3激酶和ERK信号,Shh微粒的作用被抑制。在急性内皮损伤过程中,微粒携带的Shh是一种对抗内皮功能失衡的新手段。在肝脏缺血再灌注损伤过程,以及脂多糖诱导的急性肺损伤中,Shh可能是通过介导NO信号起保护性的作用[7,8]。Ji等证实大鼠脑缺血过程中,Shh通过提高超氧化物歧化酶(SOD1)活性,保护神经元对抗氧化应激,从而减轻缺血性脑损伤[9,10]。
当前的研究证实,Shh以自分泌的方式激活Shh-Gli1-Ptch1参与了急性胰腺炎的分子病理过程。我们推测,Shh可能在急性胰腺炎症损伤中起保护性的作用,接下来的研究,需要调控Shh信号,深入探讨具体的分子机制。
1.Mukherjee R,Mareninova OA,Odinokova IV,et al. Mechanism of mitochondrial permeability transition pore induction and damage in the pancreas:inhibition prevents acute pancreatitis by protecting production of ATP[J].Gut, 2015,12(10):1136.
2.杨辉,施森,郑英强,等.音猬因子信号通路在小鼠急性胰腺炎中的作用[J].中华实验外科杂志,2014,31(11):2434-2436.
3.Holtz AM,Griffiths SC,Davis SJ,et al.Secreted HHIP1 interacts with heparan sulfate and regulates Hedgehog ligand localization and function[J].J Cell Biol,2015,209(5):739-758.
4.Wilson CW,Chuang PT.Mechanism and evolution of cytosolic Hedgehog signal transduction[J].Development, 2010,137(13):2079-2094.
5.Tsang SW,Zhang H,Lin C,et al.Rhein,a natural anthraquinonederivative,attenuatestheactivationof pancreatic stellate cells and ameliorates pancreatic fibrosis in mice with experimental chronic pancreatitis[J].PLoS One, 2013,8(12):82201.
6.Agouni A,Mostefai HA,Porro C,et al.Sonic hedgehog carried by microparticles corrects endothelial injury through nitric oxide release[J].FASEB J,2007,21(11):2735-2741.
7.Zhou Y,Chen K,He L,et al.The Protective Effect of Resveratrol on Concanavalin-A-Induced Acute Hepatic Injury in Mice[J].Gastroenterol Res Pract,2015,10(1155): 506390.
8.YangY,LiQ,DengZ,etal.Protectionfrom lipopolysaccharide-inducedpulmonarymicrovascular endothelial cell injury by activation of hedgehog signaling pathway[J].Mol Biol Rep,2011,38(6):3615-3622.
9.Ji H,Miao J,Zhang X,et al.Inhibition of sonic hedgehog signaling aggravates brain damage associated with the down-regulation of Gli1,Ptch1 and SOD1 expression in acute ischemic stroke[J].Neurosci Lett,2012,506(1):1-6.
10.Jin Y,Raviv N,Barnett A,et al.The shh signaling pathway is upregulated in multiple cell types in cortical ischemia and influences the outcome of stroke in an animal model[J].PLoS One,2015,10(4):0124657.
(2015-09-08收稿)
Potential roles of autocrine Shh signal in caerulein-induced acute pancreatitis
Zhou Xiangyu1,Chen Xia2,Huang Juan3,Zeng Fancai41Department of Vascular and Thyroid Surgery,the Affiliated Hospital of Sichuan Medical University,2Department of Gastroenterology,the Affiliated Hospital of Sichuan Medical University,3Department of Pathology, the Affiliated Hospital of Sichuan Medical University,4Department of Cell and Biochemistry,Sichuan Medical University,Lu zhou 646000,Sichuan province,China
Objective:To investigate the potential roles of Hedgehog signal in caerulein-induced acute pancreatitis.Methods:Different doses of caerulein were used to induce acute pancreatitis in pancreatic acinar cell lines,AR42J.Cells and conditioned medium were collected after 24 hours.The expression of Shh was detected by RT-PCR and Western-blot respectively,and levels of Shh in conditioned medium were measured by ELISA.After treatment of AR42J cells with recombinant Shh N-terminal peptide,the expression of the hedgehog signaling components,Shh,Gli1,and Ptch1 were evaluated by RT-PCR.Results:Caerulein induced expression of Shh at both mRNA and protein levels in pancreatic AR42J cell lines in a dose dependent manner,so did the soluble Shh in the conditioned medium.Recombinant Shh stimulated the expression of the hedgehog signaling components,Shh,Gli1,and Ptch1.Conclusion:Caerulein up-regulated the expression of Shh in AR42J cells, and recombinant Shh stimulated the expression of hedgehog signaling components,Shh,Gli1,and Ptch1, suggesting autocrine Shh signal may contribute to the pathogenesis of acute pancreatitis.
Caerulein;AR42J;Acute pancreatitis;Sonic Hedgehog
Q576
A
10.3969/j.issn.1000-2669.2015.06.001
*国家自然科学基金资助项目(No:81100272),四川省科技厅基金资助项目(No:2014JY0004)
周翔宇(1977-),男,副教授,博士。E-mail:xiangyuzhou971@126.com
