一种改进的小鼠原代胰腺细胞的解离与培养方法
2023-10-27李万顺张德宇刘月吴畅彭立嗣李诗钰杨铮晖尹华金震东黄浩杰
李万顺 张德宇 刘月 吴畅 彭立嗣 李诗钰 杨铮晖 尹华 金震东 黄浩杰
海军军医大学第一附属医院消化内科,上海 200433
【提要】 本文介绍一种迅速、简便、产量大、操作难度小的小鼠胰腺腺泡细胞的分离方法,供胰腺基础研究者参考。
由于胰腺腺泡细胞解离时容易产生和分泌各种消化酶对自身进行消化[1],因此体外原代培养胰腺腺泡细胞非常困难。1972年,Amesterdam和Jamieson[2]发明了一种胰腺腺泡细胞分离并体外培养的方法,但该法操作复杂,且花费时间长。本课题组前期曾设计了一种有效的胰腺腺泡细胞原代培养方法[3],但产量较低,不利于后续实验的进行。本研究在此基础上通过改进,建立了一种在体外能快速简便地分离、培养胰腺腺泡细胞的方法,旨在为胰腺基础研究工作者提供参考。
一、材料与方法
1.实验材料:健康成年野生型C57BL/6黑鼠,体重23~28 g,雌雄不限,由海军军医大学实验动物中心提供,第一附属医院消化病研究所专人饲养,规律进食和饮水。解离液由Hanks平衡盐溶液(HBSS)加2.38 g/ml HEPES、200 U/ml胶原酶Ⅳ和0.25 mg/ml胰蛋白酶抑制剂混匀配成。缓冲液由HBSS加10%胎牛血清、0.25 mg/ml胰蛋白酶抑制剂和2.38 g/ml HEPES混匀配成。培养液由DMEM培养基加0.25 mg/ml胰蛋白酶抑制剂、10%胎牛血清、1%青霉素-链霉素混合物混匀配成。phadebas溶液用14 ml淀粉酶溶液溶解1粒phadebas amylase substrate药片配制,搅拌后使用。
2.方法:颈椎脱臼法处死小鼠,浸泡在医用酒精2 min后固定于超净工作台上。腹部消毒后从小鼠生殖器上部至横膈膜间剪开一个V形切口并翻开,将肝叶向上推以充分暴露胰腺和脾脏。用镊子夹住脾脏和胰腺连接处,拉出胰腺,再用无菌手术剪刀沿肠道边缘完整剪下胰腺。将胰腺放入装有50 ml HBSS的无菌聚丙烯管,去除漂浮的脂肪组织,夹出沉在管底的胰腺组织置于无菌培养皿中,用剪刀和手术刀将胰腺均匀切成1~3 mm的小块,然后移至50 ml无菌聚丙烯管内,4℃下20 g/min离心1 min,弃上层细胞碎片和血细胞,沉淀的胰腺碎块加入8 ml解离液移至细胞瓶内,置37℃培养箱内孵育30 min,每隔5 min用3 mm无菌巴氏管来回吹打胰腺碎片10次,并同时仔细观察胰腺状态。当胰腺组织被完全解离时,加入10 ml预冷的缓冲液终止反应,以防胰腺腺泡细胞被过度消化。再将其移入50 ml无菌聚丙烯管内,4℃下20 g/min离心1 min,小心吸弃上清后立即加入10 ml预冷的缓冲液重悬,再在4℃下以20 g离心1 min,吸弃上清,重复操作3次。将细胞颗粒重新悬浮于8 ml配好的培养液,并转入装有100 μm过滤器的50 ml离心管,静置过滤2 min,吸弃上清,沉淀即为原代胰腺腺泡细胞。将新鲜提取出来的原代腺泡细胞接种于6孔板分别培养1、2、4 d,置镜下观察腺泡细胞形态,以未培养的新鲜提取的原代腺泡细胞为对照,判断腺泡细胞的激活程度。

二、结果
1.原代培养腺泡细胞的形态变化:光镜下可见新鲜提取的腺泡细胞光滑且呈圆形,多悬浮在培养基的表面,3~7个集聚呈团状,周围无泡状物。细胞质较为清楚,内有大量酶原小颗粒广泛分布(图1A)。细胞碎片和杂质较少。培养1 d后,绝大部分细胞团周围有形态不规则的泡状物产生,此种泡状物为原代腺泡细胞激活后而分泌的含有活化的胰酶囊泡,且细胞周围分布有大量由原代腺泡细胞分泌的酶原小颗粒(图1B)。培养2 d后,泡状物增大并逐渐趋于圆形,细胞周围的囊泡也明显增多(图1C)。表明随着培养时间的延长,细胞的活化增强。但培养4 d后,部分原代腺泡细胞的细胞膜开始变得不完整,周边的囊泡也逐渐减少,表明细胞的分泌能力开始消失,细胞逐渐死亡(图1D)。提示本法提取出来的腺泡细胞能够在37℃、5% CO2条件下培养存活3~4 d,但培养2 d后,细胞的分泌能力和极性会随着时间的推移慢慢消失,最终腺泡细胞会转化为单层上皮样细胞并逐渐死亡。
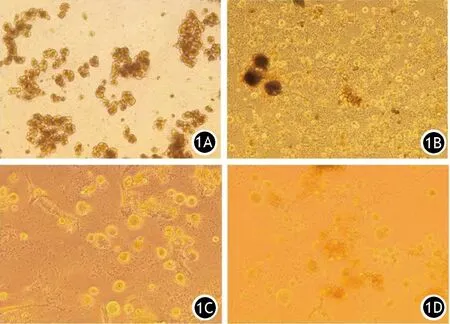
图1 新鲜提取的原代胰腺腺泡细胞(1A)及培养1(1B)、2(2C)、4(1D)d后的腺泡细胞形态变化(×40)
2.CCK-8刺激后腺泡细胞淀粉酶分泌水平的变化:以未加CCK-8刺激的腺泡细胞分泌的淀粉酶水平为0。CCK-8刺激后,腺泡细胞分泌的淀粉酶水平随CCK-8浓度的增加而升高。当CCK-8浓度为2.0 mmol/ml时,腺泡细胞分泌的淀粉酶水平达到峰值,约为未加CCK-8刺激组的80倍。随后腺泡细胞分泌淀粉酶水平下降(图2)。提示用此种解离方法解离的胰腺腺泡细胞自激活和受损情况非常轻微。

图2 不同浓度CCK-8体外刺激胰腺腺泡细胞30 min后的淀粉酶分泌曲线图
讨论腺泡细胞构成绝大部分的胰腺实质,其主要功能是产生和释放各种消化酶。目前认为,胰腺炎的发生与腺泡细胞受损密切相关[1-2,4]。以往已有研究证明,急性胰腺炎的发病机制可能是腺泡细胞自身过度激活,导致其体内的各种酶也被激活,然后对自身腺体进行消化[5],因而分离获取可靠和稳定的胰腺腺泡细胞,可以为胰腺炎的基础研究提供重要的工具。但是,无论是对胰腺腺泡细胞进行分离,还是对其进行体外培养,都较为困难。
在体外,腺泡细胞容易发生自激活,对自身造成损害,并且蛋白酶、钙离子等螯合剂也会破坏正常胰腺腺泡细胞。Dorrell等[6]用荧光激活细胞分选法(fluorescent activated cell sorting, FACS)对小鼠胰腺腺泡细胞、导管和内分泌细胞成功进行分离,但FACS不仅操作繁琐,且技术水平要求高,分选出来的腺泡细胞大多缺失部分初始结构。Gout等[7]使用含有HEPES、胶原酶Ⅰ和胰蛋白酶抑制剂的Hanks消化液对胰腺腺泡细胞进行分离,并且在培养液中加入表皮生长因子,在体外可培养7 d,但该法有3个明显缺陷:(1)分离的腺泡细胞会在体外逐渐转变为导管样细胞,导致24 h后无法对CCK-8做出有效的胰酶分泌反应。(2)Ⅰ型胶原酶容易导致腺泡细胞自激活,表现为在没有刺激情况下就能够观察到原代腺泡细胞周围有许多酶原颗粒小泡。(3)在进行功能学实验之前,需要将胰腺腺泡细胞培养1 d,换液之后才能够进行,前期准备工作复杂。上述方法较之传统分离方法而言,都有一定的进步,能够获得较为理想的胰腺腺泡细胞,但缺点在于损伤了胰腺腺泡细胞的部分功能,并且胰腺组织的消化也不够充分。鉴于此,本课题组前期曾提出一种腺泡提取并原代培养的方法,即采用胶原酶、胰蛋白酶抑制剂溶于DMEM细胞培养液消化小鼠胰腺,经过消化、水浴、重悬、过滤、沉淀等一系列操作,在2 h内分离出小鼠原代胰腺腺泡细胞[3]。但在实践中笔者发现,此法虽极大地减轻了胰腺腺泡细胞的自激活,但有两个局限性:(1)产量较低,一只成年C57小鼠仅仅能提取1×106个左右的腺泡细胞。(2)无法全部在细胞间和超净台内进行,易导致细胞污染。本研究采用的改进方法是用胶原酶Ⅳ和HEPES配置的HBSS混合溶液在细胞瓶内对胰腺进行消化,并联合吸管机械吹打进行解离,解离前后尽量减少离心时间和离心力,最后通过自然沉淀去除杂质。本法能够减少细胞碎片和杂质,降低胰腺腺泡细胞自激活,故获得的胰腺腺泡细胞可直接用来进行CCK-8或雨蛙素激活试验。该方法能够快速从小鼠胰腺成功分离得到较大量(1×107个)的较纯的原代未激活的胰腺腺泡细胞,且过程较其他方法更为简便经济。
利益冲突所有作者声明无利益冲突
