水飞蓟宾体外抑制MCF—7细胞的增殖和TGF—β诱导的侵袭转移
2015-05-30林峰佟鑫陈志杭
林峰 佟鑫 陈志杭

[摘要] 目的 探讨水飞蓟宾对人乳腺癌细胞MCF-7生长及侵袭转移的抑制作用。 方法 将人乳腺癌细胞MCF-7用不同浓度的水飞蓟宾处理后,采用MTT法检测水飞蓟宾对MCF-7细胞增殖的抑制作用;用transwell技术检测MCF-7细胞在TGF-β培养体系中水飞蓟宾对细胞侵袭力的影响; Western blot检测肿瘤侵袭力相关蛋白MMP9和vimentin的表达。 结果 培养48 h后,50 μmol/L水飞蓟宾组对MCF-7细胞的抑制率为(7.5±1.2)%,100 μmol/L水飞蓟宾组对MCF-7细胞的抑制率为(24.6±2.8)%,150 μmol/L水飞蓟宾组对MCF-7细胞的抑制率为(47.5±4.8)%, 200 μmol/L水飞蓟宾组对MCF-7细胞的抑制率为(65.5±5.2)%;对照组穿过transwell膜的MCF-7细胞数为(119.4±25.7)个,TGF-β组穿过transwell膜的MCF-7细胞数为(401.6±48.5)个,100 μmol/L水飞蓟宾+TGF-β组穿过transwell膜的MCF-7细胞数为(264.4±31.3)个;Western blot实验表明水飞蓟宾可降低MMP9和vimentin的表达。 结论 水飞蓟宾抑制人乳腺癌细胞的生长和侵袭转移。
[关键词] 水飞蓟宾;MCF-7;TGF-β;肿瘤侵袭转移
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2015)17-0001-03
乳腺癌的发生率和死亡率仅次于肺癌,而在女性群体中是发生率最高的恶性肿瘤,它的高转移性使之目前仍无法治愈[1],对于中晚期不能进行手术治疗的患者,药物治疗是首选的治疗方法,因此发展新的乳腺癌的治疗药物具有十分重要的意义。水飞蓟宾(Silibinin),是水飞蓟素(Silymarin)中最主要的生物活性成分,主要从植物奶蓟(Silybum marianum)中提取,临床上主要用于保肝护肝[2]。近些年来,水飞蓟宾还被发现具有抗肿瘤活性,对于多种肿瘤如结肠癌、乳腺癌等均具有良好抑制作用[3,4],然而其对人乳腺癌细胞生长和侵袭转移的抑制作用却很少报道。因此,作者通过研究水飞蓟宾对人乳腺癌细胞系MCF-7的生物效应,发现水飞蓟宾可以抑制乳腺肿瘤细胞的生长和侵袭转移。
1 材料与方法
1.1 实验材料
RPIM-1640培养基购于Gibco公司;胎牛血清购于杭州四季青生物工程有限公司;transwell小室购于美国康宁公司;水飞蓟宾、二甲亚砜、噻唑蓝(MTT)购于美国Sigma公司;β-actin、MMP9、vimentin抗体购自美国Cell signal公司;ECL试剂盒购于美国pierce公司。
1.2 方法
1.2.1 细胞培养 本实验从2013年5月开始至2014年12月为止。人乳腺癌细胞MCF-7细胞系购于ATCC(American Type Culture Collection,美国模式培养物研究所),培养在RPMI-1640培养基中,含10%胎牛血清,100 U/L青霉素和100 mg/mL链霉素,培养环境为37℃恒温且通入5%的CO2。
1.2.2 细胞增殖抑制试验 将MCF-7细胞按2×103/孔接种于96孔板,加入200 μL含10% FBS的RPIM-1640培养,设置3个复孔,并分别加入0、50、100、150、200 μmol/L的水飞蓟宾培养24、48、72 h,加5 mg/mL MTT 20 μL,继续培养4 h。弃上清,往孔中加150 μL DMSO,震荡使紫色絮状物完全溶解,570 nm波长下用酶标仪检测OD值,肿瘤细胞生长抑制率=(OD对照组-ODsilibinin)/OD对照组×100%。
1.2.3 肿瘤细胞侵袭试验 在transwell小室中接种1×104个MCF-7细胞置于24孔板中,上室培养基为无血清RPMI-1640培养基并加入2 ng/mL TGF-β及100 μmol/L水飞蓟宾,下室培养基为含10%胎牛血清的RPMI-1640。培养24 h后取出transwell小室,用生理盐水洗去小室内的细胞,将transwell膜用3%多聚甲醛固定15 min后用0.1%结晶紫染色20 min,低倍镜(100×)观察4个随机选择的区域,计算细胞总数。
1.2.4 Western blot试验 收集细胞,将细胞裂解后将蛋白提取液用12.5%的丙烯酰胺进行SDS-PAGE,之后将凝胶取下将蛋白转膜到PVDF膜(Millipore,USA)上。将膜在兔抗人MMP9或兔抗人vimentin一抗稀释液中孵育过夜,之后再带HRP酶活性的羊抗兔IgG二抗稀释液中孵育2 h,ECL试剂显色曝光。
1.3 统计学处理
采用Graphpad Prism 5软件进行作图,用SPSS10.0统计学分析软件进行处理,所有实验重复三次,实验数据用均数±标准差(x±s)表示,P值计算采用非配对双边t检验以及单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 水飞蓟宾对人乳腺癌细胞系MCF-7的体外抑制作用
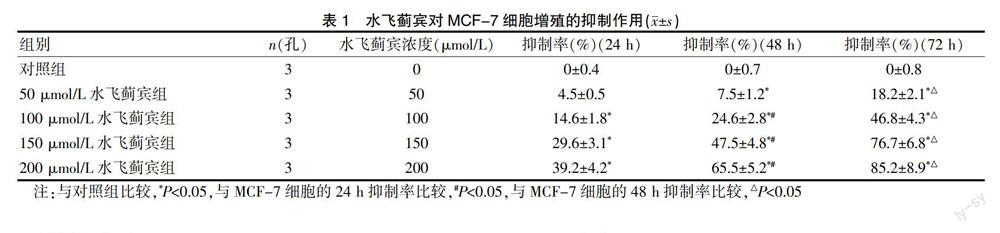
水飞蓟宾对MCF-7细胞有良好的体外抑制作用,实验数据表明随着水飞蓟宾浓度的增加,作用的时间的延长,水飞蓟宾的体外抗乳腺癌效果越明显,说明水飞蓟宾对乳腺癌细胞的杀伤呈剂量和时间依赖性,结果见表1、图1。
2.2 水飞蓟宾抑制TGF-β诱导的肿瘤侵袭转移
在TGF-β培养体系中加入水飞蓟宾培养24 h后,穿过transwell膜的MCF-7细胞数目显著下降(P<0.05),表明水飞蓟宾有体外抑制乳腺癌细胞侵袭转移的作用。见表2。
2.3 水飞蓟宾下调MCF-7细胞MMP9和vimentin的表达
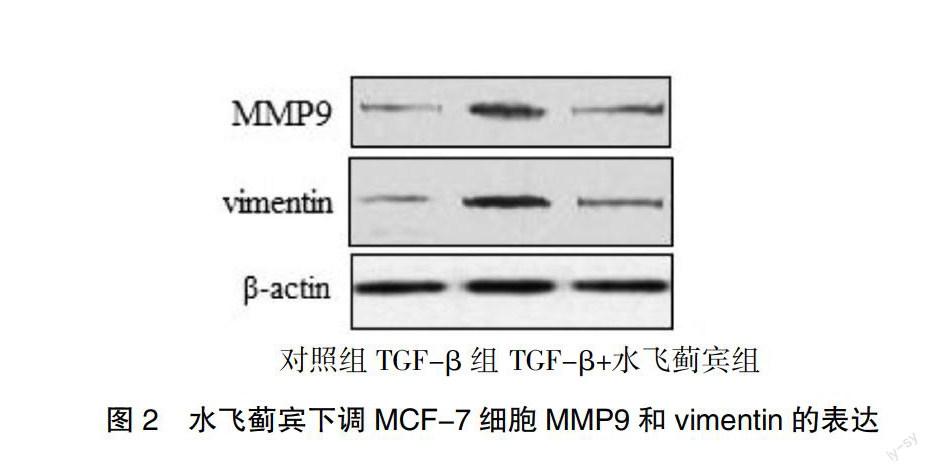
在TGF-β培养体系中加入水飞蓟宾培养24 h后,MCF-7细胞的MMP9和vimentin的表达相比于未加水飞蓟宾组显著下降,提示水飞蓟宾抑制乳腺癌细胞侵袭转移的机制可能是下调肿瘤细胞MMP9和vimentin的表达水平。见图2。
3 讨论
水飞蓟宾有十分广泛和强烈的药理活性,如水飞蓟宾能抑制肿瘤细胞DNA的合成,抑制肿瘤细胞的增殖并阻滞细胞周期,诱导肿瘤细胞发生凋亡等,对包括乳腺癌在内的多种肿瘤均有十分良好的治疗作用[5]。然而,水飞蓟宾抗肿瘤的具体机制至今仍不十分清楚,需要更多的实验研究。在本研究中,为了证实水飞蓟宾有体外抗乳腺癌作用,作者用从低剂量到高剂量的水飞蓟宾处理乳腺癌细胞系MCF-7,发现水飞蓟宾确实有显著的体外抗乳腺癌的药理活性,且处理时间越长、浓度越高,其对MCF-7细胞增殖的抑制作用越明显,表明水飞蓟宾对肿瘤细胞的杀伤作用呈剂量和时间依赖性。
乳腺癌致死率高的一个重要原因是乳腺癌细胞很容易发生转移[6],因此提高乳腺癌5年存活率的一个重要靶点就是抑制乳腺癌细胞的转移。癌细胞属于上皮细胞来源,然而在肿瘤发展过程中肿瘤细胞逐渐失去上皮细胞特征并获得间充质细胞特性,这一过程称之为上皮细胞间质转型(EMT)[7]。EMT是肿瘤侵袭转移的关键过程,是肿瘤的发展和致死的关键因素[8]。在EMT过程中,肿瘤微环境中的TGF-β是重要的调节因子,肿瘤的侵袭能力依赖于TGF-β的信号转导通路,当TGF-β与Ⅱ型TGF-β受体结合后激活Ⅰ型TGF-β受体,Ⅰ型TGF-β受体是一种跨膜丝氨酸/苏氨酸激酶,它能进一步使转录因子Smads2和Smads3发生磷酸化激活,进而上调间充质细胞骨架蛋白如波形蛋白(vimentin)及基质金属蛋白酶-9(MMP9)等促进肿瘤细胞侵袭正常组织并发生肿瘤转移[9-11]。在本研究中,为了进一步研究水飞蓟宾是否能抑制乳腺癌细胞的侵袭转移,作者将MCF-7细胞置于transwall上室中,并在上室培养基中加入适量TGF-β以模拟肿瘤生长的微环境。由于肿瘤在实际生长过程中会由于营养供应的限制,发生“饥饿”现象,因此上室培养基为无血清培养基,而在下室培养基中加入10%胎牛血清,肿瘤细胞会因此从低营养的上室往下室“迁移”[12]。
作者发现水飞蓟宾加入MCF-7细胞的培养体系后,MCF-7的转移能力受到显著抑制。这一实验结果表明水飞蓟宾不仅可以抑制乳腺癌细胞的增殖,更能抑制它们对周期组织进行侵袭和转移。为了研究水飞蓟宾抑制MCF-7细胞转移能力的分子机制,作者将MCF-7细胞用飞蓟宾处理后,用Western blot方法检测细胞转移相关蛋白vimentin和MMP9的表达水平,结果发现水飞蓟宾能显著降低乳腺癌细胞转移相关蛋白vimentin和MMP9的表达水平,提示水飞蓟宾可能通过下调MMP9和vimentin的表达从而抑制TGF-β诱导的肿瘤侵袭转移。
有文献报道很多天然药物具有十分显著的抗肿瘤作用,并且有高效、低毒、高肿瘤选择性的特点,有很大的研究价值[13,14]。水飞蓟宾是一种天然药物,在临床上已经大量应用,证实了它的低毒低副作用特性,而本研究则发现水飞蓟宾还具有十分良好的抗乳腺肿瘤细胞增殖的生物活性,此外,水飞蓟宾还能显著抑制TGF-β诱导的肿瘤侵袭效应,表明水飞蓟宾能减少乳腺癌细胞的侵袭和转移,对乳腺肿瘤患者的预后起到十分积极的作用。这些研究提示了水飞蓟宾可能在人乳腺癌治疗中有广阔的应用前景。
[参考文献]
[1] Siegel R,Naishadham D,Jemal A. Cancer statistics,2013[J].CA Cancer J Clin, 2013,63(1):11-30.
[2] Wang Y,Zhang L,Zhang D,et al. Recent advances in the nanotechnology-based drug delivery of Silibinin[J]. J Biomed Nanotechnol,2014,10(4):543-558.
[3] Akhtar R,Ali M,Sanyal SN,et al. Anti-proliferative action of silibinin on human colon adenomatous cancer HT-29 cells[J]. Nutr Hosp,2014,29(2):388-392.
[4] Oh SJ,Jung SP,Kim JH,et al. Silibinin inhibits TPA-induced cell migration and MMP-9 expression in thyroid and breast cancer cells[J]. Oncol Rep,2013,29(4):1343-1348.
[5] Cheung CW,Gibbons N,Nicol DL,et al. Silibinin-a promising new treatment for cancer[J]. Anti Cancer Agents Med Chem,2010,10:186-195.
[6] Zhu QC,Gao RY,Qin HL,et al. Epithelial-mesenchymal transition and its role in the pathogenesis of colorectal cancer[J]. Asian Pasific J Cancer Pre,2013,14(5):2689-2698.
[7] Zhao F,Wang M, Wu H, et al. DACH1 inhibits SNAI1-mediated epithelial-mesenchymal transition and represses breast carcinoma metastasis[J]. Oncogenesis,2015,4:e143.
[8] Xu J,Lamouille S,Derynck R. TGF-beta-induced epithelial to mesenchymal transition[J]. Cell Res,2009,19(2):156-172.
[9] Munger JS,Sheppard D. Cross talk among TGF-b signaling pathways,integrins,and the extracellular matrix[J]. Cold Spring Harb Perspect Biol,2011,3(11):a005017.
[10] Lampropoulos P,Zizi-Sermpetzoglou A,A. G. Papavassiliou,et al. TGF-beta signalling in colon arcinogenesis[J].Cancer Lett,2012,314(1):1-7.
[11] Sipos F,Galamb O. Epithelial-to-mesenchymal and mesenchymal-toepithelial transitions in the colon[J]. World J. Gastroenterol, 2012, 18(7):601-608.
[12] Dai J,Wang JY,Ruan QR,et al. Correlation of Forkhead Box c2 with subtypes and invasive ability of invasive breast cancer[J]. J Huazhong Univ Sci Technolog Med Sci,2014,34(6):896-901.
[13] Lachenmayer A,Alsinet C,Llovet JM,et al. Molecular approaches to treatment of hepatocellular carcinoma[J]. Digestive and Liver Disease,2010,42(Supplement 3):S264-S272.
[14] Song G,Luo Q, Shi Y,et al. Effects of oxymatrine on proliferation and apoptosis in human hepatoma cells[J]. Colloids and Surfaces B:Biointerfaces,2006,48(1):1-5.
(收稿日期:2015-03-11)
