毛蕊异黄酮体外转运研究及对多药耐药基因MDR1表达的影响
2015-05-24根黄旭军张信平徐江琳毛园清朱真程时刚
聂 根黄旭军张信平徐江琳毛园清朱 真程时刚
毛蕊异黄酮体外转运研究及对多药耐药基因MDR1表达的影响
聂 根1黄旭军1张信平1徐江琳1毛园清1朱 真2程时刚3
目的 研究毛蕊异黄酮在体外模型Caco-2模型的转运特征,及对多药耐药基因MDR1表达的影响。方法 采用MTT法确定毛蕊异黄酮对Caco-2模型作用的适用浓度范围;考察浓度、pH、温度及P-糖蛋白(P-gp)抑制剂(维拉帕米)和能量代谢抑制剂(叠氮化钠)对毛蕊异黄酮转运的影响;抑制多药耐药基因MDR1对毛蕊异黄酮转运的影响。结果 从上层(AP)到下层(BL),毛蕊异黄酮的Papp>10-6cm/s,表明吸收性良好;毛蕊异黄酮的转运与其浓度和时间呈正相关,4℃条件下毛蕊异黄酮的Papp与25、37℃下的Papp差异有统计学意义[AP→BL:(1.85±0.16)×10-6cm/s比(3.05±0.13)×10-6cm/s、(3.89±0.31)×10-6cm/s,P<0.01;BL→AP:(1.94±0.29)×10-6cm/s比(3.49±0.18)× 10-6cm/s、(4.06±0.26)×10-6cm/s,P<0.01];pH=9时的Papp与pH=5、7.4时的Papp值差异有统计学意义[(1.13±0.16)×10-6cm/s比(3.46±0.32)×10-6cm/s、(2.72±0.26)×10-6cm/s,P<0.01]。毛蕊异黄酮的转运不受MDR1基因的影响;毛蕊异黄酮的BL侧到AP侧和AP侧到BL侧的Papp比值<1.5,不受能量代谢影响。结论 毛蕊异黄酮在Caco-2模型的转运方式以被动扩散为主,不受P-gp和能量代谢的影响,且毛蕊异黄酮在低温和碱性环境下不利于其吸收。
毛蕊异黄酮;Caco-2细胞模型;多药耐药基因;被动扩散
黄芪味甘性微温,归肺、脾、肝、肾经;补气固表,托疮生肌;具有降低血液黏稠度、减少血栓形成、降低血压、保护心脏、抗缺氧、抗肿瘤、增强机体免疫力作用[1]。黄芪所含黄酮主要有效成分毛蕊异黄酮,具有提高免疫功能,增强抗氧化、抗辐射和抗癌作用,保护心脑血管、肝脏、肾脏和肺脏作用,保护脑细胞,降血脂、降血糖、减少糖尿病并发症等作用[2]。Caco-2(human colon androcarcinoma cell line)细胞模型是目前在国内外广泛应用的体外经典吸收模型,可提供药物透过小肠黏膜的吸收、转运、以及毒性等信息,已获得美国FDA批准用Caco-2细胞模型作药物吸收筛选模型[3-4]。本课题研究毛蕊异黄酮在Caco-2细胞模型的转运特性及其对多药耐药基因MDR1表达的影响,为毛蕊异黄酮药动学特征研究提供依据。
1 实验材料
1.1 药品与试剂 毛蕊异黄酮(南京泽朗生物有限公司,批号141020);二甲基亚砜(DMSO)、非必需氨基酸、L-谷氨酰胺、胰蛋白酶(含EDTA)、MTT(美国Sigma公司);DMEM培养基、胎牛血清(Gibco公司);High Pure RNA Isolation Kit、Transcrptor First Stand cDNA synthesis kit(Roche公司);超纯水。
1.2 仪 器 SW-C允-2D净化工作台(苏州净化设备有限公司);3111型CO2培养箱(Thermo Scientific公司);DMI4000B荧光倒置显微镜(德国徕卡公司);Agilent 1200 series高效液相色谱仪(德国Agilent公司);LDZ5-2型低速自动平衡离心机(北京立离心机有限公司);全自动酶标仪(BIO-RAD);Simplicity纯水仪(美国Millipore公司);Millicell-ERS电阻仪(美国Millipore Corporation公司);6、24、96孔细胞培养板、培养瓶(美国Corning公司);24孔Millicell转运孔(0.4μm,美国Millipore Corporation公司);荧光定量PCR仪(BIO-RAD);Eppendorf移液枪。
1.3 细 胞 Caco-2细胞,购自中国科学院上海细胞库,第25代。
2 实验方法
2.1 Caco-2细胞单层模型建立[5-6]将Caco-2细胞接种于6孔板并用DMEM高糖培养基(含20%胎牛血清、1%非必需氨基酸)在37℃、5%CO2恒温培养箱培养,隔天换液。当细胞生长至70%~80%的孔面积,传代。以1×105cells/mL的细胞浓度接种于Transwell小室中,上层(AP)与下层(BL)分别加0.5、1.5mL培养基,隔天换液,培养至21天左右,测定各孔跨膜电阻值>500Ω·cm2,表明Caco-2细胞单层已形成,可以用于以下实验。
2.2 MTT法确定药物安全浓度 将Caco-2细胞以1×105cells/mL细胞浓度接种于96孔板,在37℃、5% CO2恒温培养箱培养24h后,吸尽96孔板各孔培养液,加入浓度分别为20、40、80、120、160、200、300、400、600mg/L的毛蕊异黄酮溶液,空白对照孔加入空白培养液,置于培养箱中培养72h,各孔加5mg/mL的MTT溶液20μL,37℃下孵育4h。弃上清液,各孔加DMSO 180μL,振荡溶解结晶物,酶标仪490nm检测吸光度A值,空白调零,计算细胞存活率。取细胞存活率≥95%的毛蕊异黄酮浓度作为细胞安全浓度。
2.3 转运实验 取符合条件的Transwell孔,用37℃预热的Hanks液洗3遍,在37℃、5%CO2培养箱中温孵30min,弃Hanks洗液。用Hanks液配制浓度为50、100、150mg/L的毛蕊异黄酮药液。在AP侧→BL侧,AP侧分别加毛蕊异黄酮各浓度药液0.5mL,BL侧加Hanks液1.5mL;在BL侧→AP侧的转运中,AP侧加Hanks液0.5mL,BL侧分别加毛蕊异黄酮各浓度药液1.5mL。将转运孔板置于37℃、50r/min的恒温摇床上,于30、60、90、120min时间点从未加药侧取样200μL,同时补充相应体积的空白Hanks液,样品采用HPLC检测。
P糖蛋白(P-gp)抑制剂维拉帕米和能量代谢抑制剂叠氮化钠对毛蕊异黄酮转运的影响:分别用45mg/L维拉帕米和600mg/L叠氮化钠的Hanks液将细胞置于37℃、5%CO2培养箱孵育30min,弃废液,分别加100mg/L中浓度药液进行转运实验。
pH对毛蕊异黄酮转运的影响:Hanks液荡洗转运孔后,在AP侧加入pH=5、7.4、9的100mg/L中浓度药液进行转运实验。
温度对毛蕊异黄酮转运影响:37℃预热的Hanks液洗所有转运孔,加100mg/L中浓度药液,分别置于4℃、25℃和37℃摇床中进行转运实验。
2.4 毛蕊异黄酮HPLC测定方法 色谱条件:色谱柱Agilent Eclipse XDB-C18(规格:150mm×4.6mm,5μm);流动相乙腈-水(30∶70);体积流量1mL/min;检测波长260nm;柱温35℃;进样20μL。,
2.5 样品处理方法 样品12 000r/min离心15min,取上清,HPLC检测。
应用到肉制品中替代硝盐发色作用的多为天然色素,主要的为如红曲红、焦糖色素、亚硝基血红蛋白色素、番茄红素、植物提取物等,但其机理是上色,而能否作为替代物的关键为其色度和稳定性。
2.6 RT-PCR检测MDR1基因mRNA 引物序列MDR1(F):5’-GCCTGGCAGCTGGAAGACAAATAC-3’;MDR1(R):5’-ATGGCCAAAATCACAAGG GTTAGC-3’。β-actin(F):5’-TGGCACCCAGCACAATGAA-3’;β-actin(R):5’-CTAAGTCATAGTCCGCCTA GAAGCA-3’。
将Caco-2细胞分为不加药对照组、45mg/L维拉帕米阳性对照组和100mg/L毛蕊异黄酮组,给药后置于37℃、5%CO2培养箱培养72h。参照Transcrptor First Stand cDNA synthesis kit说明书:融解试剂,上下轻微颠倒混匀,短暂离心后放置冰上待用。在RNA-Primer Mix反应管中分别加入以下试剂:总RNA 2μL,Anchored-oligo(dT)18 primer 1μL,Water(PCR-grade)10μL,Transciptor Reverse Transcriptase Reaction Buffer 4μL,Protector RNase Inhibitor 0.5μL,Deoxynucleotide Mix 2μL,Transciptor Reverse Transcriptase 0.5μL,终体积20μL。轻弹管底将溶液混合,6000rpm短暂离心混匀。反应条件设置为55℃反应30min。反应结束后,85℃灭活处理5min,至冰上冷却,然后将cDNA样品放入-20℃下保存待用。
参照2×All-in-OneTM Q-PCR Mix说明书:融解试剂,上下轻微颠倒混匀,短暂离心后放置冰上待用。分别加入以下试剂:上游引物1μL,下游引物1μL,2×All-in-OneTM Q-PCR Mix10μL,First strand cDNA 2μL,ddH2O 6μL,终体积20μL。充分混匀反应液,封好热封膜,短暂离心,使所有试剂都甩至反应管底部。PCR条件为:起始94℃3min,扩增时94℃ 30s,61℃ 30s,72℃ 30s,扩增35个循环,并在65℃~95℃之间绘制溶解曲线。以β-actin作为内参,根据Bio-rad检测系统提供的Ct值,通过相对定量法(2-△△Ct法)计算MDR1mRNA表达水平,进行PCR扩增产物的实时定量分析。
2.7 统计学方法 表观渗透系数Papp值(计算公式如下)作为参考,进行数据统计分析。实验数据均以(±s) 表示,应用SPSS 13.0软件处理数据,不同组间两两比较采用LSD(最小显著性法)单因素方差分析(One-Way ANOVA)。Papp=(dQ/dt)(/A·C0)(注:dQ/dt为单位时间药物转运量,A为Caco-2细胞膜表面积,C0为初始给药物浓度)。
3 实验结果
3.1 Caco-2细胞培养 细胞接种于6孔板上,生长12、24、48、96h,显微镜观察结果发现细胞接种后12h就开始贴壁,随着培养时间延长,细胞生长均匀,边界清晰,培养48h后,贴壁70%以上,培养96h后细胞长满6孔板,并有部分开始死亡浮起,见图1(封二)。
3.2 毛蕊异黄酮安全给药浓度 MTT法计算细胞给药后存活率,毛蕊异黄酮在20~160mg/L浓度范围时细胞存活率在95%以上,确定毛蕊异黄酮对Caco-2细胞的安全给药浓度范围。
3.3 毛蕊异黄酮转运与浓度的关系 在同一时间,毛蕊异黄酮转运量与浓度呈正相关。BL→AP与AP→BL的 Papp均无显著性差异,PappBL→AP/PappAP→BL均<1.5,可推断毛蕊异黄酮以被动扩散为主,见表1、图2(封二)。
表1 毛蕊异黄酮在Caco-2细胞模型转运特性(±s)

表1 毛蕊异黄酮在Caco-2细胞模型转运特性(±s)
浓度(mg/L)50 100 150 Papp(×10-6cm/s)孔数333 AP→BL 2.32±0.41 3.11±0.36 3.90±0.67 BL→AP 2.85±0.86 3.35±0.87 4.10±0.85 PappBL→AP/PappAP→BL 1.23 1.08 1.05
3.4 pH对毛蕊异黄酮转运的影响 在介质pH分别为5、7.4、9的条件下,给药3h后,测定毛蕊异黄酮的转运量得到Papp分别为(3.46±0.32)、(2.72±0.26)、(1.13±0.16)×10-6cm/s,介质条件pH=9时,药物的Papp较pH5和7.4显著降低(P<0.01),毛蕊异黄酮在碱性环境下不利于吸收转运。见图3(封二)。
3.5 温度对毛蕊异黄酮转运的影响 温度影响蛋白的活性,可能影响药物在Caco-2细胞模型上的转运。在转运环境4、25、37℃时,毛蕊异黄酮的转运率Papp值差异均有显著差异,可见毛蕊异黄酮的转运受温度影响。见表2。
表2 温度对毛蕊异黄酮转运的影响(±s)

表2 温度对毛蕊异黄酮转运的影响(±s)
注:4℃、25℃、37℃两两比较,▲P<0.01,△P<0.01
温度(℃)4 25 37孔数Papp/(×10-6cm/s)333 AP→BL 1.85±0.16▲3.05±0.13▲3.89±0.31▲BL→AP 1.94±0.29△3.49±0.18△4.06±0.26△PappBL→AP/PappAP→BL 1.05 1.14 1.04
3.6 抑制剂维拉帕米与叠氮化钠对毛蕊异黄酮转运的影响 Caco-2细胞中P-gp是多药耐药基因调控的外排蛋白,而维拉帕米是P-gp抑制剂。叠氮化钠是非选择性的药物吸收的能量抑制剂,影响细胞的能量代谢。在加入维拉帕米和叠氮化钠共孵育30 min后,与未加抑制剂组进行各组毛蕊异黄酮Papp比较,结果显示无显著差异,说明毛蕊异黄酮的转运不受转运蛋白P-gp和能量消耗影响,见表3。
3.7 Rt-PCR检测MDR1基因表达 与对照组比较,45mg/L维拉帕米对MDR1表达有显著的下调作用(P<0.01),毛蕊异黄酮对MDR1表达没有影响,实验表明毛蕊异黄酮的转运不受P-gp的影响,见表4。
表3 抑制剂对毛蕊异黄酮转运的影响(±s)
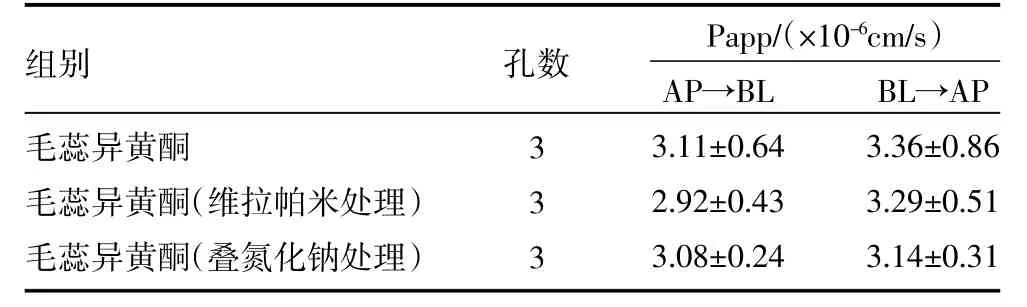
表3 抑制剂对毛蕊异黄酮转运的影响(±s)
组别毛蕊异黄酮毛蕊异黄酮(维拉帕米处理)毛蕊异黄酮(叠氮化钠处理)孔数Papp/(×10-6cm/s)333 AP→BL 3.11±0.64 2.92±0.43 3.08±0.24 BL→AP 3.36±0.86 3.29±0.51 3.14±0.31
表4 MDR1基因mRNA在各组表达(±s)
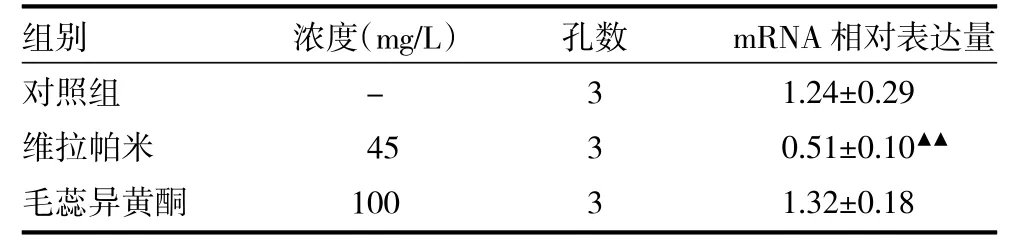
表4 MDR1基因mRNA在各组表达(±s)
注:与对照组比较,△△P<0.01
组别对照组维拉帕米毛蕊异黄酮浓度(mg/L)-45 100孔数333 mRNA相对表达量1.24±0.29 0.51±0.10▲▲1.32±0.18
4 讨论
毛蕊异黄酮是黄芪的主要有效成分,具有保护心脑血管、肝脏、肾脏和肺脏等作用,为了更好地开发利用,本实验通过Caco-2细胞模型,研究毛蕊异黄酮跨膜转运机制,为今后剂型改良及临床用药提供参考依据。
目前国际上对药物吸收难易有一个公认的判定标准,即根据即表观渗透系数(Papp)的大小来判断药物吸收情况,并进一步推导药物的生物利用度[7]:当Papp<1.0×10-6cm/s为吸收不良药物,吸收率在0%~20%;Papp在1.0×10-6cm/s~10×10-6cm/s为吸收中等药物,吸收率在20%~70%;Papp>10×10-6cm/s为吸收良好的药物,吸收率在70%~100%;从本实验的转运结果可知毛蕊异黄酮中等吸收药物,生物利用度一般。文献认为[8-9],Papp(AP→BL)与Papp(BL→AP)接近时,化合物以被动扩散方式转运;Papp(AP→BL)明显大于Papp(BL→AP)时,药物可以被小肠顶侧膜的转运载体所摄取;Papp(AP→BL)明显小于Papp(BL→AP)时,药物可被小肠顶侧膜的转运蛋白外排。根据美国FDA指导原则Papp(BL→AP)/Papp(AP→BL)≤1,转运药物可能不是P-gp的底物;Papp(BL→AP)/Papp(AP→BL)≥2,转运药物可能是P-gp的底物;Papp(BL→AP)/Papp(AP→BL)介于1.5~2时,转运药物需通过P-gp抑制剂进一步研究,进行评价。本实验中,毛蕊异黄酮从AP到BL及从BL到AP的转运量与时间和浓度呈正相关增加,毛蕊异黄酮Papp(BL→AP)与Papp(AP→BL)的比值为1~1.5,初步判定毛蕊异黄酮的转运方式为被动扩散,本实验结果与周乐等[10]研究的结果一致。
载体介导转运对温度非常敏感,温度对药物转运影响包括细胞膜上载体的活性、AP侧绒毛的运动的快慢、细胞本身的生长活性以及药物的溶解性等[11],本实验结果表明相同浓度下,4℃下毛蕊异黄酮的转运量明显降低。
不同肠段的pH可影响药物的存在状态,影响药物的溶解度等[12]。毛蕊异黄酮分子中含有酚羟基,碱性环境相对不利于毛蕊异黄酮吸收,本项目转运实验中得到了证实。
叠氮化钠可影响细胞能量代谢进而抑制药物吸收[13]。结果表明,加入叠氮化钠毛蕊异黄酮的转运量无显著变化。说明毛蕊异黄酮的吸收不耗能。
P-gp是多药耐药基因MDR1调控的主要外排蛋白,其主要功能是与底物结合后将其排出细胞[14]。本实验结果表明,维拉帕米能下调MDR1基因表达,降低细胞P-gp表达,但毛蕊异黄酮转运过程不受P-gp的外排。
本实验利用Caco-2模型研究毛蕊异黄酮体外吸收机制,毛蕊异黄酮的吸收以被动扩散为主,不受能量代谢和P-gp外排作用的影响,低温和碱性环境不利于其吸收。本实验研究为毛蕊异黄酮复方配伍药动学研究奠定基础。
[1]刘永琦,李金田,李娟,等.黄芪对肺纤维化大鼠Th1/Th2型细胞因子平衡及自由基代谢的影响[J].免疫学杂志,2009,3(12):210-215.
[2]李晶晶,崔国祯,王亮,等.毛蕊异黄酮对H9c2细胞缺糖缺氧损伤的保护作用[J].中药药理与临床,2014,5(2):1351-1355.
[3]郭慧玲,胡律江,胡志方,等.Caco-2细胞模型在中药成分吸收机制研究中的应用[J].江西中医药大学学报,2014,2(1):12-18.
[4]Li Y,Fawcett JP,Zhang H,et al.Transport and metabolism of some cationic ubiquinone antioxidants(MitoQn)in Caco-2 cell monolayers[J].Eur允Drug Metab Pharmacokinet,2008,33(4):199-204.
[5]杨雯,周惠芬,杨洁红,等.川芎嗪在Caco-2细胞单层模型的转运特征及对P-糖蛋白表达的影响[J].中草药,2013,44(5):581-585.
[6]周惠芬,杨雯,张宇燕,等.养阴通脑颗粒主要有效部位的转运研究[J].中国中药杂志,2012,37(20):3137-3140.
[7]Liang E,Chessic K,Yazdanian M.Evaluation of an accelerated Caco-2 cell permeability model[J].允Pharm Sci,2000,89(3):336-345.
[8]Huang CR,Wang GJ,Wu XL,et al.Absorption enhancement study of astragaloside IV based on its transport mechanism in Caco-2 cells[J].European允ournal of drug metabolismand pharmacokinetics,2006,31(1):5-10.
[9]Han Y,Tan TM,Lim LY.Effects of capsaicin on P-gp function and expression in Caco-2 cells[允].Biochemical Pharmacology,2006,71(14):1727-1734.
[10]周乐,赵晓莉,狄留庆,等.Caco-2细胞研究黄芪中活性成分毛蕊异黄酮的吸收转运[J].2014,9(23):453-459.
[11]姚媛,廖琼峰,谢智勇,等.新穿心莲内酯在Caco-2细胞单层模型中的吸收机制研究[J].中国实验方剂学杂志,2014,14(7):1754-1759.
[12]兰燕宇,刘跃,曹旭,等.杜仲提取物中4种主要成分在Caco-2细胞的摄取特性研究[J].中国药理学通报,2014,9(12):207-212.
[13]祝倩,郭宇星,潘道东,等.Caco-2细胞模型构建及抗高血压肽VPP和IPP小肠吸收机制研究[J].食品科学,2014,15(33):7-13.
[14]周鹏,周惠芬,何昱,等.羟基红花黄色素A在Caco-2细胞单层模型的转运研究[J].中草药,2014,45(14):2030-2035.
(收稿:2015-04-30 修回:2015-05-05)
Transport Characteristics of Calycosin and Its Effect on Multidrug Resistance Gene Expression in Vitro
NIE Gen1,HUANG Xujun1,ZHANG Xinping1,XU允iangling1,MAO Yuanqing1,ZHU Zhen2,CHEN Shigang3.1 ICU, Zhejiang Dongyang Hengdian Group Hospital,Dongyang (322118),China;2 Emergency Room,Hubei Provincial TCM Hospital,Wuhan (430060),China;3 Department of Surgery,Hubei Provincial Women and Children Hospital, Wuhan(430070),China
Objective To investigate the transport characteristics of calycosin across the Caco-2 cell monolayer and its effect on multidrug resistance(MDR1)gene expression.Methods Therapeutic concentration range of calycosin against Caco-2 cell monolayer model was determined by MTT method.The effects of concentration,pH,temperature,P-gp inhibitor(verapamil)and energy metabolism inhibitor(sodium azide)on the absorption of calycosin were assessed.The effect of the suppression of MDR1 on calycosin transport was evaluated.Results The Pappof calycosin transport from apical(AP)side to basolateral(BL)side was over 10-6 cm/s,which showed a good absorption.The transport of calycosin was positively correlated with time and concentration.The transport of calycosin was influenced by the change of temperature[AP to BL:(1.85±0.16)×10-6cm/s at 4℃ vs(3.05±0.13)×10-6cm/s at 25℃ and(3.89±0.31)×10-6cm/s at 37℃,P<0.05;BL to AP:(1.94±0.29)×10-6cm/s at 4℃ vs(3.49±0.18)×10-6cm/s at 25℃ and(4.06±0.26)×10-6cm/s at 37℃,P<0.05]and pH[(1.13±0.16)×10-6cm/s at pH=9 vs(3.46±0.32)×10-6cm/ s at pH=5 and(2.72±0.26)×10-6cm/s at pH=7.4,P<0.05].The transport of calycosin was not affected by MDR1 gene expression.The number of PappBL→AP/PappAP→BL was less than 1.5,indicating that energy metabolism did not play a role in calycosin transport.Conclusion The transport of calycosin across Caco-2 cell monolayer model is passive diffusion,and it is not influenced by the change of P-gp and energy metabolism.Low temperature and alkaline environment is not conducive to the absorption of calycosin.
calycosin;Caco-2 cell model;multidrug resistant gene;passive diffusion
1浙江省东阳市横店集团医院重症监护室(东阳 322118);2湖北省中医院急诊科(武汉 430060);3湖北省妇女儿童医院儿外科(武汉 430070)
聂根,E-mail:sun_ming_liang@126.com
